Cáncer de próstata , la enciclopedia libre
| Cáncer de próstata | ||
|---|---|---|
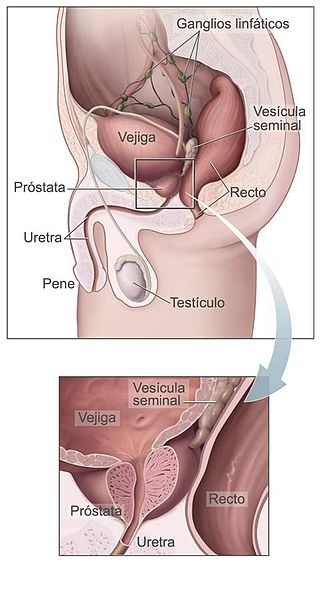 Ubicación de la próstata: diagrama anatómico. | ||
| Especialidad | oncología urología | |
| Síntomas | Ninguno, dificultad para orinar , sangre en la orina, dolor en la pelvis , la espalda o al orinar. | |
| Factores de riesgo | Edad avanzada, antecedentes familiares, etnia | |
| Diagnóstico | PSA, Biopsia de tejido , imágenes médicas. | |
| Tratamiento | Vigilancia activa , cirugía, radioterapia, terapia hormonal, quimioterapia[1] | |
Se denomina cáncer de próstata al que se desarrolla en uno de los órganos glandulares del sistema reproductor masculino llamado próstata. El cáncer se produce cuando algunas células prostáticas mutan y comienzan a multiplicarse descontroladamente. Estas también podrían propagarse desde la próstata a otras partes del cuerpo, especialmente los huesos y los ganglios linfáticos originando una metástasis. Esta afección puede causar dolor, micción dificultosa, disfunción eréctil, entre otros síntomas.
La enfermedad se desarrolla más frecuentemente en individuos mayores de 50 años. Es el segundo tipo de cáncer más común en hombres. Sin embargo, muchos hombres que desarrollan cáncer de próstata nunca tienen síntomas, ni son sometidos a terapia. Diversos factores, incluyendo la genética y la dieta, han sido implicados en su desarrollo, pero hasta la fecha (2005), las modalidades de prevención primaria conocidas son insuficientes para eliminar el riesgo de contraer la enfermedad.
Se han identificado 269 variantes genéticas de riesgo,[2] asociadas generalmente por igual con el riesgo de enfermedad agresiva y enfermedad no agresiva (no diferencia el riesgo de cáncer de próstata agresivo vs. no agresivo). Se han encontrado alteraciones o mutaciones en los genes AR, MYC, PTEN y BRCA2. El gen receptor de andrógenos (AR) está asociado con la insensibilidad a los andrógenos. MYC es un protooncogén y codifica una fosfoproteína nuclear que desempeña un papel en la progresión del ciclo celular, la apoptosis y la transformación celular. PTEN es un supresor tumoral multifuncional que se pierde con frecuencia cuando hay la presencia de cáncer. BRCA2 se lo ha relacionado con la susceptibilidad a desarrollar distintos tipos de cáncer entre ello el de próstata.[3][4]
El cáncer de próstata puede originarse en células luminales o células de origen neuroendocrino. El 95 % de los cánceres se originan de células secretoras luminales, mientras que solo el 1-5 % tienen un origen neuroendocrino. Las células luminales se caracterizan por expresar receptores de andrógenos mientras que las células basales tienen niveles muy bajos o no expresan andrógenos.[5]
La detección se lleva a cabo principalmente por la prueba en sangre del antígeno prostático específico, llamado PSA (acrónimo inglés de prostate-specific antigen) o por exploración física de la glándula prostática (tacto rectal). Los resultados sospechosos típicamente dan lugar a la posterior extracción de una muestra tisular de la próstata (biopsia), que es examinada en microscopio.
El tratamiento puede incluir cirugía, radioterapia, quimioterapia, o bien una combinación de todas. La edad y el estado de salud general del afectado, tanto como el alcance de la diseminación, la apariencia de los tejidos examinados al microscopio y la respuesta del cáncer al tratamiento inicial, son vitales en la determinación del resultado terapéutico.
Anatomía patológica e historia natural[editar]
Histología[editar]
Aunque la próstata está formada por muchos tipos de células diferentes, más del 99 % de los cánceres de próstata se desarrollan sobre células de una glándula. Las células secretoras glandulares, producen el líquido seminal que se secreta por la próstata. El término médico del cáncer que se origina en las células glandulares se denomina adenocarcinoma.
Debido a que los otros tipos de cáncer de próstata son muy raros, cuando se habla de cáncer de próstata, lo más probable es que se refiera a un adenocarcinoma. Es raro encontrar sarcomas, carcinoma de células transicionales, de células pequeñas, epidermoides o escamosos. La próstata puede ser asiento de metástasis, de cáncer de vejiga, colon, pulmón, melanoma, linfoma u otras neoplasias.
Crecimiento[editar]
La mayoría de los cánceres de próstata crecen muy lentamente y persisten durante mucho tiempo sin causar síntomas importantes. Los estudios de series de autopsias muestran que la mayoría de los hombres mayores que mueren por otras enfermedades, también tienen un cáncer de próstata que nadie había diagnosticado antes. Solo alrededor de un tercio de los casos que se descubren en necropsia se han manifestado clínicamente. Se desconoce igualmente si los tumores pueden volverse más malignos con el tiempo.
Neoplasia intraepitelial prostática[editar]
Algunos médicos creen que el cáncer de próstata procede de una lesión llamada neoplasia intraepitelial prostática (PIN). La PIN comienza a aparecer en los hombres a partir de los 20 años. Casi el 50 % de los hombres que tienen PIN alcanzan los 50 años. En esta situación hay cambios de apariencia microscópica (tamaño, superficie, etc.) de las células de la glándula prostática.
Estos cambios son clasificados como de bajo grado, lo que significa que se parecen bastante a las células normales, o de alto grado, lo que significa que son células muy alteradas y diferentes de las células normales. Si se diagnostica un PIN de alto grado por biopsia, existe de un 30 a 50 % de posibilidades de padecer también un cáncer de próstata. Por esta razón, los varones diagnosticados de un PIN de alto grado, son seguidos muy de cerca con biopsias de próstata periódicamente.

Los cilios desempeñan un papel causal en la génesis de los tumores. En algunos se requieren cilios para promover el cáncer, mientras que en otros entornos la pérdida de cilios aumenta la incidencia de tumores.[6]
Se observó pérdida de cilios primarios en muestras prostáticas preinvasivas (PIN; combinación de bajo grado (LG) y alto grado (HG)).
En el cáncer primario y las lesiones de invasión perineural existió una pérdida estadísticamente significativa de cilios primarios.[7]
Localización[editar]
El cáncer de próstata tiende a ser multifocal y con frecuencia afecta a la cápsula glandular. Al contrario que la hiperplasia benigna de próstata (HBP), el cáncer de próstata predomina en la periferia de la próstata. Ambas características (multifocal y periférico) hacen que la resección transuretral (RTU) no sea una forma de terapia curativa.
Prevención[editar]
Prevención primaria[editar]
La información actual sobre los factores de riesgo del cáncer de próstata sugiere que algunos casos pueden ser prevenidos. Un posible factor de riesgo que puede ser cambiado es la dieta, existiendo relación, por ejemplo, entre el consumo de polifenoles del vino tinto y una menor incidencia de este tipo de cáncer.[8] Cabe disminuir el riesgo de padecer este cáncer consumiendo una dieta baja en grasas y rica en verduras, frutas y cereales.
Parece que las vitaminas y los suplementos minerales pueden disminuir el riesgo de padecerlo. El mineral selenio puede reducir asimismo el riesgo. De todas formas, hay que consumir los suplementos vitamínicos con precaución. Es más recomendable una dieta ricamente variada con predominio de alimentos de origen vegetal que animal, que contienen todos estos micronutrientes y que actúan positiva y sinérgicamente.
Según T. Colin Campbell, en El Estudio de China, el consumo de lácteos está relacionado al cáncer de próstata.[9] Investigaciones realizadas en Harvard concluyeron que en doce de catorce estudios de diseño caso-control y siete de nueve estudios de cohortes demostraron una asociación positiva entre una determinada cantidad de productos lácteos y el cáncer de próstata. De acuerdo con los resultados, este es uno de los indicadores nutricionales más concordantes para el cáncer de próstata "en toda la literatura científica publicada". En estos estudios, los hombres que consumían mayor cantidad de productos lácteos tenían aproximadamente el doble de riesgo de contraer cáncer de próstata y un riesgo cuatro veces mayor de sufrir metástasis o un cáncer de próstata con consecuencias fatales, en comparación con aquellos que consumían poca cantidad de dichos alimentos.[10]
El Prostate cancer prevention trial es un ensayo clínico, que ha reclutado a más de 18.000 hombres mayores de 50 años, para determinar el efecto protector de una sustancia llamada finasterida, capaz de proteger la próstata de las hormonas masculinas, pudiendo reducir el riesgo de cáncer. A pesar de las expectativas creadas, la utilización de finasterida se asoció a una mayor frecuencia de efectos adversos de tipo sexual. Además, se observó que el grupo tratado con el medicamento mostró una mayor tasa de cánceres de próstata más agresivos,[cita requerida] un efecto científicamente plausible.[cita requerida] Cabe señalar, por último, que la prevalencia de cáncer prostático entre aquellos que tomaron placebo estaba muy por encima de lo esperado, obligando así a dudar de los resultados y aplicabilidad de dicho estudio.
Parece que los antiinflamatorios no esteroideos, como la aspirina y el ibuprofeno, tomados diariamente se asocian con una menor incidencia de cáncer de próstata en varones de 60 años o más, de acuerdo con algunos estudios.[11]
Detección precoz[editar]
A menudo puede ser detectado precozmente con la prueba del antígeno prostático específico (PSA) en sangre. También puede detectarse el cáncer de próstata precozmente cuando se realiza un tacto rectal. Debido a que la glándula prostática se localiza justamente delante del recto, con el tacto rectal se puede apreciar si hay nódulos o áreas de consistencia dura (leñosa) en la próstata que indican a menudo que existe un cáncer. Si estas pruebas se realizan anualmente de rutina y alguno de los resultados fuera anormal, tenemos la probabilidad de diagnosticar un cáncer en estado precoz.
La Sociedad Americana del Cáncer cree que los profesionales de la salud deberían ofrecer la prueba en sangre del antígeno prostático específico, llamado comúnmente PSA (prostate-specific antigen) y tacto rectal anualmente desde los 50 años, a los varones que tengan una esperanza de vida mayor de 10 años. Los hombres con alto riesgo, como los afroamericanos y los varones que tengan familiares de primer grado (padre, hermanos, tíos) diagnosticados de cáncer de próstata a edad temprana, deberían hacerse la prueba a partir de los 45 años.
Aunque sistemas de puntuación de riesgo genético (GRS) no predicen quién tiene más probabilidades de desarrollar una enfermedad agresiva (frente a una enfermedad no agresiva), pueden definir un subconjunto de hombres en el que se desarrollará una fracción sustancial de los casos agresivos: del 45 al 51% de todos los hombres con cáncer de próstata agresivo en estas poblaciones tienen un GRS en el 20% superior. Actualmente, la información genética no se incorpora al proceso de toma de decisiones para la detección con la prueba del antígeno prostático específico (PSA). Sin embargo, los hombres con un GRS alto pueden beneficiarse de un cribado más temprano y más frecuente, mientras que el conocimiento de un GRS bajo puede ayudar a reducir las biopsias innecesarias para los hombres con niveles límite de PSA en el cribado.
Los profesionales de la salud deberían facilitar a sus pacientes varones un diálogo abierto sobre los beneficios y riesgos de realizarse las pruebas anualmente. Los pacientes deberían participar activamente en esta decisión para aprender sobre el cáncer de próstata y los pros y contras de la detección precoz y su tratamiento.
El estudio de detección de cáncer de próstata, de pulmón, colorrectal y de ovario, financiado por el Instituto Nacional del Cáncer de los Estados Unidos, está diseñado para demostrar si ciertos exámenes de detección selectiva pueden reducir el número de muertes por estos cánceres. Este estudio está evaluando la utilidad de la detección precoz con tacto rectal y nivel de PSA en sangre en hombres de 55 a 74 años. Los resultados estarán disponibles a partir de 2010, cuando finalice el estudio.
Antígeno de Cáncer de Próstata-2[editar]
El Antígeno de Cáncer de Próstata-2 o APCP-2 es el más reciente descubrimiento realizado en la Universidad Johns Hopkins en Baltimore. Se trata de una proteína que se encuentra presente en el 90 % de los casos estudiados donde se confirmaba cáncer de próstata y en el 98 % de los casos donde este se había propagado más allá de ésta, quedando un relativo nivel de falsos negativos en comparación con la prueba del Antígeno Prostático. Por otro lado, presenta un bajo índice de falsos positivos, dado que tiene un 97 % de acierto cuando se trata de verificar que un paciente no sufre de cáncer de próstata. Estos hallazgos fueron publicados en la edición de mayo de Urology.
Antígeno prostático específico (PSA)[editar]
El antígeno prostático específico (PSA) es una sustancia proteica sintetizada por la próstata normal y cuya función es la disolución del coágulo seminal. Su producción depende de la presencia de andrógenos y del tamaño de la glándula prostática. Prácticamente es una proteína de síntesis exclusiva en la próstata. Una pequeñísima parte de este PSA pasa a la circulación sanguínea y es precisamente este PSA que pasa a la sangre el que se mide para el diagnóstico, pronóstico y seguimiento del cáncer de próstata. Los niveles en sangre de PSA en los varones sanos son muy bajos, del orden de millones de veces menos que el semen, y se elevan en la enfermedad prostática. Los valores de referencia para el PSA sérico varían según los distintos laboratorios, aunque normalmente éstos se sitúan en 4 ng/mL. El punto de corte de los niveles normales también aumenta según la edad del paciente. De esta forma, unos niveles de PSA séricos de 4 ng/mL pueden considerarse elevados en una persona de 50 años y ser normal en una de 80 años. Los niveles de PSA oscilan de forma aleatoria del orden de un 15 % en un mismo individuo. Así, un análisis de PSA de 3 ng/mL se puede repetir en otra ocasión y podría dar un resultado de 3,2 o 2,8 ng/mL de forma natural. En un paciente hospitalizado, los niveles pueden disminuir hasta un 50 %. Aunque el PSA es más abundante en el semen, una pequeña proporción se encuentra también en la sangre. La mayoría de los hombres tienen niveles de PSA por debajo de 4 nanogramos por mililitro de sangre. El nivel de PSA sérico es la prueba más sensible para detectar precozmente el cáncer de próstata, ya que se eleva en el 65 % de los casos aproximadamente.
Tacto rectal[editar]
Aunque el tacto rectal es menos efectivo que la prueba del PSA en sangre, para detectar cáncer de próstata en etapa inicial es indispensable que se realice como parte del examen físico, porque a veces se pueden palpar nódulos, induraciones, irregularidades o asimetrías en pacientes que tienen niveles normales de PSA y que requerirían de una biopsia para descartar o confirmar la presencia de un cáncer prostático. Por esta razón, las guías de la American Cancer Society recomiendan el uso conjunto tanto del tacto rectal como de la prueba del PSA en sangre para una detección precoz. El tacto rectal también se utiliza cuando se sabe que se tiene un cáncer de próstata, para clasificación del estado de la enfermedad y determinar, clínicamente, si el cáncer ha sobrepasado los límites de la glándula prostática o detectar recidivas después de un tratamiento.
Ecografía prostática transrectal[editar]
Se debe realizar cuando el tacto rectal es positivo o cuando el PSA esté elevado. Y ser ordenada conjuntamente con la biopsia transrectal de próstata. Este procedimiento, se lleva a cabo ambulatoriamente. Actualmente se realiza bajo anestesia (sedación) y requiere de preparación previa (antibióticos y enemas). La ecografía transrectal es el método más empleado para guiar la aguja que extraerá la muestra de tejido para la biopsia de la próstata. Los tumores de próstata y el tejido prostático normal ocasionalmente, reflejan ondas de sonido diferentes, los tumores, cuando se detectan ecográficamente aparecen como imágenes hipoecoicas por lo general alojadas en la periferia de la glándula. Sin embargo, la mayoría de los tumores prostáticos son isoecoicos, por lo que no se diferencian del tejido normal prostatitis. Por eso se utiliza la ecografía transrectal de próstata para guiar la aguja de biopsia y tomar muestras múltiples, en diferentes áreas de la glándula prostática, lo que se conoce como mapeo prostático, y adicionalmente realizar una biopsia de la lesión o nódulo que se detecte durante el estudio ecográfico de la próstata. La ecografía transrectal, por sí sola, es una técnica poco sensible e inespecífica para usarla como prueba de detección selectiva, por lo que la ecografía transrectal no se recomienda de rutina como prueba de detección precoz.
Diagnóstico[editar]
Si algunos síntomas o los resultados de las pruebas de detección precoz plantean la posibilidad de un cáncer de próstata, es obligatorio efectuar otras pruebas para decidir si la enfermedad está presente.
Signos y síntomas[editar]
El cáncer de próstata precoz normalmente no produce síntomas y se detecta por una elevación del PSA o realizando un tacto rectal. La presencia de síntomas es indicativo de que se halla en una fase avanzada. Entre los síntomas se encuentran: disuria, tenesmo vesical, polaquiuria y nicturia, retención de orina, goteo y hematuria terminal. El inicio brusco y la progresión rápida de los síntomas obstructivos urinarios en hombres del grupo de edad adecuado, tiene muchas probabilidades de ser causado por un cáncer de próstata.
Estadificación[editar]
El estadio o etapa de un cáncer es el factor más importante para elegir la opción de tratamiento más adecuada y predecir el pronóstico del paciente. Si se confirma un cáncer, es necesario practicar más pruebas diagnósticas para saber la extensión del cáncer dentro de la próstata y fuera de ella (en la vecindad de la próstata o en otras partes del cuerpo: enfermedad a distancia, diseminada o metastásica). Este proceso, llamado estadificación, ofrece información acerca del cáncer con varias pruebas para determinar la extensión del cáncer.
Los datos obtenidos del tacto rectal, nivel de PSA y puntuación Gleason permiten saber qué pruebas hacen falta para el estudio de extensión. Los hombres con tacto rectal normal, PSA bajo y puntuación Gleason baja, la mayoría de las veces no necesitan ninguna otra prueba más, porque la probabilidad de que el cáncer esté extendido fuera de la próstata es muy baja.
Exploración física[editar]
La exploración física, especialmente el tacto rectal, es una parte importante de la estadificación del cáncer de próstata. Con los datos del tacto rectal, se puede decir algunas veces si el cáncer solo está en un lado "lóbulo" de la próstata, si está presente en ambos lados y si tiene gran probabilidad de extenderse fuera de la glándula prostática. Se debe explorar si los surcos prostáticos están presentes o borrados y si se palpan o no las vesículas seminales (normalmente no se palpan). También hay que palpar los ganglios linfáticos inguinales en busca de adenopatías metastásicas (poco frecuentes). El tacto rectal siempre es usado junto con la prueba del PSA en sangre para la detección precoz del cáncer de próstata.
Imágenes[editar]
La resonancia magnética para la detección del cáncer de próstata[editar]
A partir de 2011, la resonancia magnética se utilizó para identificar los objetivos para la biopsia de próstata utilizando la resonancia magnética de fusión con ecografía o con la guía de resonancia magnética sola. Una resonancia magnética sola identificará correctamente al 91 % de los hombres con cáncer de próstata clínicamente significativo, pero clasificará erróneamente al 63 % de los hombres en riesgo de cáncer de próstata como pacientes con cáncer clínicamente significativo.[12] Una biopsia dirigida por resonancia magnética identificará correctamente al 80 % de los pacientes con cáncer de próstata. Sin embargo, clasificará al 6 % de los hombres con riesgo de cáncer como pacientes con cáncer clínicamente significativo.[12]
Después de una resonancia magnética, las regiones de interés dentro de la exploración que pueden ser cancerosas a menudo se clasifican en una escala de probabilidad entre 1 y 5. Una de esas escalas es la del sistema de datos e informes de imágenes de próstata (PI-RADS) que define los estándares del servicio clínico para la resonancia magnética multiparamétrica (mpMRI), incluida la creación y generación de informes de imágenes. La puntuación de PI-RADS versión 2 ha mostrado una especificidad y sensibilidad de 73 % y 95 %, respectivamente, para la detección del cáncer de próstata.[13]
Cuando se usa una resonancia magnética para decidir si se debe realizar una biopsia en hombres que han tenido una biopsia previa, es un 5 % más probable que haga un diagnóstico correcto que una biopsia estándar y es un 12 % más probable que sea correcta para los hombres que pueden o no haber tenido una biopsia previa.[12] En los hombres que tuvieron una biopsia negativa, esta combinación tiene un 44 % más de probabilidades de conducir a un diagnóstico correcto.[12]
El grado de propagación del cáncer se evalúa mediante resonancia magnética o exploración PSMA, una técnica de imágenes por tomografía por emisión de positrones (PET) en la que se utiliza un marcador radiactivo que se une a la proteína prostática, el antígeno de membrana específico de la próstata, para detectar metástasis distantes de la próstata. También se pueden utilizar tomografías computarizadas, pero son menos capaces de detectar la diseminación fuera de la próstata que la resonancia magnética. La gammagrafía ósea se utiliza para detectar la diseminación del cáncer a los huesos.[14]
Tratamiento[editar]
El tratamiento del cáncer de próstata se rige por la información científica disponible que se adapta al sistema sanitario y a los recursos económicos de cada región o país. Debe ser individualizado y considerar muchos factores, sobre todo:
- La edad y la expectativa de vida.
- Las preferencias del paciente con respecto a los efectos secundarios asociados a cada tratamiento.
- Cualquier enfermedad grave que padezca el paciente.
- El estado y el grado del cáncer.
- La probabilidad de que cada tipo de tratamiento sea curativo.
Con los datos del PSA, puntuación Gleason y el estadio clínico T (Tablas de Partin), se puede calcular la probabilidad de que el cáncer de próstata sea:
- Enfermedad de órgano confinada.
- Extensión extraprostática (rotura capsular).
- Invasión de vesículas seminales.
- Invasión de los ganglios linfáticos pélvicos.
Es una costumbre muy extendida en los Estados Unidos (y que cada vez tiene más importancia en España) que el paciente pida una segunda opinión acerca de la mejor opción de tratamiento, según cuál sea su situación, especialmente si hay varias opciones disponibles. El paciente debe sopesar, junto con su urólogo y su familia, los beneficios de cada uno de los tratamientos y también los posibles efectos secundarios y riesgos.
Conducta expectante[editar]
Si el cáncer no provoca ningún síntoma, crece muy lentamente y es muy pequeño, confinado en una pequeña área de la próstata, se recomienda mantener una conducta expectante. En determinadas circunstancias ésta puede ser la mejor opción. Este tipo de tratamiento se reserva generalmente a varones mayores de 80 años. Debido a que el cáncer de próstata a menudo crece muy despacio, si el paciente es mayor o padece otras enfermedades graves, no es necesario tratarlo. Algunos hombres eligen esperar y ver, porque no quieren padecer los efectos secundarios de los tratamientos agresivos.
Mantener una conducta expectante no significa que el paciente no vaya a recibir ningún cuidado médico o seguimiento. Todo lo contrario, el cáncer va a ser observado y monitorizado. Normalmente se realizan determinaciones del PSA en sangre y tacto rectal cada seis meses, posiblemente con biopsia guiada por ecografía transrectal anualmente. Si el paciente desarrollara cualquier síntoma o el cáncer creciera más rápidamente, se tiene que considerar pasar a un tratamiento activo.
Actualmente se está desarrollando un gran estudio patrocinado por el National Cancer Institute y el Veterans affairs cooperative studies program para aclarar cómo el tratamiento activo afecta a la supervivencia y a la calidad de vida de los pacientes con cáncer de próstata en diferentes edades, llamado PIVOT (acrónimo inglés de Prostatic Intervention Versus Observation Trial).
Cirugía[editar]
La prostatectomía radical es la cirugía que se realiza con la intención de curar el cáncer de próstata. Tradicionalmente, la cirugía se ha efectuado en varones menores de 70 años. Se lleva a cabo más a menudo cuando el cáncer no ha sobrepasado los límites de la glándula prostática (estadios T1 o T2). En esta operación, el urólogo trata de curar el cáncer extirpando la glándula prostática. Para realizarlo, los cirujanos solían hacer una incisión en la parte inferior del abdomen para tomar la próstata, este procedimiento se llama prostatectomía radical abierta (ORP). Recientemente los cirujanos comenzaron a utilizar la prostatectomía radical laparoscópica (PRL), la cual se realiza mediante laparatomía suprapúbica, que es la técnica de referencia o patrón oro actualmente por ser una cirugía menos invasiva y con resultados similares.[15] Una variante es la prostatectomía radical robótica, con el uso del robot Da Vinci, que consigue resultados similares con menor requerimiento transfusional.[16]
Radioterapia[editar]
La radioterapia usa rayos X de alta energía (megavoltaje) o partículas para eliminar células cancerosas. La radiación trata el cáncer de bajo grado que está confinado en la próstata o que solo ha invadido tejido vecino. Las tasas de curación de la radioterapia son similares a las obtenidas con la prostatectomía radical. Si la enfermedad está más avanzada, la radiación puede usarse para disminuir el tamaño del tumor y proporcionar alivio de síntomas actuales o futuros. Tradicionalmente se ha reservado la radioterapia como tratamiento de primera línea en los varones entre 70 y 80 años de edad con cáncer de próstata y con otros problemas de salud que contraindican la cirugía.
Braquiterapia de baja tasa[editar]
La braquiterapia de baja tasa de dosis es un tratamiento mínimamente invasivo que consiste en el implante de ínfimas fuentes radiactivas (semillas), generalmente de Paladio o I-125, directamente en la próstata. Con resultados iguales o mejores que la cirugía radical y la radioterapia externa en el tratamiento del cáncer de próstata localizado de bajo riesgo, presenta una menor morbilidad y mejores índices de calidad de vida del paciente, tal como lo acreditan los estudios del Prostate Cancer Results Study Group (PCRSG)[17] y del Prostate Cancer Center of Seattle.[18]
Criocirugía[editar]
La criocirugía, también llamada crioterapia o crioablación, se emplea algunas veces para tratar el cáncer de próstata localizado, destruyendo por congelación las células tumorales con una criosonda metálica.
A través de una sonda vesical se hace circular agua salada tibia para protegerla de la congelación. La sonda de metal se introduce en la próstata a través de una pequeña incisión en la piel del periné guiada por ecografía transrectal. Se requiere anestesia epidural o general durante este procedimiento. En España son aún pocos los centros altamente especializados donde se practica la crioterapia.
Ultrasonido focalizado de alta intensidad (HIFU)[editar]
Una de las muchas aplicaciones de la tecnología HIFU es para tratar el cáncer localizado de próstata, usando ultrasonidos focalizados de alta intensidad (en inglés "HIFU"). La energía se libera a partir de una sonda endorrectal. Las ondas de ultrasonidos viajan a través de las paredes del recto sin dañarlo y son focalizadas en la próstata. Esta focalización produce un calentamiento intenso e instantáneo que provoca la destrucción irreversible de la zona seleccionada, sin dañar los tejidos circundantes. El tratamiento, que dura de 1 a 3 horas, puede llevarse a cabo bajo anestesia epidural. Esta opción terapéutica actualmente ya no se considera como experimental.
Bloqueo hormonal androgénico[editar]
El objetivo del tratamiento hormonal es disminuir los niveles de hormonas masculinas, los andrógenos. El principal andrógeno se llama testosterona. Los andrógenos, producidos sobre todo en los testículos, promueven el crecimiento de las células cancerosas de la próstata. Cuando los niveles de andrógenos son bajos, los cánceres de próstata se reducen y crecen más lentamente. Pero el tratamiento hormonal no cura el cáncer ni es substitutivo de un tratamiento curativo.
El tratamiento hormonal puede ser usado en varias situaciones:
- Como primera línea (tratamiento inicial o primario o principal) si el paciente no está preparado para una cirugía o radioterapia o no puede ser curado con estos tratamientos porque el cáncer ha sobrepasado los límites de la próstata.
- Después de un tratamiento inicial, como cirugía o radioterapia, si el cáncer persiste o hay recaída.
- Junto con radioterapia como tratamiento inicial (terapia adyuvante) en ciertos grupos de hombres que tienen alto riesgo de recurrencia.
- Algunos médicos están ensayando el tratamiento hormonal antes de la cirugía o radioterapia (tratamiento neoadyuvante), con el objetivo de reducir el cáncer y poder hacer el tratamiento primario más efectivo. La efectividad de este procedimiento todavía no está demostrada, pero parece que es superior con radioterapia.
- Algunos médicos piensan que el tratamiento con bloqueo hormonal es más efectivo si se empieza tan pronto como sea posible, una vez que el cáncer se ha diagnosticado en un estadio avanzado, pero no todos los médicos están de acuerdo.
- Tradicionalmente se ha reservado al bloqueo androgénico completo para varones mayores de 80 años con cáncer de próstata sintomático o avanzado.
Además, cuando el cáncer de próstata es metastásico y se hace resistente al tratamiento hormonal por la adquisición de mutaciones durante el mismo por la terapia dirigida al receptor androgénico, surge la necesidad de desarrollar nuevas terapias dirigidas a la señalización de este receptor. Los agentes emergentes de atención estándar e investigación, como 177Lu-PSMA617, degradadores de la proteína del receptor de andrógenos e inhibidores del dominio N-terminal de este receptor, ofrecen estrategias renovadas para explotar la dependencia de la señalización del RA. Asimismo, es esencial que los fármacos se administren sobre una base de deprivación continua de andrógenos. [19]
Quimioterapia[editar]
Algunas veces se recurre a la quimioterapia si el cáncer de próstata está extendido fuera de la glándula prostática y el tratamiento hormonal no hace efecto (hormonorresistencia). En la “quimioterapia sistémica” se administran fármacos por vía intravenosa o por vía oral, los cuales entran en el torrente sanguíneo y alcanzan todas las partes del cuerpo, haciendo que este tratamiento sea potencialmente eficaz en los cánceres que han metastatizado (que se han extendido hacia órganos distantes de la próstata).
El objetivo de este tratamiento no es eliminar todas las células cancerosas, pero puede disminuir el crecimiento del cáncer y reducir el dolor. Se obtiene respuesta parcial objetiva entre el 10 y el 40 % de los casos. La quimioterapia no está indicada como tratamiento en caso de cáncer de próstata precoz.[20][21]
Tratamiento paliativo[editar]
La mayoría de los tratamientos anteriores tienen por finalidad eliminar o destruir las células del cáncer de próstata, o ralentizar su crecimiento. También es un objetivo muy importante cuidar de la “calidad de vida” del paciente, intentando eliminar, o disminuir, el dolor y otros síntomas que afligen al paciente. Algunos métodos muy efectivos para lograrlo son:
- Con analgésicos, especialmente opioides.
- Con bifosfonatos, sustancias que pueden aliviar el dolor causado por metástasis óseas y también enlentecer el crecimiento de estas metástasis. El ácido zoledrónico (Zometa) es el primer bifosfonato recientemente aprobado para el uso de las metástasis óseas del cáncer de próstata.
- Con esteroides, como la prednisona y la dexametasona, pueden aliviar el dolor de huesos en algunos hombres con cáncer de próstata metastásico.
- Con radioterapia. Tanto con radioterapia externa como con radiofármacos se puede calmar el dolor óseo.
Algunos estudios han demostrado que los pacientes que reciben un buen tratamiento analgésico se sienten mejor, viven más tiempo y pueden realizar sus actividades con más normalidad.
Opciones según estadio[editar]
El estado del cáncer de próstata es uno de los factores más importantes para decidir el tratamiento más idóneo. Las opciones de tratamiento están basadas en el sistema AJCC (TNM):
- Estadio I: Si el paciente no presenta ningún síntoma, es mayor o tiene algún problema importante de salud, mantener una conducta expectante puede ser la mejor opción. Si el paciente es joven y presenta buen estado de salud, hay que considerar la prostatectomía radical o la radioterapia, especialmente si la puntuación Gleason o el PSA no es muy baja.
- Estadio II: Por su tendencia a mayor crecimiento y síntomas, se suele ofrecer (según la edad y estado de salud): prostatectomía, radioterapia, braquiterapia o terapia combinada.
- Estadio III: Puede tomarse una conducta expectante para los hombres mayores en los que el cáncer no produce síntomas o que tienen problemas importantes de salud, manteniendo las opciones del estadio II, sumando la terapia de supresión androgénica sola o en combinación con otros tratamientos.
- Estadio IV: En esta etapa se encuentran las siguientes opciones paliativas: tratamiento de supresión androgénica, radioterapia, resección transuretral (paliativa) y otros tratamientos para disminuir los síntomas provocados por las metástasis. Los bifosfonatos pueden usarse para las metástasis óseas y puede ofrecerse quimioterapia en casos seleccionados.
Metástasis y alteraciones genéticas[editar]

Se ha observado en un estudio de comparación genómica pan-cáncer entre tumores primarios y metastásicos que el cáncer de próstata experimenta cambios significativos en su paisaje genómico durante las etapas avanzadas de la enfermedad.[22]El cáncer de próstata metastásico mostró una mayor clonalidad en comparación con el cáncer primario, lo que sugiere una evolución hacia subclones más dominantes en etapas metastásicas. También se observaron cambios sustanciales en los perfiles de aneuploidía cromosómica en las muestras metastásicas, incluyendo el marcador de mal pronóstico de ganancia de 8q [23]y diferentes pérdidas en brazos cromosómicos. Además, hubo un aumento significativo en la carga de mutaciones tumorales (TMB) en el cáncer metastásico comparado con el primario. Estos cambios podrían estar relacionados con la progresión de la enfermedad y la resistencia a tratamientos. Concretamente, se identificaron mutaciones específicas en tumores metastásicos que parecen estar relacionados con la resistencia a terapias específicas, como mutaciones en el gen AR que podrían estar relacionadas con resistencia a terapias de deprivación de andrógenos. Esta información podría ser crucial para el desarrollo de estrategias de tratamiento más efectivas.
El cáncer de próstata debido a la dependencia por las vías reguladas mediante receptores de andrógenos tiene alta progresión y metástasis en el hueso como a nivel de ganglios linfáticos. Estudios genómicos en cáncer prostático metastásico han identificado alteraciones en vías de señalización y diferentes genes alterados como AR, TP53, RB1, PTEN entre otros.[3] La pérdida de PTEN junto con la desregulación transcripcional de MYC pueden sinergizarse para inducir inestabilidad genómica y cáncer de próstata agresivo. En un estudio usaron un modelo de ratón genéticamente diseñado con deficiencia de PTEN/TP53 y mostró que la eliminación de PTEN y TP53 activó la metástasis y estas lesiones mostraron la activación de MYC en ausencia de la activación de AKT.[24] Son varios los genes involucrados en el proceso de carcinogénesis de la próstata de tal manera que es fundamental estudiar las vías de señalización involucradas en el desarrollo de dicho tumor. Otro gen que se encuentra alterado frecuentemente es RB1, que esta implicado en la regulación del ciclo celular y en la regulación transcripcional de genes de puntos de control mitóticos. La pérdida de función de RB1 desencadena la desregulación de la expresión de procesos transcripcionales mediados por hipoxia caracterizados por angiogénesis y metástasis. En un modelo de ratón, suprimiendo a RB1 facilitó la metástasis del adenocarcinoma prostático iniciado por la mutación de PTEN, y la pérdida adicional de TP53.[24]
El cáncer de próstata metastásico desencadena problemas óseos que deben ser caracterizados patológicamente y a nivel molecular mediante biopsias óseas. Sin embargo, la obtención de biopsias óseas es incómoda y difícil de realizar, y en la mayoría de las ocasiones se obtienen cantidades muy pequeñas que no son adecuadas para los análisis moleculares. En la actualidad, ha revolucionado la forma de análisis moleculares y genómicos, optando por biopsias líquidas, es decir análisis de sangre de pacientes con cáncer de próstata que ayudan a indagar la heterogeneidad y la evolución clonal a lo largo del tiempo de una terapia.[3] En concreto, se toman muestras del ADN circulante tumoral de los pacientes y se analizan las mutaciones mediante secuenciación del genoma completo (Whole genome sequencing). Se trata de una técnica mínimamente invasiva que detecta los mecanismos genómicos de resistencia.[19]
Véase también[editar]
- Cáncer
- Carcinógeno
- Medicina basada en la evidencia
- Medicamento citostático
- Abiraterona
- Masaje prostático
- Oncología
- Quimioterapia
- Tabaquismo
- Virus y cáncer
Referencias[editar]
- ↑ «Prostate Cancer Treatment (PDQ®)–Patient Version - NCI». www.cancer.gov (en inglés). 23 de mayo de 2022. Consultado el 26 de julio de 2022.
- ↑ V.Conti, David; F.Darst, Burcu (4 de enero de 2021). «Trans-ancestry genome-wide association meta-analysis of prostate cancer identifies new susceptibility loci and informs genetic risk prediction». Nature Genetics 53 (1). PMC 6429226. PMID 30823649. doi:10.1038/s41588-020-00748-0. Consultado el 27 de diciembre de 2021.
- ↑ a b c Ramesh, Naveen; Sei, Emi; Tsai, Pei Ching; Bai, Shanshan; Zhao, Yuehui; Troncoso, Patricia; Corn, Paul G.; Logothetis, Christopher et al. (6 de julio de 2020). «Decoding the evolutionary response to prostate cancer therapy by plasma genome sequencing». Genome Biology 21. ISSN 1474-7596. PMC 7336456. PMID 32631448. doi:10.1186/s13059-020-02045-9. Consultado el 28 de diciembre de 2020.
- ↑ «GeneCards - Human Genes | Gene Database | Gene Search». www.genecards.org. Consultado el 3 de enero de 2021.
- ↑ Costea, Teodora; Nagy, Péter; Ganea, Constanța; Szöllősi, János; Mocanu, Maria-Magdalena (1 de marzo de 2019). «Molecular Mechanisms and Bioavailability of Polyphenols in Prostate Cancer». International Journal of Molecular Sciences 20 (5). ISSN 1422-0067. PMC 6429226. PMID 30823649. doi:10.3390/ijms20051062. Consultado el 5 de enero de 2021.
- ↑ Sunny Y Wong; Allen D Seol; Po-Lin So; Alexandre N Ermilov; Christopher K Bichakjian; Ervin H Epstein Jr; Andrzej A Dlugosz; Jeremy F Reiter (2009). «Primary cilia can both mediate and suppress Hedgehog pathway–dependent tumorigenesis». Nature Medicine 15: 1055-1061.
- ↑ Hassounah N.B.; Nagle R.; Saboda K.; Roe D.J.; Dalkin B.L. (2013). «Primary Cilia Are Lost in Preinvasive and Invasive Prostate Cancer.». PLoS ONE 8 (7): e68521. doi:10.1371/journal.pone.0068521. Consultado el 16 de febrero de 2023.
- ↑ Ignacio Romero Cagigal et alii. «Dieta y cáncer de próstata». Consultado el 2012.
- ↑ Campbell, T. Colin (2012). «8». El estudio de China. Thomas Campbell II. Dallas, TX: BenBella Books, Inc. p. 138. ISBN 978-1-935618-81-2. «Lo sorprendente es que uno de los vínculos más concordantes entre la dieta y el cáncer de próstata es el consumo de productos lácteos.»
- ↑ Chan, J. M.; Giovannucci, E. L. (2001). «Dairy products, calcium, and vitamin D and risk of prostate cancer». Epidemiologic Reviews 1 (23): 87-92.
- ↑ «Inverse association of prostate cancer and non-ste...[Oncol Rep. 2000 Jan-Feb] - PubMed Result». Consultado el 2009.
- ↑ a b c d Drost, Frank-Jan H; Osses, Daniël F; Nieboer, Daan; Steyerberg, Ewout W; Bangma, Chris H; Roobol, Monique J; Schoots, Ivo G (25 de abril de 2019). «Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMC 6483565. PMID 31022301. doi:10.1002/14651858.CD012663.pub2. Consultado el 15 de marzo de 2021.
- ↑ Wang, Ximing; Bao, Jie; Ping, Xiaoxia; Hu, Chunhong; Hou, Jianquan; Dong, Fenglin; Guo, Lingchuan (28 de junio de 2018). «The diagnostic value of PI‑RADS V1 and V2 using multiparametric MRI in transition zone prostate clinical cancer». Oncology Letters. ISSN 1792-1074. PMC 6096261. PMID 30127915. doi:10.3892/ol.2018.9038. Consultado el 15 de marzo de 2021.
- ↑ Harrison's principles of internal medicine (21st ed edición). McGraw Hill. 2022. ISBN 978-1-264-26850-4.
- ↑ Schuessler WW (1997). «Laparoscopic radical prostatectomy: initial short-term experience.». Urology 50 (6): 854-7. PMID 9426713.
- ↑ Ilic, Dragan; Evans, Sue M.; Allan, Christie Ann; Jung, Jae Hung; Murphy, Declan; Frydenberg, Mark (09 12, 2017). «Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer». The Cochrane Database of Systematic Reviews 9: CD009625. ISSN 1469-493X. PMC 6486168. PMID 28895658. doi:10.1002/14651858.CD009625.pub2. Consultado el 27 de febrero de 2021.
- ↑ Prostate Cancer Results Study Group (PCRSG)
- ↑ Prostate Cancer Center of Seattle, USA.
- ↑ a b Herberts, Cameron; Annala, Matti; Sipola, Joonatan; Ng, Sarah W. S.; Chen, Xinyi E.; Nurminen, Anssi; Korhonen, Olga V.; Munzur, Aslı D. et al. (2022-08). «Deep whole-genome ctDNA chronology of treatment-resistant prostate cancer». Nature (en inglés) 608 (7921): 199-208. ISSN 1476-4687. doi:10.1038/s41586-022-04975-9. Consultado el 7 de enero de 2023.
- ↑ «Treatment Options For Prostate Cancer».
- ↑ «Prostate Cancer Symptoms & Treatment». Archivado desde el original el 22 de junio de 2020. Consultado el 19 de junio de 2020.
- ↑ Martínez-Jiménez, Francisco; Movasati, Ali; Brunner, Sascha Remy; Nguyen, Luan; Priestley, Peter; Cuppen, Edwin; Van Hoeck, Arne (2023-06). «Pan-cancer whole-genome comparison of primary and metastatic solid tumours». Nature (en inglés) 618 (7964): 333-341. ISSN 1476-4687. PMC 10247378. PMID 37165194. doi:10.1038/s41586-023-06054-z. Consultado el 5 de enero de 2024.
- ↑ Steiner, Thomas; Junker, Kerstin; Burkhardt, Frank; Braunsdorf, Andreas; Janitzky, Volker; Schubert, Joerg (1 de febrero de 2002). «Gain in Chromosome 8q Correlates with Early Progression in Hormonal Treated Prostate Cancer». European Urology 41 (2): 167-171. ISSN 0302-2838. doi:10.1016/S0302-2838(01)00030-6. Consultado el 6 de enero de 2024.
- ↑ a b Rycaj, Kiera; Tang, Dean G. (19 de septiembre de 2017). «Molecular determinants of prostate cancer metastasis». Oncotarget 8 (50): 88211-88231. ISSN 1949-2553. PMC 5675705. PMID 29152153. doi:10.18632/oncotarget.21085. Consultado el 3 de enero de 2021.
Enlaces externos[editar]
- En MedlinePlus hay más información sobre Cáncer de próstata
- Tutoriales Interactivos de Salud Medline Plus: Cáncer de próstata Utiliza gráficas animadas y se puede escuchar el tutorial
- Estadificación del Cáncer de Próstata, MedicalCriteria.com
- En inglés
- Sociedad Americana del Cáncer
- Prostate Cancer Treatment Center of Seattle
- Prostate Cancer Results Study Group (PCRSG)
- Prostate Cancer Foundation
- National Institute on Aging Information Center
- National Kidney and Urologic Diseases Information Clearinghouse
- Varias publicaciones del NCI pueden accederse vía Internet en http://cancer.gov/publications Archivado el 24 de febrero de 2018 en Wayback Machine.
- NOTA: La versión original de este artículo proviene de esta página Archivado el 6 de noviembre de 2008 en Wayback Machine. donde se encuentra bajo dominio público.


 French
French Deutsch
Deutsch