Cariotipo , la enciclopedia libre


El cariotipo (diferente de un idiograma) es el patrón de cromosomas que posee una especie (animal o vegetal), expresado a través de un código establecido por convenio, que describe las características de sus cromosomas.
El cariotipo es característico de cada especie, al igual que el número de cromosomas. Como ejemplo : el ser humano tiene 46 cromosomas (23 pares) en el núcleo de cada célula,[1] organizados en 22 pares autosómicos y 1 par sexual (hombre XY y mujer XX). Cada brazo se divide en zonas y cada zona, a su vez, en bandas e incluso las bandas en sub-bandas, gracias a las técnicas de marcado o tinción. No obstante, puede darse el caso de que existan otros patrones en los cariotipos, los que se conocen como anomalías numéricas . Debido a que en el ámbito de la clínica suelen ir ligados, el concepto de cariotipo se usa con frecuencia para referirse a un cariograma.
Diversidad[editar]
El número de cromosomas en el cariotipo entre especies no relacionadas es enormemente variable.
El récord más bajo le pertenece al nematodo Parascaris univalens, donde el número haploide es n = 1; el récord más alto podría estar en algún lugar entre los helechos, con el helecho Lengua de Adder Ophioglossum adelante, con un promedio de 1262 cromosomas.[2]
El récord más alto para animales podría estar en el esturión de nariz corta Acipenser brevirostrum con 372 cromosomas.[3]
El número de cromosomas (cariotipo) en los mamíferos está bien limitado y suele oscilar entre 36-60 cromosomas. Existen raras excepciones, el genoma de la rata vizcacha roja (Tympanoctomys barrerae) consta de 102 cromosomas. En el otro extremo, el del muntjac indio (Muntiacus muntjak vaginalis) el cariotipo consta de unos modestos 6 en la hembra, y 7 cromosomas en el macho.[4]
La existencia de cromosomas supernumerarios o B significa que el número de cromosomas puede variar incluso dentro de una misma población. (El cromosoma supernumerario se sitúa en el lugar del cromosoma normal 21. La fórmula de este triple cromosoma puede ser XXY o XYY).
Diversidad y evolución del cariotipo[editar]
Aunque la replicación del ADN y la transcripción del ADN están altamente estandarizadas en eucariotas, no puede decirse lo mismo de sus cariotipos, ya que son sumamente variables entre especies en el número y en la organización detallada de cromosomas, a pesar de haber sido construidos con las mismas macromoléculas.
Esta variación proporciona la base para una gama de estudios que podría llamarse citología evolutiva.
En algunos casos, incluso hay variaciones significativas dentro de la especie. En una revisión del 2000 Godfrey y Masters concluyen: "En nuestra visión, es poco probable que un proceso o el otro, puedan independientemente contar para el amplio rango de estructuras de cariotipo que son observadas. Pero usadas en conjunto con otros datos filogenéticos, el «fisionamiento» cariotípico puede ayudar a explicar diferencias dramáticas en los números diploides entre especies estrechamente relacionadas, que antes fueron inexplicables.[5]
- Cambios durante el desarrollo
A lo largo del tiempo, algunos de los organismos fueron eliminando la presencia de algunos componentes de su núcleo, así como la heterocromatina.
- La eliminación del cromosoma; En algunas especies (moscas) los cromosomas se van eliminando durante el desarrollo.[6]
- La disminución de la cromatina; En este proceso (en algunos copépodos) parte de los cromosomas son emitidos hacia fuera en algunas células. Este es un proceso donde el genoma está cuidadosamente organizado, donde se organizan y construyen nuevos telómeros y donde ciertas regiones de la heterocromatina se pierden[7][8]
- En Ascaris suum, todos los precursores de células somáticas experimentan disminución de la cromatina.[9]
- X-inactivación; La inactivación de un cromosoma X se lleva a cabo durante el desarrollo temprano de los mamíferos. En los mamíferos placentarios, la inactivación es al azar entre los dos X, pero en marsupiales es el cromosoma X paterno el que se inactiva.
Hay veces que se dan casos donde algunos cromosomas son anormales por lo que resulta un trastorno para el nuevo descendiente.
- Número de cromosomas en cada serie
Un ejemplo de la variabilidad entre especies estrechamente relacionadas es el del muntjac (un mamífero de la familia de los cérvidos que vive en la India y el sudeste asiático), que fue investigado por Kurt Benirschke y su compañera Doris Wurster donde demostraron que el número diploide del muntjac Chino (Muntiacus reevesi) resultó ser de 46 y todos telocéntricos. Cuando se estudió el cariotipo del muntjac Indio (Muntiacus muntjak) vieron que la hembra tenía 6 y el macho 7 cromosomas.[10]
- "Ellos simplemente no podían creer lo que habían visto... Ellos se mantuvieron en silencio por dos o tres años porque ellos pensaban que algo había andado mal con su cultivo de tejidos... Pero cuando ellos obtuvieron un par más de especímenes, ellos confirmaron sus hallazgos".[11]
Cariotipo humano[editar]
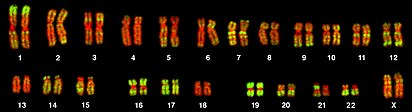
Levitsky fue el primero en dar una definición de cariotipo como las características o rasgos observables (fenotipo), de los cromosomas somáticos, en contraste con su contenido de genes. Este concepto siguió siendo estudiado con los trabajos de Darlington[12] y White.[13][14]
La investigación y el interés por el estudio del cariotipo hizo que se planteara una pregunta : ¿cuántos son los cromosomas que contiene una célula diploide humana?
En 1912, Hans von Winiwarter encontró que el humano tenía 47 cromosomas en las espermatogonias y 48 en las oogonias, postulando un mecanismo de determinación sexual XX/XO. Años después, en 1922 von Winiwarter no estaba seguro si el número cromosómico del hombre era 46 o 48. Se necesitó un estudio más profundo para poder responder a esta pregunta.
Técnica[editar]
- Se usaron células en cultivo.
- Células pretratadas en una solución hipotónica, lo que hace que los cromosomas se extiendan y aumenten de tamaño.
- Con una solución del colchicina detener el proceso de mitosis en la metafase.
Esto tomó hasta mediados de los años 1950 que fue cuando se dio como generalmente aceptado que el cariotipo de humano incluye solo 46 cromosomas. En los grandes monos el cariotipo es de 48 cromosomas, por lo que se postuló que el cromosoma 2 (humano) fue formado por una fusión de cromosomas hereditarios, reduciendo así el número de estos.
Los cromosomas dispuestos mediante un cariograma se clasifican en 7 grupos, nombrados de la A a la G, atendiendo a su longitud relativa y a la posición del centrómero, que define su morfología (fenotipo). De esta manera, el cariotipo humano queda formado así:
- Grupo A: Incluye los pares cromosómicos 1, 2 y 3. Se caracterizan por ser cromosomas muy grandes, casi metacéntricos. En concreto, 1 y 3 son metacéntricos, mientras que el 2 es submetacéntrico.

- Grupo B: Incluye los pares cromosómicos 4 y 5. Se trata de cromosomas grandes y submetacéntricos (con dos brazos muy diferentes en tamaño).
- Grupo C: Incluye los pares cromosómicos 6, 7, 8, 9, 10, 11, 12, X. Son cromosomas medianos submetacéntricos.
- Grupo D: Incluye los pares cromosómicos 13, 14 y 15. Se caracterizan por ser cromosomas medianos acrocéntricos con satélites.
- Grupo E: Incluye los pares cromosómicos 16, 17 y 18. Son cromosomas pequeños, metacéntrico el 16 y submetacéntricos 17 y 18.
- Grupo F: Incluye los pares cromosómicos 19 y 20. Se trata de cromosomas pequeños y metacéntricos.
- Grupo G: Incluye los pares cromosómicos 21, 22. Se caracterizan por ser cromosomas pequeños y acrocéntricos con satélites.
Mediante el cariograma se pueden analizar anomalías numéricas y estructurales, cosa que sería muy difícil de observar mediante genética mendeliana.
Requisitos para el estudio del cariotipo[editar]
Deben cumplirse los siguientes requerimientos:
- Las células deben encontrarse en división. Para ello es mejor hacer la incubación de la muestra en presencia de productos inductores de la mitosis (mitógenos), como es el caso de fitohemaglutinina.
- Las células deben detenerse en prometafase, empleando colchicina que interfiere en la polimerización de los microtúbulos del huso mitótico.
- Con el objetivo de conseguir una buena separación cromosómica, las células deben someterse a choque osmótico. Para ello, se emplea un medio hipotónico (0,075 M KCl), que ocasiona el aumento de volumen de las células.
- Las células tienen que ser fijadas.
- Hay que proceder a la tinción de los cromosomas para que sean visibles e identificables.
Tinción[editar]
El estudio de los cariotipos es posible mediante su tinción. Usualmente se aplica un colorante adecuado después de que las células hayan sido detenidas durante la división celular usando colchicina. En muestras humanas, lo más frecuente es usar glóbulos blancos porque su crecimiento y división son fáciles de inducir en cultivo.[15]
Algunas veces es posible realizar la observación cuando las células no se están dividiendo (interfase). El sexo de un neonato feto puede ser determinado por observación de células en la interfase (ver punción amniótica y corpúsculo de Barr).
La mayoría de especies (aunque no todas) tienen un cariotipo estándar. El ser humano normalmente tiene 22 pares de cromosomas autosómicos y un par de cromosomas sexuales. El cariotipo normal para la mujer contiene dos cromosomas X y se designa 46 XX, mientras el varón tiene un cromosoma X y uno Y, lo que se denomina 46 XY. Cualquier variación de este cariotipo estándar puede llevar a anomalías en el desarrollo.
En los laboratorios de citogenética se utilizan varias técnicas de tinción o bandeo cromosómico. En este sentido, destaca el método de tinción de las bandas de quinacrina (bandas Q). Fue el primero en emplearse, requiere un microscopio de fluorescencia, aunque su uso ya no está tan extendido como el de las bandas de giemsa (bandas G). Para producir estas bandas G se aplica una tinción de Giemsa tras digerir parcialmente las proteínas cromosómicas con tripsina. Las bandas reversas (bandas R) requieren tratamiento por calor y en ellas se invierte el patrón normal blanco y negro que se observa en las bandas Q y G. Este método destaca por su gran utilidad en la tinción de los extremos distales de los cromosomas. Existen otras técnicas de tinción como las bandas C y las NOR (región de organizadores nucleolares), tiñendo estos últimos específicamente ciertas regiones del cromosoma. Así, las bandas C tiñen la heterocromatina constitutiva, que se localiza normalmente cerca de los centrómeros, y la tinción NOR marca los satélites y tallos de los cromosomas acrocéntricos.
Las bandas de alta resolución suponen la tinción de los cromosomas en profase o metafase precoz (prometafase) antes de alcanzar la condensación máxima. Los cromosomas en profase y prometafase están más elongados que los cromosomas en metafase; por este motivo, el número de bandas observadas, para el conjunto de cromosomas, aumenta desde 300-450 hasta casi 800. Ello permite detectar anomalías menos claras, que no suelen apreciarse con las bandas convencionales. Para obtener este tipo de bandas se necesita añadir otro requisito para la realización del cariotipo. Se trata de un componente utilizado en quimioterapia, el metotrexato, que junto con la colchicina se añade antes de realizar la tinción.
Método de estudio del cariotipo[editar]
- Toma de sangre periférica y separación de los glóbulos blancos (linfocitos T)
- Incubación en presencia de productos que inducen a la mitosis (mitógenos), como la fitohemaglutinina. Los mitógenos se adicionan a las células para que éstas crezcan adecuadamente hasta formar una monocapa. Después se recogen separándolas de la superficie plástica del recipiente mediante un rascador.
- Detención de la mitosis en la metafase (utilizando colchicina, que interfiere en la polimerización de los microtúbulos del huso mitótico).
Tanto el paso de adición de mitógenos como la adición de colchicina son los pasos críticos para el estudio del cariotipo.
- Paso por un medio hipotónico que hace que las células se hinchen.
- Depositar una gota de la preparación entre porta y cubre (sobre el cual se hace presión para dispersar los cromosomas)
- Fijar, teñir y fotografiar los núcleos estallados (10-15; 30 en mosaicos). Se observan entre 10 y 15 núcleos porque puede haber muchos falsos positivos debido a que le hemos añadido mitógenos (de manera que las células se dividen de forma rápida y precipitada) y colchicina, los cuales pueden provocar mutaciones e irregularidades en los cromosomas. Si los 10-15 núcleos no son iguales puede ser debido a estas sustancias o a que nos encontremos ante un organismo mosaico (por lo que deberíamos mirar más núcleos)
- Actualmente existen aparatos de captación y programas de análisis que elaboran el cariotipo automáticamente con los datos obtenidos.
Es necesario realizar un recuento de entre 12 y 25 células, al menos, en metafase. Esto se debe a que si por ejemplo, al contar un núcleo le falta el cromosoma 21, puede ser que sea mosaico y que el resto de células sí presenten ese cromosoma. Otra opción, y más probable, es que sea un efecto de la adición del mitógeno, ya que este compuesto altera el proceso normal de división celular, favoreciendo las aneuploidías. Una última opción podría ser que los cromosomas se solapen y al proceder al analizar el cariotipo solo se cuente un cromosoma cuando realmente hay dos. Por todas estas razones se deben contar un mínimo de 12-15 células en metafase que se encuentren bastante separadas en el porta.
Cariotipo clásico[editar]
En el cariotipo clásico se suele utilizar una disolución de Giemsa como tinción (específica para los grupos fosfato del ADN) para colorear las bandas de los cromosomas (bandas G), menos frecuente es el uso del colorante quinacridina (que se une a las regiones ricas en adenina y timina). Cada cromosoma tiene un patrón característico de bandas que ayuda a identificarlo.
La imagen de los cromosomas se organiza de forma que su brazo corto quede orientado hacia la parte superior y el brazo largo hacia la parte inferior.
Algunos cariotipos nombran a los brazos cortos p y a los largos q. Además, las diferentes regiones y subregiones teñidas reciben designaciones numéricas según la posición en la que se encuentren respecto al centrómero, dentro de cada brazo cromosómico.
Por ejemplo, el "síndrome del maullido" (cri du chat) implica una deleción en el brazo corto del cromosoma 5. Se designa como 46, XX, 5p-. La región crítica para este síndrome es la deleción de la banda 15.2, lo que se indica como 46,XX, del(5)(p15.2)[16]
Cariotipo espectral[editar]

El análisis espectral de los cariotipos (o SKY) es una tecnología de citogenética molecular que permite el estudio y visualización de los 23 pares de cromosomas en forma simultánea. Se preparan sondas específicas para cada cromosoma marcando el DNA específico de cada cromosoma con diferentes fluoróforos. Debido a que hay un limitado número de fluoróforos espectralmente distintos, se usa un método de etiquetado combinatorio para generar muchos colores diferentes.
La diferencias espectrales generadas por el etiquetado combinatorio son capturadas y analizadas usando un interferómetro acoplado a un microscopio de fluorescencia.
El programa de procesamiento de imágenes entonces asigna un pseudocolor a cada combinación espectralmente diferente, permitiendo la visualización de cromosomas coloreados.[17]
Esta técnica se usa para identificar aberraciones estructurales cromosómicas en células cancerosas y otras patologías cuando el bandeo con Giemsa u otras técnicas no son lo suficientemente precisas.
Este tipo de técnicas mejorará la identificación y diagnóstico de las aberraciones cromosómicas en citogenética prenatal así como en células cancerosas.
Cariotipo digital[editar]
El cariotipo digital es una técnica utilizada para cuantificar el número de copias de ADN en una escala genómica. Se trata de secuencias de loci de ADN específicos de todo el genoma que son aisladas y enumeradas.[18]
Este método es también conocido como cariotipo virtual.
Observaciones en cariotipo[editar]
- Los cromosomas sufren grandes variaciones en su tamaño a lo largo del ciclo celular, pasando de estar muy poco compactados (interfase) a estar muy compactados (metafase).
- Diferencia de posición del centrómero.
- Las diferencias en el número básico de cromosomas puede ocurrir debido a desplazamientos sucesivos que quitan todo el material genético de un cromosoma, haciendo que este se pierda.
- Diferencias de grado y distribución de regiones de heterocromatina. La heterocromatina es una forma inactiva de ADN condensada localizada sobre todo en la periferia del núcleo que se tiñe fuertemente con las coloraciones, tomando coloración más oscura que la cromatina.
Se encuentra con frecuencia variación en los cromosomas:
- Entre sexos.
- Entre gametos y el resto del cuerpo.
- Entre los miembros de una población.
- Variación geográfica.
Poliploidía: el número de receptores en un cariotipo[editar]
La poliploidía (más de dos conjuntos de cromosomas homólogos en las células) se produce principalmente en las plantas. Ha sido de gran importancia en la evolución de estas según Stebbins.[19][20][21][22] La proporción de las plantas con flores poliploides es de 30-35% y en el caso de las gramíneas un valor mucho más elevado, alrededor del 70%.[23]
La poliploidía en plantas inferiores (helechos y psilotales) también es común. Algunas especies de helechos han alcanzado niveles de poliploidía muy por encima de los niveles más altos conocidos en plantas con flores. La poliploidía en animales es mucho menos común, alcanzando importancia en algunos grupos.[24] En humanos se han registrado casos de embriones y fetos triploides (69, XXX) e incluso tetraploides (92, XXXX)[25] que con un gran porcentaje acababan en aborto natural; en el caso poco frecuente de neonatos con dicha carga cromosómica, sus esperanzas de vida no superaban los pocos días postparto debido a diversas alteraciones en todos sus órganos.[26]
La endopoliploidía se produce cuando los tejidos adultos de las células han dejado de dividirse por mitosis, pero los núcleos contienen más cantidad de cromosomas somáticos originales.[27]
En muchos casos, los núcleos endodiploides contienen decenas de miles de cromosomas (no pueden contarse con exactitud). Las células no siempre contienen exactamente múltiplos (potencias de dos), razón por la cual el aumento en el número de conjuntos de cromosomas causados por la reproducción no es del todo exacto.
Este proceso (sobre todo estudiado en insectos y algunas plantas superiores) puede ser una estrategia de desarrollo para aumentar la productividad de los tejidos que son muy activos en la biosíntesis.[28]
Este fenómeno ocurre esporádicamente a través del reino eucariota desde protozoo hasta el hombre; Este es diverso y complejo, y sirve a la diferenciación y morfogénesis de muchas formas. [29]
Vea paleopoliploidía para la investigación de duplicación de antiguos cariotipos.
Aneuploidía[editar]
El término es principalmente usado cuando el número de cromosomas varía dentro del cruce poblacional de especies. Esto puede también ser usado dentro de un grupo de especies estrechamente relacionado.
Clásicos ejemplos en plantas son el género Crepis, donde el número gamético (= haploide) forma las series x = 3, 4, 5, 6, y 7; y Crocus, donde cada número desde x = 3 hasta x = 15 es representado por al menos una especie. Evidencia de varios tipos muestran que las tendencias de evolución han ido en direcciones diferentes, en diferentes grupos.[30]
Más cerca de casa, los grandes monos tienen 24x2 cromosomas, allí donde los humanos tienen 23x2.
El cromosoma 2 humano fue formado por la mezcla de cromosomas ancestrales, reduciendo el número.[31] La aneuploidía no es considerada normalmente -ploidía sino -somía, tal como la trisomía o monosomía.
Las aneuploidías se denominan de la siguiente manera: número de veces que se repite seguido de la palabra “somía” seguido del número de cromosoma involucrado. El origen de esta mutación puede provenir de la no disyunción en meiosis I o II.
Anomalías cromosómicas[editar]
Estas anomalías pueden ser numéricas (presencia de cromosomas adicionales) o estructurales (translocaciones, inversiones a gran escala, supresiones o duplicaciones).
Las anomalías numéricas, también conocidas como aneuploidía, hacen referencia a cambios en el número de cromosomas, que pueden dar lugar a enfermedades genéticas. La aneuploidía se puede observar frecuentemente en células cancerosas. En los animales solo son viables las monosomías y las trisomías, ya que las nulisomías son letales en individuos diploides.
Las anormalidades estructurales a menudo se derivan de errores en la recombinación homóloga. Ambos tipos de anomalías pueden ocurrir en los gametos y, por tanto, estarán presentes en todas las células del cuerpo de una persona afectada, o puede ocurrir durante la mitosis y dar lugar a mosaicos genéticos individuales que tiene normal y anormal algunas células.
Anomalías cromosómicas en humanos:
- Síndrome de Turner, donde solo hay un cromosoma X (45, X o 45 X0)
- Síndrome de Klinefelter, se da en el sexo masculino, también conocido como 47 XXY. Es causada por la adición de un cromosoma X.
- Síndrome de Edwards, causado por una trisomía (tres copias) del cromosoma 18.
- Síndrome de Down, causado por la trisomía del cromosoma 21.
- Síndrome de Patau, causado por la trisomía del cromosoma 13.
- Síndrome de Pallister Killian, causado por la presencia de un cromosoma extra en el par 12.
También se detectó la existencia de la trisomía 8, 9 y 16, aunque por lo general no sobreviven después de nacer. No se han registrado casos en humanos de trisomías en el cromosoma 1, ya que todas acaban en aborto natural y no llegan a nacer.
Hay algunos trastornos que se derivan de la pérdida de un solo trozo de cromosoma, entre ellas:
- Cri du Chat (maullido del gato) donde hay un brazo corto en el cromosoma 5. El nombre viene por el grito que causan los recién nacidos parecido al maullido de un gato debido a una malformación de la laringe.
- Síndrome de supresión que se da por la pérdida de una parte del brazo corto del cromosoma 1.
- Síndrome de Angelman; Un 50% de los casos falta un segmento del brazo largo del cromosoma 15.
Estas anomalías cromosómicas también pueden ocurrir en células cancerosas de un individuo genéticamente normales. Un ejemplo bien documentado es el de Cromosoma Filadelfia o la llamada translocación Filadelfia que es una anormalidad genética asociada a la leucemia mieloide crónica (LMC).
Esta anormalidad afecta a los cromosomas 9 y 22. El 95 por ciento de los enfermos de leucemia mieloide crónica presenta esta anormalidad, mientras el resto de los enfermos padecen translocaciones crípticas invisibles a las preparaciones mediante el método de banda G u otras translocaciones que afectan a otro u otros cromosomas de la misma forma que sucede con los cromosomas 9 y 22.
Partes de dos cromosomas, el 9 y el 22, intercambian sus posiciones. El resultado es que parte del gen de región de fractura (BCR, Breakpoint Cluster Region, en inglés) del cromosoma 22 (región q11) se fusiona con parte del gen ABL del cromosoma 9 (región q34). El gen ABL toma su nombre de «Abelson», el nombre de un virus causante de leucemias precursor de una proteína similar a la que produce este gen.
Nomenclatura[editar]
Desde de 1995 se emplean distintos símbolos para describir la anomalía que sufre un cromosoma en concreto o un cariotipo, siguiendo las reglas que impone el ISCN (siglas inglesas procedentes de Sistema Internacional de Nomenclatura para Citogenética Humana). Es decir, la fórmula cromosómica refleja la descripción simplificada de un cariotipo. En la fórmula cromosómica se registra el número total de cromosomas (incluidos los sexuales) seguido de una coma, tras la cual se escriben los cromosomas sexuales. Si existen aberraciones numéricas o estructurales de los autosomas, éstas se escriben a continuación, tras otra coma. Cuando hay un mosaico, es decir, coexisten dos o más poblaciones celulares diferentes, los cariotipos correspondientes a cada una se escriben separados por una barra; primero se escribe el que tiene menor número de cromosomas y luego sucesivamente los de mayor número. Algunos de los símbolos y abreviaturas usados para describir los cariotipos son:
- p: brazo corto del cromosoma.
- q: brazo largo del cromosoma.
- +: ganancia de un cromosoma completo.
- -: pérdida de un cromosoma completo.
- tel: telómero.
- r( ): cromosoma en anillo. Entre paréntesis ponemos el cromosoma involucrado.
- del( )( ): deleción de. En el primer paréntesis ponemos los cromosomas en los que se produce la deleción, y en el segundo de dónde a dónde se produce la deleción.
- ins: inserción de.
- dup: duplicación de.
- inv( )( ): inversión de. En el primer paréntesis ponemos los cromosomas en los que se produce la inversión, y en el segundo los extremos del segmento invertido.
- t: translocación de.
- mar: fragmento de ADN que no se sabe de donde procede, y se le designa el nombre de "cromosoma marcador".
- dic: cromosoma dicéntrico.
- dn: aberración cromosómica no heredada de los padres sino surgida de novo.
- h: región de heretocromatina.
- i: isocromosoma, es decir, cromosoma que tiene los dos brazos iguales ya sean dos brazos p o dos brazos 1.
- .ish: cariotipo estudiado por FISH.
- mat: rearreglo de un cromosoma de origen materno.
- pat: rearreglo de un cromosoma de origen paterno.
- psu dic: cromosoma pseudodicéntrico, es decir, en el que solo uno de los centrómeros está activo.
- tri: trisomía.
- trp: triplicación de una porción de un cromosoma.
Ejemplos de fórmulas cromosómicas[editar]
- Aberraciones numéricas euploides: el número total de cromosomas es múltiplo del número haploide. 69,XXY: cariotipo anormal, con 69 cromosomas (triploide), 2 cromosomas X y un cromosoma Y.
- Aberraciones numéricas aneuploides: el número total de cromosomas no es múltiplo del número haploide, es decir, hay uno o más cromosomas de menos o de más.
- 45,X: monosomía en la que hay 45 cromosomas al tener un único cromosoma X. Es típico en persona con el Síndrome de Turner.
- 47,XXY o también 47,XY,+X: hombre con un cromosoma X adicional (síndrome de Klinefelter) lo que provoca que el individuo no desarrolle los caracteres sexuales secundarios.

- 47,XX,+21: mujer con síndrome de Down.
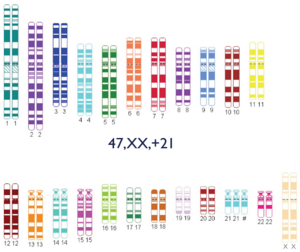
- Mosaicismo: existencia de varias poblaciones celulares diferentes en el mismo individuo.
- 45,X/46,XY mosaico con dos líneas celulares, una con 45 cromosomas y un único X y otra con 46 cromosomas, un X y un Y.
- Aberraciones estructurales: son aquellas en que uno o más cromosomas cambian su estructura propia por la adición o pérdida de material genético, por alteración de su forma o del patrón de bandas. Estos cambios se llaman reorganizaciones y siempre se relacionan con rotura cromosómica. En la fórmula cromosómica hay que especificar, tras el número total de cromosomas seguido de una coma, el tipo de reorganización con la correspondiente abreviatura.
- 46,X,i(X): 46 cromosomas, con un cromosoma X normal y un isocromosoma X.
- 46,XX,del(7)(q1q3): mujer con una deleción de la banda 1 a la banda 3 del brazo q del cromosoma 7.
Véase también[editar]
- Glosario relacionado con genoma
- Genoma humano
- Citogenética
- Citogenética vegetal
- Aberración cromosómica
Referencias[editar]
- ↑ White M.J.D. 1973. The chromosomes. 6ª ed., Chapman & Hall, London. pág.28
- ↑ Khandelwal S. 1990. Chromosome evolution in the genus Ophioglossum L. Botanical Journal of the Linnean Society 102: 205–217.
- ↑ Kim, D.S.; Nam, Y.K.; Noh, J.K.; Park, C.H.; Chapman, F.A. (2005). «Karyotype of North American shortnose sturgeon Acipenser brevirostrum with the highest chromosome number in the Acipenseriformes» (PDF). Ichthyological Research 52 (1): 94-97. doi:10.1007/s10228-004-0257-z. Consultado el 18 de marzo de 2008.
- ↑ Vicky Tsipouri, Mary G Schueler, Sufen Hu, NISC Comparative Sequencing Program, Amalia Dutra, Evgenia Pak, Harold Riethman & Eric D Green (2008). «Comparative sequence analyses reveal sites of ancestral chromosomal fusions in the Indian muntjac genome». Genome Biology 9 (R155).
- ↑ «Kinetochore reproduction theory may explain rapid chromosome evolution».
- ↑ Goday C. and Esteban M.R. 2001. Chromosome elimination in sciarid flies. Bioessays 23: 242–250.
- ↑ Müller F. Bernard V. & Tobler H. 1996. Chromatin diminution in nematodes. Bioessays 18: 133–138.
- ↑ Wyngaard G.A. & Gregory T.R. 2001. Temporal control of DNA replication and the adaptive value of chromatin diminution in copepods. J. Exp. Zool. 291: 310–16.
- ↑ Gilbert S.F. 2006. Developmental biology. Sinauer Associates, Stamford CT. 8th ed, Chapter 9
- ↑ Wurster D.H. and Benirschke K. 1970. Indian Muntjac, Muntiacus muntjak: a deer with a low diploid number. Science 168, 1364-1366.
- ↑ Hsu T.C. 1979. Human and mammalian cytogenetics: an historical perspective. Springer-Verlag N.Y. p73-4
- ↑ Darlington C.D. 1939. Evolution of genetic systems. Cambridge University Press. 2nd ed, revised and enlarged, 1958. Oliver & Boyd, Edinburgh.
- ↑ White M.J.D. 1973. Animal cytology and evolution. 3rd ed, Cambridge University Press.
- ↑ White M.J.D. 1973. The chromosomes. 6th ed, Chapman & Hall, London.
- ↑ Gustashaw K.M. 1991. Chromosome stains. In The ACT Cytogenetics Laboratory Manual 2nd ed, ed. M.J. Barch. The Association of Cytogenetic Technologists, Raven Press, New York.
- ↑ Lisa G. Shaffer, Niels Tommerup, ed. (2005). ISCN 2005: An International System for Human Cytogenetic Nomenclature. Switzerland: S. Karger AG. ISBN 3-8055-8019-3.
- ↑ E. Schröck, S. du Manoir, T. Veldman, B. Schoell, J. Wienberg, M. A. Ferguson-Smith, Y. Ning, D. H. Ledbetter, I. Bar-Am, D. Soenksen, Y. Garini, T. Ried. Multicolor spectral karyotyping of human chromosomes. Science, 26 July 1996; 273 (5274):494. abstract
- ↑ Digital karyotyping - Wang et al., 10.1073/pnas.202610899 - Proceedings of the National Academy of Sciences
- ↑ Stebbins, G.L. 1940. The significance of polyploidy in plant evolution. The American Naturalist 74, 54–66.
- ↑ Stebbins G.L. 1950. Variation and evolution in plants. Columbia University Press.
- ↑ Comai L. 2005. The advantages and disadvantages of being polyploid. Nature Reviews, Genetics. 6, 836-46.
- ↑ Adams K.L. & Wendel J.F. 2005. Polyploidy and genome evolution in plants. Current Opinion in Plant Biology. 8 135-41.
- ↑ Stebbins G.L. 1970. Chromosomal evolution in flowering plants. Arnold, London.
- ↑ Gregory T.R. & Mable B.K. 2005. Polyploidy in animals. In The Evolution of the genome Gregory T.R. (ed). Elsevier, San Diego. p427-517
- ↑ http://www.springerlink.com/content/k8111226633827t2/
- ↑ «Copia archivada». Archivado desde el original el 3 de noviembre de 2011. Consultado el 6 de noviembre de 2011.
- ↑ White M.J.D. 1973. The chromosomes. 6th ed, Chapman & Hall, London. p45
- ↑ Edgar B.A. & Orr-Weaver T.L. 2001. Endoreduplication cell cycles: more for less. Cell 105, 297-306.
- ↑ Nagl W. 1978. Endopolyploidy and polyteny in differentiation and evolution: towards an understanding of quantitative and qualitative variation of nuclear DNA in ontogeny and phylogeny. Elsevier, Nueva York.
- ↑ Stebbins, G. Ledley, Jr. 1972. Chromosomal evolution in higher plants. Nelson, London. p18
- ↑ Ijdo J.W. et al 1991. Origin of human chromosome 2: an ancestral telomere-telomere fusion. Proceedings of the National Academy of Sciences 88: 9051–5.
Bibliografía[editar]
- Citogenética Básica y Biología de los Cromosomas. Monografía No 20, Programa Regional de Desarrollo Científico y Técnológico, Departamento de Asuntos Científicos, Seecretaria General de la OEA.
- Solari A J (2011) Genética Humana: fundamentos y aplicaciones en medicina. Capítulo 17. Editorial Panamericana. ISBN 9789500602693
- Tres Etapas en la Historia de la Citogenética Clínica Scribid.
- Laboratorio ADN, Fertilidad y Paternidad


 French
French Deutsch
Deutsch



