تاریخ فرگشتی گیاهان - ویکیپدیا، دانشنامهٔ آزاد

فرگشت گیاهان به دامنه گستردهای از پیچیدگیها، از نخستین فرشهای جلبکی، جلبکهای سبز چندسلولی دریایی و آبشیرین، خزهتباران خاکی، لیکوپودیوپسیدا و سرخسها گرفته تا بازدانگان و نهاندانگان (گیاهان گلدار) امروزی منجر شدهاست. باوجود اینکه بسیاری از نخستین گروهها همچنان به رشد خود ادامه میدهند (نمونهای از آنان جلبکهای قرمز و سبز در محیطهای دریایی هستند) گروههایی که تازگی مشتق شدهاند، و جانشین آنانی که پیشتر ازنظر بومشناختی غالب بودهاند، شدهاند. مانند پیروزی گیاهان گلدار بر بازدانگان در محیطهای خاکی.[۱]: 498

شواهدی وجود دارد که نشان میدهد سیانوباکتریها و یوکاریوتهای فتوسنتزی چندسلولی در آغاز ۱ میلیارد سال پیش در جمعیتهای آبشیرین در خشکی زندگی میکردند،[۷] و جمعیتهایی از جانداران پیچیده و چندسلولی فتوسنتزکننده در خشکی در پایان پرکامبرین، یعنی حدود ۸۵۰ سال میلیون سال پیش، وجود داشتند.[۸]
شواهدی از ظهور گیاهان خاکی رویاندار که برای نخستین بار در میانه دوره اردویسین (حدود ۴۷۰ میلیون سال پیش)، و در میانه دوونین (حدود ۳۹۰ میلیون سال پیش) پدیدار شدند؛ که بسیاری از ویژگیهایی که امروزه در گیاهان خاکی شناخته میشوند، ازجمله ریشه و برگ در آنان وجود داشتند. در پایان دوونین (حدود ۳۷۰ میلیون سال پیش) برخی از گیاهان بدون هاگ مانند باستانسرخس دارای بنلاد آوندساز بودند که چوب تولید میکرد و جنگلهایی از درختان بلند را تشکیل داده بود. همچنین در پایان دوونین، Elkinsia، یک دانهسرخستبار اولیه، دانههایی را فرگشت داده بود.[۹] نوآوری فرگشتی در دیگر دورانهای پیدازیستی ادامه داشت و هنوز هم ادامه دارد. بیشتر گروههای گیاهی از رویداد انقراض پرمین-تریاس آسیب ندیدند، اگرچه ساختار جمعیتها تغییر کرد. این ممکن است صحنه را برای ظهور گیاهان گلدار در تریاس (حدود ۲۰۰ میلیون سال پیش)، و متنوعشدن پسین آنان در کرتاسه و پالئوژن آماده کرده باشد. واپسین گروه بزرگ گیاهان که فرگشت یافتند گندمیان بودند که در میانه پالئوژن، از حدود ۴۰ میلیون سال پیش اهمیت یافتند. گندمیان، و همچنین بسیاری از گروههای دیگر، سازوکارهای نوینی از سوختوساز را برای زنده ماندن از اندکی CO۲ و شرایط گرم و خشک مناطق گرمسیری در طول ۲۰ میلیون سال گذشته ایجاد کردند.
استعمار زمین[ویرایش]
گیاهان خاکی از گروهی از جلبکهای سبز فرگشت یافتهاند، شاید در آغاز ۸۵۰ میلیون سال پیش،[۸] اما گیاهان جلبکمانند ممکن است در آغاز ۱ میلیارد سال پیش فرگشت یافته باشند.[۷] نزدیکترین خویشاوندان زنده گیاهان خاکی، سنگخزهتباران، بهویژه کارایان هستند. با فرض اینکه عادت کارایان از زمان انشعاب دودمان تغییر چندانی نکرده باشد، این بدان معنی است که گیاهان خاکی از یک جلبک شاخهدار و رشتهای که در آبشیرین کمعمق، شاید در لبه برکههایی که بهطور فصلی خشک میشوند، زندگی میکرد،[۱۰] فرگشت یافتهاند.[۱۱] با این حال، برخی شواهد جدید نشان میدهد که گیاهان خاکی ممکن است از سنگخزهتباران تکسلولی خشکی شبیه به نسخه موجود Klebsormidiophyceae منشأ گرفته باشند.[۱۲] این جلبک یک چرخه زندگی هائلوئیدی داشت. بهندرت هنگامی که تخمک و اسپرم باهم ترکیب میشدند و یک زیگوت را تشکیل میدادند تنها برای مدت کوتاهی کروموزومهای جفت داشت (شرایط دیپلوئید) که بلافاصله با میوز تقسیم میشد و سلولهایی با نیم شمار کروموزومهای جفتنشده (شرایط هاپلوئید) تولید میشد. همزیستی با قارچها ممکن است به گیاهان اولیه کمک کرده باشد تا با تنشهای قلمروی خاکی سازگار شوند.[۱۳]


گیاهان نخستین فتوسنتزکنندگان روی زمین نبودند. ارزیابیهای هواشناسی نشان میدهد که جاندارانی که توانایی فتوسنتز دارند پیشتر روی زمین حدود ۱۲۰۰ میلیون سال پیش زندگی میکردهاند،[۱۱] و فسیلهای میکروبی در رسوبات دریاچه آبشیرین متعلق به ۱۰۰۰ میلیون سال پیش یافت شده است،[۱۴] اما امضای ایزوتوپ کربن نشان میدهد که آنها تا حدود سال ۸۵۰ میلیون سال پیش برای تأثیرگذاری بر ترکیب اتمسفر بسیار ناچیز بودند.[۸] این جانداران، اگرچه ازنظر فیلوژنتیکی متنوع بودند،[۱۵] احتمالاً کوچک و ساده بودند و کمی بیشتر از یک پسمانده جلبکی را تشکیل میدادند.[۱۱]
شواهدی از قدیمیترین گیاهان خاکی بسیار دیرتر، در حدود ۴۷۰ میلیون سال پیش، در سنگهای اردویسین میانه از عربستان سعودی[۱۶] و گندوانا[۱۷] بهشکل هاگهایی با دیوارههای مقاوم دربرابر پوسیدگی پدیدار شدهاست. این هاگها که بهعنوان کریپتوسپور شناخته میشوند، بهصورت منفرد (موناد)، بهصورت جفت (دیاد) یا گروههای چهارتایی (تتراد) تولید میشوند و ریزساختار آنها شبیه به هاگهای جگرواشان نوین است، که نشان میدهد آنان دارای درجه سازمانیافتگی مشابهی هستند.[۱۸] دیواره آنان دارای اسپورپولنین است- شواهد بیشتر از قرابت جنینی.[۱۹] ممکن است پیش از این، «مسمومیت» جوی از استعمار زمین توسط یوکاریوتها جلوگیری کند،[۲۰] یا بهسادگی میشد زمان بسیاری را صرف کند تا پیچیدگی لازم فرگشت یابد.[۲۱]
هاگهای سهبخشی شبیه به گیاهان آونددار در حدود ۴۵۵ میلیون سال پیش در سنگهای اردوویسین بالایی ظاهر میشوند.[۲۲][۲۳] بسته به اینکه دقیقاً چه هنگامی چهارتایی (تتراد) تقسیم شود، هریک از چهار هاگ ممکن است دارای یک "علامت سهبخشی"، به شکل Y باشد، که منعکس کننده نقاطی است که در آن هر سلول دربرابر همسایگان خود نرم میشود.[۲۴] با این حال، این مستلزم آن است که دیوارههای هاگ در مراحل اولیه محکم و مقاوم باشند. این مقاومت ارتباط نزدیکی با داشتن دیواره بیرونی مقاوم دربرابر خشکشدن دارد - این ویژگی تنها هنگامی بهکار میآید که هاگها باید بیرون از آب زنده بمانند. در واقع، حتی رویاندارانی که به آب برگشتهاند، فاقد دیواره مقاوم هستند، بنابراین علائم سهبخشی را ندارند.[۲۴] بررسی دقیق هاگهای جلبکی نشان میدهد که هیچکدام دارای هاگ سهبخشی نیستند، یا به این دلیل که دیوارههای آنان به اندازه کافی مقاوم نبوده، یا در موارد نادری، به این دلیل که هاگها پیش از فشردهشدن به مقدار کافی برای ایجاد این علامت، پراکنده میشوند یا در درون یک تتراد چهاروجهی قرار نمیگیرند.[۲۴]
نخستین ابرفسیلهای گیاهان خاکی جانداران ریسهای بودند که در تالابهای رودخانهای زندگی میکردند و مشخص شد که بیشتر دشت سیلورین اولیه را میپوشاندند. آنها تنها هنگامی میتوانستند زنده بمانند که زمین غرقاب بود.[۲۵] فرشهای میکروبی هم وجود داشتند.[۲۶]
هنگامی که گیاهان به زمین رسیدند، دو رویکرد برای مقابله با خشکی وجود داشت. خزههای نوین یا از آن اجتناب میکنند یا تسلیم آن میشوند، محدودهشان را به محیطهای مرطوب محدود میکنند یا خشک میشوند و سوختوساز خود را تا رسیدن آب بیشتر به حالت تعلیق درمیآورند، مانند جنس Targionia. آوندداران با کنترل سرعت ازدست دادن آب دربرابر خشکشدن مقاومت میکنند. همه آنها دارای یک لایه کوتیکول بیرونی ضدآب در هر جایی که در معرض هوا قرار میگیرد (مانند برخی از خزهها) برای کاهش ازدست دادن آب میباشند، اما از آنجایی که یک پوشش کامل آنها را از CO۲ در جو محروم میکند، آوندداران از ورودیهای متغیری بهنام روزنه هوایی استفاده میکنند، تا نرخ تبادل گاز را تنظیم کنند. همچنین آوندداران بافت آوندی را برای کمک به حرکت آب در درون جاندار ایجاد کردند، و از چرخه زندگی تحتسلطه گامتوفیت دور شدند. بافت آوندی نیز در پایان رشد عمودی بدون حمایت آب را تسهیل کرد و راه را برای فرگشت گیاهان بزرگتر در خشکی هموار کرد.
باور بر این است که یک زمین گوی برفی، از حدود ۷۲۰ تا ۶۳۵ میلیون سال پیش در دوره کریوژنین، توسط جانداران فتوسنتزی اولیه ایجاد شده است که غلظت کربن دیاکسید را کاهش داده و مقدار اکسیژن را در جو افزایش میدهد.[۲۷] بر اساس ارزیابی چنددهه پیش با ساعتهای مولکولی در یک مطالعه مربوط به سال ۲۰۲۲ مشاهده شد که زمان تخمینزده شده برای منشأ رویانسنگخزهایان چندسلولی در کریوژنین سرد قرار داشت درحالیکه جداسازی پسین رویانسنگخزهایان در ادیاکاران گرم اتفاق افتاد، که آنها از آن بهعنوان نشانهای از فشار انتخابی دوره یخبندان بر جانداران فتوسنتزکننده تعبیر کردند، گروهی از آنان موفق به زندهماندن در پناهگاه ادافیک نسبتاً گرمتر، که سپس در ادیاکران و پیدازیستی پسین در خشکی بهعنوان رویانداران رشد کردند. این مطالعه همچنین این نظریه را مطرح کرد که ریختشناسی تکسلولی و دیگر ویژگیهای منحصر بهفرد یوغیجلبکان ممکن است منعکس کننده سازگاریهای بیشتر با یک زندگی رواندوست باشد.[۲۸] ایجاد یک گیاگان خاکی باعث افزایش سرعت انباشت اکسیژن در جو شد، زیرا گیاهان خاکی اکسیژن را بهعنوان یک محصول زائد تولید میکردند. هنگامی که این غلظت به بالای ۱۳ درصد رسید، حدود ۰٫۴۵ میلیارد سال پیش،[۲۹] آتشسوزیهای جنگلی امکانپذیر شد، که از زغالچوب موجود در فسیلها مشهود است.[۳۰] جدا از یک شکاف بحث برانگیز در دوونین پسین، زغالچوب از آن هنگام وجود دارد.
فرگشت چرخۀ زندگی[ویرایش]

همه گیاهان چند سلولی یک چرخه زندگی شامل دو نسل یا فاز دارند. فاز گامتوفیت دارای یک مجموعه کروموزوم منفرد (با ۱n) است و گامت (اسپرم و تخمک) تولید میکند. فاز اسپوروفیت دارای کروموزومهای جفتی است (۲n نشان داده میشود) و هاگ تولید میکند. فازهای گامتوفیت و اسپوروفیت ممکن است همومورف باشند و در برخی از جلبکها مانند Ulva lactuca یکسان ظاهر میشوند، اما در همه گیاهان زمینی نوین بسیار متفاوت هستند، وضعیتی که به نام هترومورفی شناخته میشود.
الگوی فرگشت گیاه تغییر از همومورفی به هترومورفی بوده است. اجداد جلبکی گیاهان خشکی تقریباً به طور قطع هاپلوبیونتیک بودند و در همه چرخههای زندگی خود هاپلوئید بودند و یک زیگوت تک سلولی مرحله ۲N را فراهم میکرد. همه گیاهان خشکی (بهعنوان مثال جنین ها) دیپلوبیونتیک هستند - یعنی هر دو مرحله هاپلوئید و دیپلوئید چند سلولی هستند.[۶] دو روند آشکار است: بریوفیتها (جگر، خزهها و شاخک ها) گامتوفیت را بهعنوان مرحله غالب چرخه زندگی توسعه دادهاند و اسپوروفیت تقریباً به طور کامل به آن وابسته است. گیاهان آوندی اسپوروفیت را بهعنوان فاز غالب ایجاد کردهاند که گامتوفیتها به ویژه در گیاهان دانه کاهش مییابند.
بهعنوان مبنایی برای ظهور فاز دیپلوئیدی چرخه زندگی بهعنوان فاز غالب پیشنهاد شده است که دیپلوئیدی اجازه میدهد تا بیان جهشهای مضر را از طریق مکمل ژنتیکی پنهان کند.[۳۱][۳۲] بنابراین اگر یکی از ژنومهای والدین در سلولهای دیپلوئید دارای جهشهایی باشد که منجر به نقص در یک یا چند محصول ژنی میشود، این کمبودها میتواند توسط ژنوم والدین دیگر جبران شود (که با این وجود ممکن است نقصهای خاص خود را در ژنهای دیگر داشته باشد). از آنجایی که فاز دیپلوئید در حال غالب شدن بود، اثر پوشاندن احتمالاً اجازه میدهد اندازه ژنوم و در نتیجه محتوای اطلاعات، بدون محدودیت افزایش دقت همانندسازی افزایش یابد. فرصت افزایش محتوای اطلاعاتی با هزینه کم سودمند است زیرا امکان کدگذاری سازگاریهای جدید را فراهم میکند. این دیدگاه به چالش کشیده شده است، با شواهدی که نشان میدهد انتخاب در هاپلوئید موثرتر از مراحل دیپلوئید چرخه زندگی خزهها و نهاندانگان نیست.[۳۳]
دو نظریه رقیب برای توضیح ظاهر چرخه حیات دیپلوبیونتیک وجود دارد.
نظریه درونیابی (همچنین بهعنوان نظریه آنتیتتیک یا بینکالری شناخته میشود)[۳۴] باور دارد که درون یابی فاز اسپوروفیت چندسلولی میان دو نسل متوالی گامتوفیت یک نوآوری ناشی از میوز پیشی در یک زیگوت تازه جوانه زده با یک یا چند دور تقسیم میتوز بود. در نتیجه مقداری بافت چند سلولی دیپلوئیدی تولید میکند تا در نهایت میوز اسپور تولید کند. این نظریه نشان میدهد که نخستین اسپوروفیتها مورفولوژی بسیار متفاوت و سادهتری نسبت به گامتوفیتی داشتند که به آن وابسته بودند.[۳۴] به نظر میرسد این به خوبی با آنچه در مورد بریوفیتها شناخته شده است، مطابقت دارد، که در آن یک گامتوفیت تالوید رویشی یک اسپوروفیت ساده را پرورش میدهد، که از کمی بیشتر از یک اسپورانژیوم بدون شاخه روی یک ساقه تشکیل شده است. پیچیدگی فزاینده اسپوروفیت ساده اجدادی، از جمله به دست آوردن پایانی سلولهای فتوسنتزی، آن را از وابستگی به گامتوفیت رها میکند، همانطور که در برخی از شاخکها (Anthoceros) دیده میشود، و در نهایت منجر به رشد اندامها و بافت عروقی اسپوروفیت میشود و تبدیل به یک گامتوفیت میشود. فاز غالب، مانند تراکئوفیتها (گیاهان آوندی).[۶] این نظریه ممکن است با مشاهداتی تأیید شود که افراد کوچکتر کوکسونیا باید توسط یک نسل گامتوفیت پشتیبانی شده باشند. ظاهر مشاهدهشده اندازههای محوری بزرگتر، با فضایی برای بافت فتوسنتزی و در نتیجه خودپایداری، مسیر ممکنی را برای توسعه فاز اسپوروفیت خودکفا فراهم میکند.[۳۴]
فرضیه جایگزین، که نظریه تبدیل (یا نظریه همولوگ) نامیده میشود، بیان میکند که اسپوروفیت ممکن است به طور ناگهانی با به تاخیر انداختن وقوع میوز تا هنگامی که یک اسپوروفیت چند سلولی کاملاً توسعه یافته ظاهر شده باشد. از آنجایی که یک ماده ژنتیکی در هر دو فاز هاپلوئید و دیپلوئید به کار گرفته میشود، ظاهر یکسانی دارند. این رفتار برخی از جلبکها مانند Ulva lactuca را توضیح میدهد که فازهای متناوب اسپوروفیتها و گامتوفیتهای یکسان را تولید میکنند. سازگاری پسین با محیط خشکی خشک، که تولیدمثل جنسی را دشوار میکند، ممکن است منجر به سادهسازی گامتوفیت فعال جنسی، و بسط فاز اسپوروفیت برای پراکندگی بهتر هاگهای ضدآب شود.[۶] بافت اسپوروفیتها و گامتوفیتهای گیاهان آوندی مانند Rhynia که در چرت Rhynie نگهداری میشود، از پیچیدگی مشابهی برخوردار است که برای حمایت از این فرضیه استفاده میشود.[۳۴][۳۵][۳۶] در مقابل، گیاهان آوندی نوین، به استثنای Psilotum، دارای اسپوروفیتها و گامتوفیتهای هترومورفیک هستند که در آنها گامتوفیتها به ندرت دارای بافت آوندی هستند.[۳۷]
فرگشت آناتومی گیاهی[ویرایش]
همزیستی آربوسکولار میکوریز[ویرایش]
هیچ مدرکی مبنی بر اینکه گیاهان زمینی اولیه سیلورین و دوونین اولیه ریشه داشته باشند وجود ندارد، اگرچه شواهد فسیلی از ریزوئیدها برای چندین گونه مانند هورنئوفیتون وجود دارد. نخستین گیاهان زمینی نیز سامانه آوندی برای انتقال آب و مواد مغذی نداشتند. Aglaophyton، یک گیاه آوندی بدون ریشه که از فسیلهای دوونین در چرت Rhynie[۳۸] شناخته میشود، نخستین گیاه خشکی کشف شد که رابطه همزیستی با قارچها[۳۹] داشت که میکوریزاهای آربوسکولار، به معنای واقعی کلمه "ریشههای قارچی درخت مانند" را در استوانهای از سلولها به خوبی مشخص کردند. (حلقه در مقطع) در قشر ساقههای آن. قارچها در ازای مواد مغذی تولید شده یا استخراج شده از خاک (به ویژه فسفات) که گیاه در غیر این صورت به آنها دسترسی نداشت، از قندهای گیاه تغذیه میکردند. مانند دیگر گیاهان زمینی بی ریشه سیلورین و آگلاوفیتون اولیه دوونین ممکن است برای بدست آوردن آب و مواد مغذی از خاک به قارچهای میکوریز آربوسکولار متکی بوده باشند.
قارچها از شاخه گلومرومیکوتا بودند،[۴۰] گروهی که احتمالاً برای نخستین بار ۱ میلیارد سال پیش ظاهر شدند و هنوز هم امروزه با همه گروههای اصلی گیاهان زمینی از بریوفیتها تا پتریدوفیتها، بازدانگان و نهاندانگان و با بیش از ۸۰ درصد گیاهان آوندی، پیوندهای میکوریزی آربوسکولار را تشکیل میدهند.[۴۱]
شواهد حاصل از تجزیه و تحلیل توالی DNA نشان میدهد که متقابل میکوریزی آربوسکولار در اجداد مشترک این گروههای گیاهی زمین در طول انتقال آنها به زمین به وجود آمده است[۴۲] و حتی ممکن است این مرحله حیاتی باشد که آنها را قادر به استعمار زمین کرده است.[۴۳] قارچهای میکوریزا مانند پیش از فرگشت ریشههای این گیاهان، به گیاهان در کسب آب و مواد مغذی معدنی مانند فسفر کمک میکردند، در ازای ترکیبات آلی که خودشان نمیتوانستند آنها را سنتز کنند.[۴۴] چنین قارچهایی حتی بازده گیاهان سادهای مانند جگر را افزایش میدهند.[۴۵][۴۶]
کوتیکول، روزنه و فضاهای میان سلولی[ویرایش]
برای فتوسنتز، گیاهان باید CO۲ را از جو جذب کنند. با این حال، در دسترس قرار دادن دستمالها برای ورود CO۲ باعث میشود که آب تبخیر شود، بنابراین هزینهای دارد.[۴۶] آب بسیار سریعتر از جذب CO۲ از دست میرود، بنابراین گیاهان باید آن را جایگزین کنند. گیاهان زمینی اولیه آب را به صورت آپوپلاستیک، درون دیوارههای متخلخل سلول هایشان منتقل میکردند. سپس، آنها سه ویژگی تشریحی را ایجاد کردند که توانایی کنترل اتلاف آب اجتنابناپذیری را که همراه با کسب CO۲ بود، فراهم کردند. ابتدا یک پوشش بیرونی ضد آب یا کوتیکول ایجاد شد که از دست دادن آب را کاهش داد. ثانیاً، روزنههای متغیر، روزنههایی که میتوانند برای تنظیم مقدار آب از دست رفته در اثر تبخیر در طول جذب CO۲ باز و بسته شوند و سوم فضای میان سلولی میان سلولهای پارانشیم فتوسنتزی که باعث بهبود توزیع درونی CO۲در کلروپلاستها میشود. این سامانه سه بخشی همیو هیدری بهبود یافته، تنظیم محتوای آب بافتها را فراهم میکند و هنگامی که تامین آب ثابت نیست، مزیت خاصی را ارائه میدهد.[۴۷] غلظت بالای CO۲ سیلورین و دوونین اولیه، هنگامی که گیاهان برای نخستین بار در زمین استعمار کردند، به این معنی بود که آنها به طور نسبی از آب استفاده میکردند. همانطور که CO۲ توسط گیاهان از اتمسفر بیرون شد، آب بیشتری در جذب آن از دست رفت و سازوکارهای جذب و انتقال آب ظریفتر فرگشت یافت.[۴۶] گیاهانی که به سمت بالا در هوا رشد میکنند به سامانهی برای انتقال آب از خاک به همه بخشهای مختلف گیاه بالای خاک، به ویژه به بخشهای فتوسنتز کننده نیاز داشتند. در پایان دوره کربونیفر، هنگامی که غلظت CO۲ به چیزی نزدیک به امروز کاهش یافت، حدود ۱۷ برابر بیشتر آب در هر واحد جذب CO۲ از دست رفت.[۴۶] با این حال، حتی در روزهای "آسان" اولیه، آب همیشه در اولویت بود، و برای جلوگیری از خشک شدن باید از خاک مرطوب به بخشهایی از گیاه منتقل میشد.[۴۷]
آب را میتوان با عمل مویرگی در امتداد پارچهای با فضاهای کوچک فتح کرد. در ستونهای باریک آب، مانند ستونهای درون دیوارههای سلولی گیاه یا در تراکئیدها، وقتی مولکولها از یک انتها تبخیر میشوند، مولکولها را در امتداد کانالها به پشت خود میکشند. بنابراین تبخیر به تنهایی نیروی محرکه انتقال آب در گیاهان را فراهم میکند. با این حال، بدون مخازن ترابری تخصصی، این سازوکار چسبندگی کشش میتواند باعث ایجاد فشارهای منفی کافی برای فروپاشی سلولهای رسانای آب شود و آب انتقال را به بیش از چند سانتیمتر محدود کند و در نتیجه اندازه گیاهان اولیه را محدود کند.[۴۶]

گزیلم[ویرایش]
گیاهان برای رهایی از محدودیتهای اندازه کوچک و رطوبت ثابتی که سامانه ترابری پارانشیمی ایجاد میکرد، به سامانه انتقال آب کارآمدتری نیاز داشتند. همانطور که گیاهان به سمت بالا رشد کردند، بافتهای آوندی مخصوص حملونقل آب فرگشت یافتند، ابتدا به شکل هیدرووئیدهای ساده از گونه یافت شده در مجموعههای اسپوروفیت خزه. این سلولهای دراز ساده مرده و در زمان بلوغ پر از آب بودند و کانالی را برای انتقال آب فراهم میکردند، اما دیوارههای نازک و تقویتنشده آنها تحت کشش متوسط آب فرو میریختند و ارتفاع گیاه را محدود میکردند. تراکئیدهای آوند چوبی، سلولهای وسیعتر با دیوارههای سلولی تقویتشده با لیگنین که در برابر ریزش تحت تنش ناشی از تنش آبی مقاومتر بودند، در بیش از یک گروه گیاهی تا میانه سیلورین رخ میدهند، و ممکن است منشا فرگشتی واحدی داشته باشند، احتمالاً در شاخکها.[۴۸] همه تراکئوفیتها را متحد میکند. از طرف دیگر، ممکن است آنها بیش از یک بار فرگشت یافته باشند.[۴۶] بسیار بعد، در دوره کرتاسه، تراکئیدها توسط عروق در گیاهان گلدار دنبال شدند.[۴۶] با فرگشت سازوکارهای انتقال آب و کوتیکولهای ضد آب، گیاهان میتوانند بدون پوشاندن پیوسته توسط یک لایه آب زنده بمانند. این انتقال از poikilohydry به homoioiohydry پتانسیل جدیدی را برای استعمار باز کرد.[۴۶][۴۷]
پرتراکئوفیتهای اولیه دوونین، Aglaophyton و Horneophyton دارای لولههای انتقال آب تقویتنشده با ساختارهای دیوارهای بسیار شبیه به هیدرووئیدهای خزه هستند، اما آنها در کنار چندین گونه از تراکئوفیتها رشد کردند، مانند Rhynia gwynne-vaughanii که دارای تراشههای آوند چوبی بود که به خوبی با نوارهای نین تقویت شده بودند. نخستین ماکروفسیلهای شناخته شده دارای تراکئید آوند چوبی، گیاهان کوچک سیلورین میانی از جنس کوکسونیا هستند.[۴۹] با این حال، نوارهای ضخیم بر روی دیواره قطعات لوله جدا شده از سیلورین اولیه به بعد آشکار است.[۵۰]
گیاهان به ابداع روشهایی برای کاهش مقاومت در برابر جریان درون سلولهایشان ادامه دادند و به تدریج کارایی انتقال آب را افزایش دادند و مقاومت نایها را در برابر فروپاشی تحت تنش افزایش دادند.[۵۱][۵۲] در طول دوونین اولیه، حدبیشتر قطر تراکئید با گذشت زمان افزایش یافت، اما ممکن است در میانه دوونین در زوستروفیلها فلات شده باشد.[۵۱] نرخ انتقال کلی همچنین به سطح مقطع کلی خود دسته آوند چوبی بستگی دارد، و برخی از گیاهان دوونین میانی، مانند Trimerophytes، ستونهای بسیار بزرگتری نسبت به اجداد اولیه خود داشتند.[۵۱] در حالی که تراکئیدهای عریضتر نرخ انتقال آب بیشتری را فراهم میکردند، اما خطر کاویتاسیون، تشکیل حبابهای هوا ناشی از شکستن ستون آب تحت تنش را افزایش دادند.[۴۶] گودالهای کوچک در دیوارههای تراکئید به آب اجازه میدهند تا از تراکئید معیوب عبور کند و در عین حال مانع از عبور حبابهای هوا میشود،[۴۶] اما به قیمت نرخهای جریان محدود. در دوران کربونیفر، Gymnosperms حفرههای حاشیهدار، ساختارهای دریچهمانندی را ایجاد کرده بود[۵۳][۵۴] که به حفرههای با رسانایی بالا اجازه میدهد هنگامی که یک طرف تراکئید از فشار بیرون میشود، مهر و موم شوند.
تراکئیدها دارای دیوارههای انتهایی سوراخدار هستند که مقاومت بسیاری در جریان آب ایجاد میکنند،[۵۱] اما ممکن است این مزیت را داشته باشند که آمبولیهای هوای ناشی از کاویتاسیون یا یخ زدگی را جدا میکنند. آوندها ابتدا در دورههای خشک و کم CO۲ پرمین پسین، در دم اسبها، سرخسها و Selaginellales به طور مستقل فرگشت یافتند و سپس در میانه کرتاسه در گنتوفیتها و نهاندانگان ظاهر شدند.[۴۶] اعضای آوند لولههای باز بدون دیوارههای انتهایی هستند و از سر به انتها چیده شدهاند تا طوری عمل کنند که گویی یک آوند پیوسته هستند. آوندها به همان سطح مقطع چوب اجازه میدادند تا آب بیشتری را نسبت به تراکئیدها منتقل کند.[۴۶] این به گیاهان اجازه داد تا ساقههای بیشتری را با الیاف ساختاری پر کنند و همچنین یک طاقچه جدید به تاکها باز کرد که میتوانست آب را بدون ضخامت درختی که روی آن رشد کرده است، منتقل کند.[۴۶] علیرغم این مزایا، چوب بر پایه تراکئید بسیار سبکتر است، بنابراین ساخت آن ارزانتر است، زیرا رگها برای جلوگیری از کاویتاسیون باید بسیار تقویت شوند. هنگامی که گیاهان این سطح از کنترل را بر تبخیر آب و انتقال آب به دست آوردند، آنها واقعاً همیوهیدریک بودند و قادر بودند به جای تکیه بر لایهای از رطوبت سطحی، آب را از محیط خود از طریق اندامهای ریشه مانند استخراج کنند و به آنها امکان میداد تا به اندازه بسیار بیشتری رشد کنند.[۴۶][۴۷] اما در نتیجه افزایش استقلال آنها از محیط اطراف، بیشتر گیاهان آوندی توانایی خود را برای زنده ماندن در اثر خشک شدن از دست دادند - یک ویژگی پرهزینه برای از دست دادن.[۴۶] در گیاهان اولیه زمین، پشتیبانی بیشتر توسط فشار تورگر، به ویژه لایه بیرونی سلولها به نام تراکئید استروم، و نه بوسیله آوند چوبی، که بسیار کوچک، ضعیف و در موقعیت مرکزی برای ایجاد حمایت ساختاری بسیار ایجاد میشد، تأمین میشد.[۴۶] گیاهانی با آوند چوبی ثانویه که در میانه دوونین ظاهر شده بودند، مانند Trimerophytes و Progymnosperms، برشهای عروقی بسیار بزرگتری داشتند که بافت چوبی قوی تولید میکردند.
آندودرم[ویرایش]
اندودرم ممکن است در نخستین ریشههای گیاهی در طول دوره دوونین فرگشت یافته باشد، اما نخستین شواهد فسیلی برای چنین ساختاری کربونیفر است.[۴۶] اندودرم در ریشهها بافت انتقال آب را احاطه کرده و تبادل یونی میان آبهای زیرزمینی و بافتها را تنظیم میکند و از ورود عوامل بیماری زا ناخواسته و غیره به سامانه انتقال آب جلوگیری میکند. اندودرم همچنین میتواند فشاری رو به بالا ایجاد کند و هنگامی که تعرق به اندازه کافی محرک نیست، آب را از ریشه بیرون میکند.
فرگشت ریختشناسی گیاه[ویرایش]
برگها[ویرایش]
برگها اندامهای اولیه فتوسنتزی یک گیاه نوین هستند. منشاء برگها تقریباً به طور قطع با کاهش غلظت CO۲ اتمسفر در طول دوره دوونین ایجاد شد و کارایی جذب دی اکسید کربن برای فتوسنتز را افزایش داد.[۵۵][۵۶]
برگها قطعا بیش از یک بار فرگشت یافتهاند. بر اساس ساختار آنها به دو گونه تقسیم میشوند: میکروفیلها که فاقد تهویه پیچیده هستند و ممکن است به صورت برآمدگیهای خاردار به نام اناسیونها منشأ گرفته باشند و مگافیلها که بزرگ هستند و دارای تهویه پیچیده هستند که ممکن است از تغییر گروههای شاخهها به وجود آمده باشد. . پیشنهاد شده است که این ساختارها به طور مستقل بهوجود آمدهاند.[۵۷] بنابر نظریه تلوم والتر زیمرمن،[۵۸] مگافیلها از گیاهانی که معماری انشعاب سهپسین را نشان میدهند، از طریق سه تغییر شکل گرفتهاند - رو به رو شدن، که منجر به موقعیت جانبی معمولی برگها، کاشت، که شامل شکلگیری یک معماری مسطح، تار یا تار است. همجوشی، که شاخههای مسطح را متحد میکند، بنابراین منجر به تشکیل یک لایه برگ مناسب میشود. هر سه مرحله چندین بار در فرگشت برگهای امروزی اتفاق افتاده است.[۵۹]
به طور گستردهای اعتقاد بر این است که نظریه تلوم به خوبی توسط شواهد فسیلی پشتیبانی میشود. با این حال، ولفگانگ هاگمن آن را به دلایل ریختشناختی و بومشناختی زیر سؤال برد و یک نظریه جایگزین ارائه کرد.[۶۰][۶۱] در حالی که بنابر نظریه تلوم، ابتداییترین گیاهان زمینی دارای یک سامانه انشعاب سه پسین از محورهای متقارن شعاعی (تلوم ها) هستند، بنابر جایگزین هاگمن، برعکس آن پیشنهاد میشود: ابتداییترین گیاهان زمینی که گیاهان آوندی را به وجود آوردند، تخت و تالوید بودند. ، برگ مانند، بدون تبر، تا حدودی شبیه پروتالوس جگر یا سرخس. محورهایی مانند ساقه و ریشه سپس بهعنوان اندامهای جدید فرگشت یافتند. رولف ساتلر یک دیدگاه فرآیندمحور فراگیر ارائه کرد که فضای محدودی را برای نظریه تلووم و جایگزین هاگمن باقی میگذارد و بهجز این، کل پیوستار میان ساختارهای پشتی (مسطح) و شعاعی (استوانهای) را که میتوان در فسیلها و زندهها یافت، در نظر گرفت.[۶۲][۶۳] گیاهان زمینی این دیدگاه توسط پژوهشها در زمینه ژنتیک مولکولی پشتیبانی میشود. بنابراین، جیمز (۲۰۰۹)[۶۴] به این نتیجه رسید که "اکنون به طور گسترده پذیرفته شده است که ... شعاع [ویژگی محورهایی مانند ساقه] و پشتی شکمی [ویژگی برگها] جز افراطی یک دامنه پیوسته هستند. در واقع، این تنها زمانبندی است. بیان ژن KNOX!"

پیش از فرگشت برگها، گیاهان دارای دستگاه فتوسنتزی بر روی ساقهها بودند که آن را حفظ میکردند، اگرچه برگها تا حد بسیاری این کار را بر عهده داشتند. برگهای مگافیل امروزی احتمالاً در حدود ۳۶۰ میلیمتر، تقریباً ۴۰ میلیمتر پس از اینکه گیاهان ساده بیبرگ زمین را در دوونین اولیه مستعمره کردند، رایج شدند. این گسترش با کاهش غلظت دی اکسید کربن اتمسفر در پایان دوره پالئوزوئیک مرتبط با افزایش تراکم روزنهها در سطح برگ مرتبط است.[۵۵] این امر منجر به نرخ تعرق و تبادل گاز بیشتر میشود، اما بهویژه در غلظتهای بالای CO۲، برگهای بزرگ با روزنههای کمتر در نور کامل خورشید تا دمای کشنده گرم میشوند. افزایش تراکم روزنه اجازه میدهد تا یک برگ بهتر خنک شود، بنابراین گسترش آن امکان پذیر است، اما جذب CO۲ را به قیمت کاهش راندمان مصرف آب افزایش داد.[۵۶][۶۵]
رینیوفیتهای چرت Rhynie از چیزی بیش از تبرهای باریک و بدون تزئین تشکیل نمیشد. تری مروفیتهای دوونین اولیه تا میانی ممکن است برگدار در نظر گرفته شوند. این گروه از گیاهان آوندی با تودههای اسپورانژی انتهایی که انتهای محورهایی را که ممکن است منشعب یا سه شاخه شوند، تزئین میکنند، قابل تشخیص هستند.[۶] برخی از جانداران، مانند Psilophyton، مته سوراخ میشوند. اینها برآمدگیهای کوچک و خاردار ساقه هستند که فاقد منبع عروقی خاص خود هستند.

زوستروفیلها پیشاً در سیلورین پایان بسیار مهم بودند، بسیار زودتر از هر رینیوفیت با پیچیدگی مشابه.[۶۶] این گروه، با اسپورانژیای کلیه شکلشان که روی شاخههای جانبی کوتاه نزدیک به محورهای اصلی رشد میکردند، که گاهی به شکل H مشخص منشعب میشدند، قابل تشخیص هستند.[۶] بسیاری از زوستروفیلها خارهای مشخصی روی محورهای خود داشتند اما هیچکدام از اینها اثر عروقی نداشتند. نخستین شواهد جانداران عروقی در یک خزه فسیلی به نام باراگواناتیا رخ میدهد که پیشاً در فسیلهای سیلورین پسین ظاهر شده بود.[۶۷] در این جاندار، این آثار برگ به درون برگ ادامه مییابد تا رگبرگ میانی خود را تشکیل دهد.[۶۸] یک نظریه، "نظریه ی اناسیون" باور دارد که برگهای میکروفیل خزههای کلابی در اثر رشد پیش ستارهای که با جانداران موجود در ارتباط است، ایجاد شده است.[۶] منبع آوندی اولیه - به شکل ردپای برگ که از پیش ستاره مرکزی به سمت هر "برگ" منفرد حرکت میکند.[۶۹] Asteroxylon و Baragwanathia به طور گسترده بهعنوان lycopods ابتدایی در نظر گرفته میشوند،[۶] گروهی که هنوز هم امروزه وجود دارد و توسط خزهها، خزههای سنبله و خزههای کلوپی نمایش داده میشود. Lycopods دارای میکروفیلهای متمایز هستند که بهعنوان برگهایی با یک اثر آوندی منفرد تعریف میشوند. میکروفیلها میتوانند تا اندازهای رشد کنند، طول میکروفیلها به بیش از یک متر میرسد، اما تقریباً همه تنها یک دسته آوندی را تحمل میکنند. استثناء انشعاب نادر در برخی از گونههای سلاژینلا است.
تصور میشود که برگهای آشناتر، مگافیلها، چهار بار بهطور مستقل از سرخسها، دم اسبها، نطفهها و گیاهان بذری منشأ گرفتهاند.[۷۰] به نظر میرسد که آنها از اصلاح شاخههای دوتایی سرچشمه میگیرند، که ابتدا روی یکدیگر همپوشانی داشتند (یا «روی آنها» روی یکدیگر قرار گرفتند، مسطح یا کاشته شدند و در نهایت «بافتهای» ایجاد کردند و به تدریج به ساختارهای برگمانندتری تبدیل شدند.[۶۸] مگافیلها، بر اساس نظریه تلوم زیمرمن، از گروهی از شاخههای شبکهای تشکیل شدهاند[۶۸] و از این رو "شکاف برگ" در جایی که دسته آوندی برگ از شاخه اصلی جدا میشود، باقی میماند که شبیه دو محور شکافته است.[۶۸] در هر یک از چهار گروهی که مگافیلها را فرگشت دادند، برگهای آنها ابتدا در طول دوره دوونین پسین تا کربونیفر اولیه فرگشت یافتند و به سرعت متنوع شدند تا هنگامی که طرحها در میانه کربونیفر مستقر شدند.[۷۰]
توقف تنوع بیشتر را میتوان به محدودیتهای رشد نسبت داد،[۷۰] اما چرا در وهله نخست اینقدر طول کشید تا برگها فرگشت پیدا کنند؟ پیش از اینکه مگافیلها قابل توجه باشند، گیاهان حداقل ۵۰ میلیون سال روی زمین بودند. با این حال، مزوفیلهای کوچک و کمیاب از جنس دوونین اولیه Eophyllophyton شناخته شدهاند - بنابراین توسعه نمیتواند مانعی برای ظاهر آنها باشد.[۷۱] بهترین توضیح تاکنون مشاهداتی را شامل میشود که نشان میدهد دیاکسید کربن اتمسفر به سرعت در این زمان کاهش مییابد - که در طول دوونین حدود ۹۰ درصد کاهش مییابد.[۷۲] این امر مستلزم افزایش ۱۰۰ برابری تراکم روزنه برای حفظ سرعت فتوسنتز بود. هنگامی که روزنهها باز میشوند تا آب از برگها تبخیر شود، اثر خنک کنندگی دارد که در نتیجه از دست دادن گرمای نهان تبخیر ایجاد میشود. به نظر میرسد که چگالی کم روزنهای در دوونین اولیه به این معنی بود که تبخیر و سرد شدن تبخیری محدود بود و اگر برگها به هر اندازه بزرگ شوند بیش از حد گرم میشدند. تراکم روزنه نمیتواند افزایش یابد، زیرا استلهای اولیه و سامانههای ریشه محدود قادر به تامین سریع آب برای مطابقت با میزان تعرق نیستند.[۵۶] واضح است که برگها همیشه مفید نیستند، همانطور که با وقوع مکرر ریزش ثانویه برگها نشان داده میشود که نمونههای معروف آن توسط کاکتوسها و "سرس همزن" Psilotum است.
فرگشت ثانویه همچنین میتواند منشا فرگشتی واقعی برخی از برگها را پنهان کند. برخی از جنسهای سرخس برگهای پیچیدهای را نشان میدهند که با رشد بسته آوندی به شبهدسته متصل میشوند و هیچ شکاف برگی باقی نمیگذارند.[۶۸] بهجز این، برگهای دم اسبی (Equisetum) تنها یک رگبرگ دارند و به نظر میرسد که میکروفیلوس هستند. با این حال، هم سوابق فسیلی و هم شواهد مولکولی نشان میدهند که اجدادشان برگهایی با تهویه پیچیده داشتند و وضعیت فعلی نتیجه سادهسازی ثانویه است.[۷۳]
درختان برگ ریز یکی دیگر از مضرات داشتن برگ را دارند. این باور عمومی که گیاهان وقتی روزها بسیار کوتاه میشوند، برگهای خود را میریزند، اشتباه است. گیاهان همیشه سبز در طول جدیدترین زمین گلخانهای در دایره قطب شمال رشد کردند.[۷۴] دلیل عموماً پذیرفتهشده ریزش برگها در طول زمستان، مقابله با آبوهوا است - نیروی باد و وزن برف بدون برگ برای افزایش مساحت بسیار راحتتر هوازدگی میکنند. ریزش برگ فصلی چندین بار به طور مستقل فرگشت یافته است و در جینکوئلها، برخی پینوفیتاها و نهاندانگانی خاص به نمایش گذاشته شده است.[۷۵] ریزش برگ نیز ممکن است در پاسخ به فشار حشرات ایجاد شده باشد. ممکن است از میان رفتن کامل برگها در فصل زمستان یا فصل خشک کمتر از ادامه سرمایه گذاری منابع برای تعمیر آنها باشد.[۷۶]
عوامل مؤثر بر معماری برگ[ویرایش]
عوامل مختلف فیزیکی و فیزیولوژیکی مانند شدت نور، رطوبت، دما، سرعت باد و غیره بر فرگشت شکل و اندازه برگ تأثیر گذاشتهاند. درختان مرتفع به ندرت دارای برگهای بزرگ هستند، زیرا در اثر بادهای شدید آسیب میبینند. به طور مشابه، درختانی که در مناطق معتدل یا تایگا رشد میکنند، احتمالاً برای جلوگیری از هسته زایی یخ بر روی سطح برگ و کاهش از دست دادن آب به دلیل تعرق، برگهای نوک تیز دارند.[۷۷] گیاهخواری، توسط پستانداران و حشرات، یک نیروی محرکه در فرگشت برگ بوده است. یک مثال این است که گیاهانی از جنس نیوزیلندی Aciphylla دارای خارهایی بر روی لایههای خود هستند که احتمالاً باعث منصرف شدن موآسهای منقرض شده از تغذیه آنها میشود. دیگر اعضای Aciphylla که با موآها همزیستی نداشتند، این خارها را ندارند.[۷۸]
در سطح ژنتیکی، مطالعات رشدی نشان دادهاند که سرکوب ژنهای KNOX برای آغاز پریموردیوم برگ مورد نیاز است. این توسط ژنهای ARP که فاکتورهای رونویسی را رمزگذاری میکنند، ایجاد میشود. به نظر میرسد سرکوب ژنهای KNOX در پریموردیای برگ کاملاً حفظ شده باشد، در حالی که بیان ژنهای KNOX در برگها باعث ایجاد برگهای پیچیده میشود. به نظر میرسد عملکرد ARP در آغاز فرگشت گیاهان آوندی بهوجود آمده است، زیرا اعضای گروه اولیه Lycophytes نیز دارای یک ژن عملکردی مشابه هستند.[۷۹] دیگر بازیکنانی که نقش حفاظتی در تعریف پریموردیای برگ دارند، فیتوهورمونهای اکسین، جیبرلین و سیتوکینین هستند.

چینش برگها یا فیلوتاکسی روی بدن گیاه میتواند حدبیشتر نور را برداشت کند و ممکن است انتظار میرود که از نظر ژنتیکی قوی باشد. با این حال، در ذرت، جهش تنها در یک ژن به نام ABPHYL (PHYLlotaxy غیرطبیعی) برای تغییر فیلوتاکسی برگها کافی است، که به این معنی است که تنظیم جهش یک مکان منفرد روی ژنوم برای ایجاد تنوع کافی است.[۸۰]
هنگامی که سلولهای اولیه برگ از سلولهای SAM ایجاد میشوند، محورهای جدید برای رشد برگ تعریف میشوند که از جمله آنها محورهای محوری-آداکسیال (سطح پایین-بالایی) هستند. به نظر میرسد ژنهای دخیل در تعریف این و دیگر محورها در میان گیاهان عالی کم و بیش حفظ شده باشند. پروتئینهای خانواده HD-ZIPIII در تعریف هویت آکسیال نقش دارند. این پروتئینها برخی از سلولهای پریموردیوم برگ را از حالت پیشفرض محوری منحرف میکنند و آنها را آکسیال میکنند. در گیاهان اولیه با برگ، برگها احتمالاً تنها یک گونه سطح داشتند - سطح محوری، سطح زیرین برگهای امروزی. تعریف هویت محوری حدود ۲۰۰ میلیون سال پس از ایجاد هویت محوری رخ داد.[۸۱]
اینکه چگونه تنوع گستردهای از مورفولوژی برگ گیاهی مشاهده شده ایجاد میشود موضوع پژوهشها شدید است. برخی از موضوعات مشترک پدیدار شده است. یکی از مهمترین آنها دخالت ژنهای KNOX در تولید برگهای ترکیبی است، مانند گوجه فرنگی (به بالا مراجعه کنید). اما، این جهانی نیست. بهعنوان مثال، نخود از سازوکار متفاوتی برای انجام همان کار استفاده میکند.[۸۲][۸۳] جهش در ژنهای مؤثر بر انحنای برگ نیز میتواند شکل برگ را با تغییر شکل برگ از صاف به شکل چروک[۸۴] مانند شکل برگهای کلم تغییر دهد. همچنین شیبهای مورفوژن متفاوتی در یک برگ در حال رشد وجود دارد که محور برگ را مشخص میکند و همچنین ممکن است شکل برگ را تحت تأثیر قرار دهد. دسته دیگری از تنظیم کنندههای رشد برگ، میکرو RNAها هستند.[۸۵][۸۶]
ریشهها[ویرایش]
ریشهها به دو دلیل برای گیاهان مهم هستند: نخست اینکه آنها به بستر لنگر میاندازند. مهمتر از آن، آنها منبع آب و مواد مغذی را از خاک فراهم میکنند. ریشهها به گیاهان اجازه میدهند بلندتر و سریعتر رشد کنند.
فرگشت ریشهها پیامدهایی در مقیاس جهانی داشت. آنها با ایجاد اختلال در خاک و ترویج اسیدی شدن آن (با جذب مواد مغذی مانند نیترات و فسفات[۸۷])، آن را قادر ساختند تا هوای عمیقتری داشته باشد و ترکیبات کربن را عمیقتر به خاک تزریق کرد[۸۸] که پیامدهای بسیاری برای آبوهوا دارد.[۸۹] این اثرات ممکن است آنقدر عمیق بوده باشد که منجر به انقراض دسته جمعی شود.[۹۰]
در حالی که آثاری از تأثیرات ریشه مانند در خاکهای فسیلی در سیلورین پسین وجود دارد،[۹۱] فسیلهای بدن نشان میدهد که گیاهان اولیه فاقد ریشه هستند. بسیاری از آنها شاخههای سجدهای داشتند که در امتداد زمین پراکنده بودند، با تبرهای عمودی یا تالیهایی که اینجا و آنجا نقطهگذاری شده بودند، و حتی برخی شاخههای زیرزمینی غیرفتوسنتزی داشتند که فاقد روزنه بودند. تمایز میان شاخه ریشه و تخصصی رشدی است. که در الگوی انشعاب آنها و داشتن کلاهک ریشه متفاوت است.[۱۱] بنابراین، در حالی که گیاهان سیلورو-دوونی مانند Rhynia و Horneophyton دارای معادل فیزیولوژیکی ریشه بودند،[۹۲][۹۳] ریشهها - که بهعنوان اندامهای متمایز از ساقهها تعریف میشوند - تا دیرتر وارد نشدند.[۱۱] متأسفانه، ریشهها به ندرت در آثار فسیلی حفظ میشوند و درک ما از منشأ فرگشتی آنها پراکنده است.[۱۱]
ریزوئیدها - ساختارهای کوچکی که همان نقش ریشهها را ایفا میکنند، معمولاً یک سلول به قطر - احتمالاً بسیار زود فرگشت یافتهاند، شاید حتی پیش از اینکه گیاهان زمین را مستعمره کنند؛ آنها در Characeae، یک گروه خواهر جلبکی برای کاشت گیاهان شناخته میشوند.[۱۱] گفته میشود، ریزوئیدها احتمالاً بیش از یک بار فرگشت یافتهاند. بهعنوان مثال، ریزهای گلسنگها نقش مشابهی را ایفا میکنند. حتی برخی از جانوران (Lamellibrachia) ساختارهای ریشه مانندی دارند.[۱۱] ریزوئیدها به روشنی در فسیلهای چرت Rhynie قابل مشاهده هستند و در بیشتر گیاهان آوندی اولیه وجود داشتند و بر این اساس به نظر میرسد که ریشههای گیاهی واقعی را پیشبینی کردهاند.[۹۴]
ساختارهای پیشرفتهتر در چرت Rhynie و بسیاری دیگر از فسیلهای مشابه در دوران اولیه دوونین ساختارهای خرسهایی را دارند که شبیه ریشهها هستند و شبیه به آنها عمل میکنند.[۱۱] رینیوفیتها دارای ریزوئیدهای ظریف بودند و تری مروفیتها و لیکوپودهای علفی چرت دارای ساختار ریشه مانندی بودند که چند سانتیمتر به درون خاک نفوذ میکردند.[۹۵] با این حال، هیچ یک از این فسیلها همه ویژگیهای ریشههای نوین را نشان نمیدهند،[۱۱] به استثنای Asteroxylon که اخیراً بهعنوان ریشههایی شناخته شده است که مستقل از گیاهان آوندی موجود فرگشت یافتهاند.[۹۶] ریشهها و ساختارهای ریشهمانند در طول دوره دوونین به طور فزایندهای متداول و عمیقتر شدند، با درختان لیکوپود که ریشههایی به طول حدود ۲۰ سانتیمتر در طول دوره ایفلین و گیوتین تشکیل دادند. در مرحله فراسنی پسین، نطفههایی که تا عمق یک متری ریشه داشتند به آنها پیوستند.[۹۵] بازدانگانی واقعی و سرخسهای زیگوپترید نیز سامانههای ریشه زایی کم عمقی را در طول دوره فامنین تشکیل دادند.[۹۵]
ریزوفورهای لیکوپودها رویکرد کمی متفاوت برای ریشه زایی ارائه میدهند. آنها معادل ساقه بودند، با اندامهایی معادل برگ که نقش ریشهچه را ایفا میکردند.[۱۱] ساختار مشابهی در lycopod Isoetes موجود مشاهده میشود، و به نظر میرسد این شواهدی باشد که ریشهها حداقل دو بار به طور مستقل در لیکوفیتها و دیگر گیاهان فرگشت یافتهاند،[۱۱] پیشنهادی که توسط مطالعات نشان میدهد که ریشهها آغاز میشوند و رشد آنها توسط سازوکارهای مختلف در گیاهان تقویت میشود. لیکوفیتها و یوفیلوفیتها.[۹۷]
سامانه آوندی برای گیاهان ریشهدار ضروری است، زیرا ریشههای غیر فتوسنتزکننده نیاز به تامین قند دارند و سامانه آوندی برای انتقال آب و مواد مغذی از ریشه به بقیه بخشهای گیاه مورد نیاز است.[۱۰] گیاهان ریشه دار کمی پیشرفتهتر از اجداد سیلوری خود هستند، بدون سامانه ریشه اختصاصی. با این حال، میتوان به روشنی مشاهده کرد که تبرهای تخت خواب دارای رشدهایی شبیه به ریزوئیدهای بریوفیتهای امروزی هستند.[۹۸]
در میانه تا پایان دوونین، بیشتر گروههای گیاهان به طور مستقل یک سامانه ریشهزایی با طبیعت ایجاد کرده بودند.[۹۸] با بزرگتر شدن ریشهها، میتوانستند درختان بزرگتر را حمایت کنند و خاک تا عمق بیشتری هوازدگی میکرد.[۹۰] این هوازدگی عمیقتر نه تنها بر کاهش CO۲ یادشده تأثیر داشت، بلکه زیستگاههای جدیدی را برای استعمار توسط قارچها و جانوران باز کرد.[۹۵]
امروزه ریشهها تا حد فیزیکی رشد کردهاند. آنها به اندازه ۶۰ متر خاک نفوذ میکنند تا از سطح آب استفاده کنند.[۹۹] باریکترین ریشهها تنها ۴۰ میکرومتر قطر دارند و اگر باریک تر باشند نمیتوانند آب را انتقال دهند.[۱۱] در مقابل، نخستین ریشههای فسیلی بازیابی شده از ۳ میلی متر به کمتر از ۷۰۰ میکرومتر در قطر کاهش یافتند. البته تافونومی کنترل پایانی ضخامتی است که میتوان دید.[۱۱]
شکل درختی[ویرایش]

مناظر اولیه دوونین فاقد پوشش گیاهی بلندتر از ارتفاع کمر بود. ارتفاع بیشتر یک مزیت رقابتی در برداشت نور خورشید برای فتوسنتز، تحت الشعاع قرار گرفتن رقبا و توزیع هاگ ایجاد میکند، زیرا هاگها (و سپس، دانهها) در صورت آغاز بالاتر میتوانند در فواصل بیشتری دمیده شوند. یک سامانه عروقی مؤثر برای دستیابی به ارتفاعات بیشتر مورد نیاز بود. برای رسیدن به درختکاری، گیاهان باید بافت چوبی ایجاد میکردند که هم پشتیبانی و هم انتقال آب را فراهم میکرد و بنابراین نیاز به فرگشت ظرفیت رشد ثانویه داشت. استل گیاهان تحت رشد ثانویه توسط یک کامبیوم آوندی احاطه شده است، حلقهای از سلولهای مریستمی که آوند چوبی بیشتری در درون و آبکش در بیرون تولید میکند. از آنجایی که سلولهای آوند چوبی شامل بافتهای مرده و lignified هستند، حلقههای پسین آوند چوبی به حلقههای موجود اضافه میشوند و چوب را تشکیل میدهند. فسیلهای گیاهان مربوط به دوره دوونین اولیه نشان میدهد که شکل سادهای از چوب برای نخستین بار حداقل ۴۰۰ میلیون سال پیش ظاهر شد، در هنگامی که همه گیاهان خشکی کوچک و علفی بودند.[۱۰۰] از آنجا که چوب بسیار پیش از درختچهها و درختان فرگشت یافته است، احتمالاً هدف اصلی آن ترابری آب بوده است و سپس تنها برای پشتیبانی مکانیکی مورد استفاده قرار گرفته است.[۱۰۱]

نخستین گیاهانی که رشد ثانویه و عادت چوبی پیدا کردند، گویا سرخسها بودند و در آغاز گونههای دوونین میانی، Wattieza، پیشاً به ارتفاع ۸ متر رسیده بود و عادتی شبیه به درخت داشت.[۱۰۲]
دیگر کلادها طولی نکشید که قد درخت مانندی پیدا کردند. آرکئوپتریس دوونین متأخر، پیش ساز بازدانگان که از تریمروفیتها فرگشت یافتهاند،[۱۰۳] به ارتفاع ۳۰ متر میرسد. پروبازدانگان نخستین گیاهانی بودند که چوب واقعی را رشد دادند که از کامبیوم دو صورت رشد کرد. نخستین ظهور یکی از آنها، Rellimia، در دوونین میانی بود.[۱۰۴] تصور میشود که چوب واقعی تنها یک بار فرگشت یافته است و مفهوم کلاد "لیگنوفیت" را به وجود آورده است.
جنگلهای باستان شناسی به زودی با لیکوپودهای درختزی به شکل لپیدودندرالها تکمیل شدند که ارتفاع آنها از ۵۰ متر و در قاعده به ۲ متر میرسد. این لیکوپودهای درختزی بر جنگلهای دوونین پسین و کربونیفر مسلط شدند که باعث ایجاد ذخایر زغالسنگ شدند.[۱۰۵] لپیدودندرالها از نظر رشد مشخص با درختان نوین تفاوت دارند: پس از ایجاد ذخیرهای از مواد مغذی در ارتفاع پایین تر، گیاهان به صورت یک تنه به ارتفاع تعیین شده ژنتیکی میپیچند، در آن سطح شاخه میشوند، هاگهای خود را پخش میکنند و میمیرند.[۱۰۶] آنها از چوب "ارزان" تشکیل شده بودند تا رشد سریع آنها امکان پذیر باشد و حداقل نیمی از ساقههای آنها دارای یک حفره پر از مغز باشد.[۶] چوب آنها همچنین توسط یک کامبیوم آوندی تک صورت تولید میشود - آبکش جدیدی تولید نمیکند، به این معنی که تنهها نمیتوانند در طول زمان بزرگتر شوند.
کالامیت دم اسبی در کربونیفر ظاهر شد. برخلاف Equisetum نوین دم اسبی، کالامیتها دارای یک کامبیوم آوندی یکصورت بودند که به آنها اجازه میداد تا چوب رشد کنند و تا ارتفاع بیش از ۱۰ متر رشد کنند و به طور مکرر شاخه شوند.

در حالی که شکل درختان اولیه شبیه به شکل امروزی بود، اسپرماتوفیتها یا گیاهان دانه، گروهی که همه درختان نوین را در بر میگیرند، هنوز فرگشت نیافته بودند. گروههای درختی غالب امروزه همه گیاهان دانهدار، بازدانگان که شامل درختان مخروطی هستند و گلدانگان که شامل همه درختان بارده و گلدهنده هستند، هستند. هیچ درخت بدون اسپور مانند Archaeopteris در فلور موجود وجود ندارد. مدتها تصور میشد که نهاندانگان از درون بازدانگان به وجود آمدهاند، اما شواهد مولکولی اخیر نشان میدهد که نمایندگان زنده آنها دو گروه مجزا را تشکیل میدهند.[۱۰۷][۱۰۸][۱۰۹] دادههای مولکولی هنوز به طور کامل با دادههای ریختشناختی تطبیق داده نشدهاند،[۱۱۰][۱۱۱][۱۱۲] اما پذیرفته شده است که حمایت ریختشناختی برای پارافیلی قوی نیست.[۱۱۳] این منجر به این نتیجه میشود که هر دو گروه از درون پتریدوسپرمها، احتمالاً در آغاز دوره پرمین، پدید آمدهاند.[۱۱۳]
نهاندانگان و اجداد آنها تا هنگامی که در دوره کرتاسه تنوع پیدا کردند نقش بسیار کمی داشتند. آنها بهعنوان جانداران کوچک و مرطوب دوست در زیر زمین آغاز به کار کردند و از دوره کرتاسه[۱۱۴] در حال تنوع بودهاند تا امروزه به عضو غالب جنگلهای غیر شمالی تبدیل شوند.
دانهها[ویرایش]

گیاهان اولیه زمینی که به روش سرخسها تکثیر میشدند: هاگها به گامتوفیتهای کوچکی جوانه زدند که تخم و/یا اسپرم تولید میکردند. این اسپرمها در خاکهای مرطوب شنا میکنند تا اندامهای ماده (آرکگونیا) را روی همان گامتوفیت یا گامتوفیت دیگری پیدا کنند، جایی که با تخمک ترکیب میشوند تا جنینی تولید کنند که به اسپوروفیت جوانه میزند.[۹۵]
گیاهان هتروسپوریک، همانطور که از نامشان پیداست، اسپورهایی با دو اندازه دارند - میکروسپور و مگاسپور. اینها به ترتیب جوانه زده و میکروگامتوفیتها و مگاگامتوفیتها را تشکیل میدهند. این سامانه راه را برای تخمکها و دانهها هموار کرد: مگاسپورانژیا میتوانست تنها یک مگاسپور تتراد را تحمل کند، و برای تکمیل انتقال به تخمکهای واقعی، سه مگاسپور در تتراد اصلی سقط میشوند و در هر مگاسپورانگیوم یک مگاسپور باقی میماند.

انتقال به تخمکها با این مگاسپور که در حین جوانه زدن به اسپورانژیوم خود "جعبه" میشد ادامه یافت. سپس مگاگامتوفیت درون یک پوشش ضدآب قرار گرفت که دانه را محصور کرد. دانه گرده که دارای یک میکروگامتوفیت جوانه زده از یک میکروسپور بود، برای پراکندگی گامت نر استفاده شد و تنها هنگامی که به یک مگاگامتوفیت پذیرنده رسید، اسپرم تاژکدار مستعد خشک شدن آزاد شد.[۶]
لایکوپودها و اسفنوپسیدها بدون اینکه از آستانه عبور کنند، مسیر عادلانهای را به سمت عادت بذر طی کردند. مگاسپورهای فسیلی لیکوپود با قطر ۱ سانتیمتر و احاطه شده توسط بافت رویشی شناخته شده است (Lepidocarpon، Achlamydocarpon)؛ اینها حتی به صورت مگاگامتوفیت در محل جوانه میزنند. با این حال، آنها تخمک نداشتند، زیرا هسته، یک لایه درونی پوشاننده هاگ، بهطور کامل اسپور را دربرنمیگیرد. یک شکاف بسیار کوچک (میکروپیل) باقی میماند، به این معنی که مگاسپورانگیوم هنوز در معرض جو است. این دو پیامد دارد - نخست اینکه به این معنی است که به طور کامل در برابر خشک شدن مقاوم نیست و دوم اینکه اسپرم برای دسترسی به آرکگونیای مگاسپور نیازی به "نقف کردن" ندارد.[۶]
یک پیش ساز دوونین میانی برای گیاهان بذری از بلژیک شناسایی شده است که در حدود ۲۰ میلیون سال پیش از نخستین گیاهان بذری قدمت دارد. رانکاریا، کوچک و متقارن شعاعی، یک مگاسپورانژیوم پوشیده شده است که توسط یک کوپول احاطه شده است. مگاسپورانژیوم دارای یک پسوند دیستال باز نشده است که بالای پوشش چند لوبی بیرون زده است. گمان میرود که اکستنشن در گرده افشانی آنموفیل نقش داشته باشد. Runcaria نور جدیدی را بر توالی اکتساب شخصیت منتهی به دانه میافکند. رانکاریا همه خصوصیات گیاهان بذری را دارد به جز پوشش دانه جامد و سامانه برای هدایت گرده به سمت تخمک.[۱۱۵]
نخستین اسپرماتوفیتها (به معنای واقعی کلمه: "گیاهان دانه") - یعنی نخستین گیاهانی که دانههای واقعی را تولید کردند - پتریدوسپرم نامیده میشوند: به معنای واقعی کلمه "سرس بذر" نامیده میشود، زیرا شاخ و برگ آنها از شاخههای سرخس مانند تشکیل شده بود، اگرچه آنها چنین نبودند. نزدیک به سرخس. قدیمیترین شواهد فسیلی گیاهان بذر مربوط به دوره دوونین پسین است و به نظر میرسد که آنها از یک گروه پیشی به نام نطفههای نطفهای فرگشت یافتهاند. این گیاهان بذر اولیه از درخت گرفته تا درختچههای کوچک و پرتغالی را در بر میگرفت. مانند بسیاری از نطفههای اولیه، آنها گیاهان چوبی با شاخ و برگ سرخس مانند بودند. همه آنها تخمک داشتند، اما بدون مخروط، میوه یا مشابه. در حالی که ردیابی فرگشت اولیه دانهها دشوار است، اصل و نسب سرخسهای دانه ممکن است از تری مروفیتهای ساده از طریق آنوروفیتهای همسپور ردیابی شود.[۶] گیاهان بذری نخستین تشعشعات فرگشتی عمده خود را در عصر فامنین متحمل شدند.[۱۱۶]
این مدل بذر اساساً با همه بازدانگان (به معنای واقعی کلمه: "دانههای برهنه") مشترک است، که بیشتر آنها دانههای خود را در یک مخروط چوبی یا ارل گوشتی (مانند سرخدار) میپوشانند، اما هیچ کدام به طور کامل دانههای خود را در بر نمیگیرند. نهاندانگان ("دانههای رگ") تنها گروهی هستند که دانه را به طور کامل در برچه محصور میکنند.
بذرهای کاملاً محصور مسیر جدیدی را برای گیاهان باز کردند: مسیر خواب بذر. جنین که کاملاً از اتمسفر بیرونی جدا شده و در نتیجه از خشک شدن محافظت میشود، میتواند چندین سال از خشکسالی پیش از جوانه زدن زنده بماند. دانههای Gymnosperm از پایان کربونیفر دارای جنین هستند که نشاندهنده فاصله طولانی میان لقاح و جوانهزنی است.[۱۱۷] این دوره با ورود به دوره زمین گلخانهای همراه با افزایش خشکی همراه است. این نشان میدهد که خواب بهعنوان پاسخی به شرایط آبوهوایی خشکتر به وجود آمد، جایی که انتظار برای یک دوره مرطوب پیش از جوانهزنی مفید بود.[۱۱۷] به نظر میرسد که این پیشرفت فرگشتی دروازهای را باز کرده است: مناطقی که پیشاً غیرقابل مهماننواز بودند، مانند دامنههای کوههای خشک، اکنون قابل تحمل بودند و به زودی توسط درختان پوشیده شدند.[۱۱۷]
دانهها مزایای بیشتری برای حاملان خود داشتند: آنها میزان موفقیت گامتوفیتهای بارور شده را افزایش دادند، و از آنجایی که میتوان یک انبار مواد مغذی را با جنین "بسته بندی" کرد، دانهها میتوانند به سرعت در محیطهای نامناسب جوانه بزنند و به اندازهای برسند که بتواند خود را سریعتر حفظ کند.[۹۵] بهعنوان مثال، بدون آندوسپرم، نهالهایی که در محیطهای خشک رشد میکنند، ذخایری برای رشد ریشههای آنقدر در عمق برای رسیدن به سطح آب پیش از انقضای آنها در اثر کمآبی ندارند.[۹۵] به همین ترتیب، بذرهایی که در زیرزمینی تیره و تار جوانه میزنند، به ذخیره انرژی اضافی نیاز دارند تا به سرعت رشد کنند تا نور کافی را برای حفظ خود جذب کنند.[۹۵] ترکیبی از این مزایا به گیاهان بذر برتری بومشناختی نسبت به جنس غالب پیشی Archaeopteris داد و در نتیجه تنوع زیستی جنگلهای اولیه را افزایش داد.[۹۵]
باوجود این مزایا، تخمکهای بارور شده بهعنوان بذر بالغ نمیشوند.[۱۱۸] همچنین در طول خواب بذر (اغلب با شرایط غیرقابل پیشبینی و تنشزا همراه است) آسیب DNA تجمع مییابد.[۱۱۹][۱۲۰][۱۲۱] بنابراین آسیب DNA به نظر میرسد یک مشکل اساسی برای بقای گیاهان دانهای باشد، همانطور که آسیب DNA به طور کلی یک مشکل اساسی برای زندگی است.[۱۲۲]
گلها[ویرایش]

گلها، برگهای تغییر یافتهای هستند که تنها در اختیار گلدانهای گیاهی قرار دارند که نسبتاً دیر ظاهر شدهاند و در آثار فسیلی ظاهر میشوند. این گروه در دوره کرتاسه اولیه شکل گرفت و متنوع شد و پس از آن از نظر بومشناختی مهم شد.[۱۲۳] ساختارهای گل مانند برای نخستین بار در سوابق فسیلی حدود ۱۳۰ میلیون میلی متر، در کرتاسه ظاهر میشود.[۱۲۴] با این حال، در سال ۲۰۱۸، دانشمندان از کشف یک گل فسیلی مربوط به حدود ۱۸۰ میلیون سال پیش، ۵۰ میلیون سال زودتر از آنچه پیشتر تصور میشد، گزارش دادند.[۱۲۵] با این حال، این تفسیر به شدت مورد مناقشه قرار گرفته است.[۱۲۶]
ساختارهای رنگارنگ و/یا تند مخروطهای گیاهانی مانند سیکادها و گنتالها را احاطه کردهاند و تعریف دقیقی از اصطلاح «گل» را ناممکن میسازند.[۱۱۲]
وظیفه اصلی گل تولیدمثل است که پیش از فرگشت گل و نهاندانگان، کار میکروسپوروفیلها و مگاسپوروفیلها بوده است. یک گل را میتوان یک نوآوری فرگشتی قدرتمند در نظر گرفت، زیرا وجود آن به دنیای گیاهان اجازه داد تا به ابزارها و سازوکارهای جدیدی برای تولیدمثل دسترسی پیدا کند.
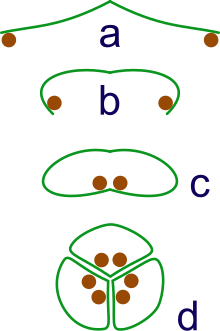
d: grouping of three rolls into a syncarp
مدتها تصور میشد که گیاهان گلدار از درون بازدانگان فرگشت یافتهاند. با توجه به دیدگاه مرفولوژیکی سنتی، آنها نزدیک به Gnetales هستند. با این حال، همانطور که در بالا ذکر شد، شواهد مولکولی اخیر در تضاد با این فرضیه است،[۱۰۸][۱۰۹] و همچنین نشان میدهد که گنتالها بیشتر از نهاندانگان به برخی از گروههای بازدانگان مرتبط هستند[۱۰۷] و بازدانگانی موجود یک کلاد متمایز از نهاندانگان را تشکیل میدهند،[۱۰۷][۱۰۸][۱۰۹] این دو کلاد حدود ۳۰۰ میلیون سال پیش از هم جدا شدند.[۱۲۷]
ارتباط گروههای ساقه با گل نباتی در تعیین فرگشت گلها مهم است. گروههای ساقه بینشی از وضعیت "چنگال"های پیشی در مسیر به وضعیت فعلی ارائه میدهند. همگرایی خطر شناسایی نادرست گروههای ساقه را افزایش میدهد. از آنجایی که حفاظت از مگاگامتوفیت از نظر فرگشتی مطلوب است، احتمالاً بسیاری از گروههای جداگانه پوششهای محافظ را به طور مستقل فرگشت دادهاند. در گلها، این محافظت به شکل برچه شکل میگیرد که از یک برگ فرگشت یافته و به نقش محافظتی تبدیل میشود و از تخمکها محافظت میکند. این تخمکها بیشتر توسط یک پوشش دو جداره محافظت میشوند.
نفوذ این لایههای محافظ به چیزی بیش از یک میکروگامتوفیت شناور آزاد نیاز دارد. نهاندانگان دارای دانههای گردهای هستند که تنها از سه سلول تشکیل شده است. یک سلول مسئول سوراخ کردن پوستهها و ایجاد مجرای برای جریان دو سلول اسپرم به سمت پایین است. مگاگامتوفیت تنها هفت سلول دارد. یکی از آنها با یک سلول اسپرم ترکیب میشود و هسته خود تخمک را تشکیل میدهد و دیگری به اسپرم دیگر میپیوندد و خود را وقف تشکیل یک آندوسپرم غنی از مواد مغذی میکند. سلولهای دیگر نقشهای کمکی دارند. [توضیحات مورد نیاز] این فرآیند "لقاح مضاعف" یکتا و مشترک برای همه نهاندانگان است.

در پیشینه فسیلی، سه گروه جالب وجود دارد که ساختارهای گل مانندی دارند. نخستین مورد، گلوسوپتریس پتریدوسپرم پرمین است که پیشاً دارای برگهای برگشتی شبیه برچه بود. کایتونیا مزوزوئیک بیشتر شبیه گل است، با تخمکهای محصور - اما تنها یک لایه. بهجز این، جزئیات گرده و پرچم آنها آنها را از گیاهان گلدار واقعی متمایز میکند.
Bennettitales دارای اندامهای گلمانند چشمگیری بود که توسط حلقههای براکت محافظت میشد که احتمالاً نقشی مشابه گلبرگها و کاسبرگهای گلهای واقعی داشتهاند. با این حال، این ساختارهای گل مانند به طور مستقل فرگشت یافتهاند، زیرا بنتیتالها بیشتر به سیکادها و جینکوها مرتبط هستند تا نهاندانگان.[۱۲۸]
با این حال، هیچ گل واقعی در هیچ گروهی به جز گلهای موجود امروزی یافت نمیشود. بیشتر آنالیزهای ریختشناختی و مولکولی Amborella، nymphaeales و Austrobaileyaceae را در یک کلاد پایه به نام "ANA" قرار میدهند. به نظر میرسد که این کلاد در آغاز کرتاسه، حدود ۱۳۰ میلیون سال پیش - تقریباً همزمان با نخستین نهاندانگان فسیلی،[۱۲۹][۱۳۰] و درست پس از نخستین گرده نهاندانگان مانند، ۱۳۶ میلیون سال پیش، از هم جدا شده است. ماگنولیدها به زودی پس از آن از هم جدا شدند و یک تشعشع سریع ۱۲۵ میلیون سال پیش باعث ایجاد eudicots و monocots شد. تا پایان کرتاسه ۶۶ میلیون سال پیش، بیش از ۵۰ درصد از راستههای نهاندانگان امروزی فرگشت یافته بود و کلاد ۷۰ درصد از گونههای جهانی را تشکیل میداد. در همین زمان بود که درختان گلدار بر درختان مخروطی غالب شدند.: ۴۹۸
ویژگیهای گروههای پایه «ANA» نشان میدهد که نهاندانگان در مناطق تاریک، مرطوب و اغلب آشفته سرچشمه میگیرند. به نظر میرسد که نهاندانگان در سرتاسر کرتاسه به چنین زیستگاههایی محدود میماندند - در آغاز سریهای متوالی، تولهای از گیاهان کوچک را اشغال میکردند. این ممکن است اهمیت اولیه آنها را محدود کرده باشد، اما به آنها انعطاف پذیری میدهد که باعث سرعت تنوع پسین آنها در دیگر زیستگاهها میشود.
برخی باور دارند که نهاندانگان از یک سرخس بذر ناشناخته، پتریدوفیت، به وجود آمدهاند و سیکادها را بهعنوان سرخسهای دانهای زنده با برگهای دانهدار و عقیم میدانند (Cycas revoluta).
در آگوست ۲۰۱۷، دانشمندان شرح مفصل و بازسازی سه پسین احتمالاً نخستین گلی را که حدود ۱۴۰ میلیون سال پیش میزیسته ارائه کردند.
منشأ گل[ویرایش]
خانواده Amborellaceae بهعنوان خواهر و برادر دیگر گیاهان گلدار زنده در نظر گرفته میشود. پیش نویس ژنوم Amborella trichopoda در دسامبر ۲۰۱۳ منتشر شد. با مقایسه ژنوم آن با دیگر گیاهان گلدار زنده، میتوان محتملترین ویژگیهای جد A. trichopoda و دیگر گیاهان گلدار را بررسی کرد. یعنی گیاه گلدار اجدادی
به نظر میرسد که در سطح اندام، برگ ممکن است جد گل یا حداقل برخی از اندامهای گل باشد. هنگامی که برخی از ژنهای مهم درگیر در رشد گل جهش مییابند، خوشههایی از ساختارهای برگ مانند به جای گلها بهوجود میآیند. بنابراین، هنگامی در تاریخ، برنامه رشدی که منجر به تشکیل یک برگ میشود باید برای تولید گل تغییر کرده باشد. احتمالاً یک چارچوب کلی قوی نیز وجود دارد که در آن تنوع گل ایجاد شده است. نمونهای از آن ژنی به نام LEAFY (LFY) است که در رشد گل در Arabidopsis thaliana نقش دارد. همولوگهای این ژن در نهاندانگان به گونهای متنوع مانند گوجه فرنگی، اسنپدراگون، نخود، ذرت و حتی بازدانگان یافت میشود. بیان Arabidopsis thaliana LFY در گیاهان دوردست مانند صنوبر و مرکبات نیز منجر به تولید گل در این گیاهان میشود. ژن LFY بیان برخی از ژنهای متعلق به خانواده MADS-box را تنظیم میکند. این ژنها به نوبه خود بهعنوان کنترل کننده مستقیم رشد گل عمل میکنند.
فرگشت خانواده MADS-box[ویرایش]
اعضای خانواده فاکتورهای رونویسی MADS-box نقش بسیار مهمی را در رشد گل ایفا میکنند. بر اساس مدل ABC توسعه گل، سه ناحیه A، B و C در پریموردیوم گل در حال رشد، با عملکرد برخی از عوامل رونویسی، که اعضای خانواده MADS-box هستند، ایجاد میشوند. در این میان، عملکرد ژنهای دامنه B و C از نظر فرگشتی بیشتر از ژن دامنه A حفظ شده است. بسیاری از این ژنها از طریق تکرار ژنی اعضای اجدادی این خانواده به وجود آمدهاند. شمار کمی از آنها عملکردهای اضافی را نشان میدهند.
فرگشت خانواده MADS-box به طور گسترده مورد مطالعه قرار گرفته است. این ژنها حتی در پتریدوفیتها نیز وجود دارند، اما گسترش و تنوع در نهاندانگان چندین برابر بیشتر است. به نظر میرسد که الگوی کمی در مورد چگونگی فرگشت این خانواده وجود دارد. فرگشت ژن منطقه C AGAMOUS (AG) را در نظر بگیرید. در گلهای امروزی در برچهها و برچهای که اندامهای زایشی هستند بیان میشود. جد آن در بازدانگان نیز همین الگوی بیان را دارد. در اینجا، در استروبیلی، اندامی که گرده یا تخمک تولید میکند، بیان میشود. به طور مشابه، اجداد ژنهای B (AP۳ و PI) تنها در اندامهای نر در بازدانگان بیان میشوند. نوادگان آنها در نهاندانگانی نوین نیز تنها در برچهها، اندام تناسلی نر بیان میشوند. بنابراین، همان اجزای موجود در آن زمان توسط گیاهان به روشی جدید برای تولید نخستین گل استفاده شد. این یک الگوی تکرارشونده در فرگشت است.
عوامل مؤثر بر تنوع گل ها[ویرایش]
تنوع بسیاری در ساختار گل در گیاهان وجود دارد که معمولاً به دلیل تغییرات در ژنهای MADS-box و الگوی بیان آنها است. بهعنوان مثال، چمنها دارای ساختارهای گلی یکتایی هستند. برچهها و پرچمها توسط لودیکولهای فلسمانند و دو براکت به نامهای لم و رنگ پره احاطه شدهاند، اما شواهد ژنتیکی و مورفولوژی نشان میدهند که لیدیکولها همولوگ با گلبرگهای eudicot هستند. رنگ پریدگی و لما ممکن است همولوگ با کاسبرگهای گروههای دیگر باشند، یا ممکن است ساختارهای چمنی منحصربهفردی باشند. [نیازمند منبع]
نمونه دیگر Linaria vulgaris است که دارای دو گونه تقارن گل است - شعاعی و دو طرفه. این تقارنها به دلیل تغییرات اپی ژنتیکی تنها در یک ژن به نام CYCLOIDEA است.

رشادی گوشموشی ژنی به نام AGAMOUS دارد که نقش مهمی در تعیین شمار گلبرگها و کاسبرگها و دیگر اندامها دارد. جهش در این ژن باعث میشود که مریستم گل سرنوشت نامشخصی پیدا کند و اندامهای گل به شکلهای دو گل رز، میخک و شکوه صبحگاهی تکثیر شود. این فنوتیپها به دلیل افزایش شمار گلبرگها توسط باغبانان انتخاب شدهاند. چندین مطالعه بر روی گیاهان متنوعی مانند گل اطلسی، گوجه فرنگی، ایمپاتیانس، ذرت و غیره نشان دادهاند که تنوع بسیار گلها نتیجه تغییرات کوچکی در ژنهای کنترل کننده رشد آنهاست.
پروژه ژنوم گل تایید کرد که مدل ABC رشد گل در همه نهاندانگان حفظ نشده است. گاهی دامنههای بیان تغییر میکند، مانند بسیاری از تک لپهها، و همچنین در برخی از نهاندانگانی پایه مانند آمبورلا. مدلهای مختلف توسعه گل مانند مدل مرزهای محو، یا مدل مرزهای همپوشانی که حوزههای بیان غیر صلب را پیشنهاد میکنند، ممکن است این معماریها را توضیح دهند. این احتمال وجود دارد که از بازال تا نهاندانگانی نوین، حوزههای معماری گلها از طریق فرگشت بیشتر و بیشتر ثابت شده باشند.
زمان گلدهی[ویرایش]
یکی دیگر از ویژگیهای گل که موضوع انتخاب طبیعی بوده، زمان گلدهی است. برخی از گیاهان در آغاز چرخه زندگی خود گل میدهند، برخی دیگر پیش از گلدهی نیاز به یک دوره بهاره شدن دارند. این نتیجه بر اساس عواملی مانند دما، شدت نور، حضور گردهافشان و دیگر سیگنالهای محیطی است: ژنهایی مانند CONSTANS (CO)، مکان گل C (FLC) و FRIGIDA ادغام سیگنالهای محیطی را در مسیر رشد گل تنظیم میکنند. تغییرات در این مکانها با تغییرات زمان گلدهی میان گیاهان مرتبط است. بهعنوان مثال، اکوتیپهای رشادی گوشموشی که در مناطق سرد و معتدل رشد میکنند، پیش از گلدهی به بهاره شدن طولانیمدت نیاز دارند، در حالی که گونههای گرمسیری و رایجترین گونههای آزمایشگاهی این گونه نیستند. این تنوع به دلیل جهش در ژنهای FLC و FRIGIDA است که باعث غیرعملکردی شدن آنها میشود.
بسیاری از ژنهای دخیل در این فرآیند در همه گیاهان مورد مطالعه حفظ میشوند. گاهی، با وجود حفاظت ژنتیکی، سازوکار عمل متفاوت است. بهعنوان مثال، برنج یک گیاه روز کوتاه است، در حالی که Arabidopsis thaliana یک گیاه روز بلند است. هر دو گیاه دارای پروتئینهای CO و FLOWERING LOCUS T (FT) هستند، اما در رشادی گوشموشی، CO باعث افزایش تولید FT میشود، در حالی که در برنج، همولوگ CO تولید FT را سرکوب میکند و در نتیجه اثرات پایین دستی کاملاً متضاد ایجاد میکند.
نظریههای فرگشت گل[ویرایش]
نظریه آنتوفیت بر اساس این مشاهدات بود که یک گروه بازدانگانی Gnetales تخمک گل مانندی دارد. نهاندانگان تا حدی رگهایی را توسعه داده است و مگاسپورانژیوم مانند ساختار تخمدانی گلهای نهاندانگان توسط سه پوشش پوشیده شده است. با این حال، بسیاری از مدارک دیگر نشان میدهند که Gnetales به نهاندانگان مرتبط نیست.
نظریه بیشتر پایه ژنتیکی نر بیشتری دارد. طرفداران این نظریه اشاره میکنند که بازدانگان دو نسخه بسیار مشابه از ژن LFY دارند، در حالی که نهاندانگان تنها یک نسخه دارند. تجزیه و تحلیل ساعت مولکولی نشان داده است که پارالوگ LFY دیگر تقریباً همزمان با فراوان شدن فسیلهای گل در نهاندانگان گم شده است، که نشان میدهد این رویداد ممکن است به فرگشت گل منجر شده باشد. بر اساس این نظریه، از دست دادن یکی از پارالوگهای LFY منجر به گلهایی شد که بیشتر نر بودند و تخمکها به صورت نابجا بیان میشدند. این تخمکها در ابتدا کار جذب گرده افشانها را انجام میدادند، اما مدتی بعد ممکن است در هسته گل ادغام شده باشند.
سازوکارها و عوامل در فرگشت مورفولوژی گیاهی[ویرایش]

در حالی که عوامل محیطی به طور چشمگیری مسئول تغییرات فرگشتی هستند، آنها تنها بهعنوان عوامل انتخاب طبیعی عمل میکنند. تغییر ذاتاً از طریق پدیدههایی در سطح ژنتیکی ایجاد میشود: جهشها، بازآراییهای کروموزومی و تغییرات اپیژنتیکی. در حالی که گونههای کلی جهش در سراسر جهان زنده صادق است، در گیاهان، برخی سازوکارهای دیگر بهعنوان بسیار مهم دخیل هستند.
دو برابر شدن ژنوم یک اتفاق نسبتاً رایج در فرگشت گیاه است و منجر به پلیپلوئیدی میشود که در نتیجه یک ویژگی مشترک در گیاهان است. تخمین زده میشود که حداقل نیمی (و احتمالاً همه) گیاهان در تاریخ خود شاهد دو برابر شدن ژنوم بودهاند. دوبرابر شدن ژنوم مستلزم تکثیر ژن است، بنابراین در بیشتر ژنها افزونگی عملکردی ایجاد میشود. ژنهای تکراری ممکن است به عملکرد جدیدی دست یابند، چه با تغییر در الگوی بیان یا تغییر در فعالیت. اعتقاد بر این است که پلیپلوئیدی و تکثیر ژن یکی از قدرتمندترین نیروها در فرگشت شکل گیاهی هستند. اگرچه مشخص نیست که چرا دو برابر شدن ژنوم یک فرآیند مکرر در گیاهان است. یکی از دلایل احتمالی تولید مقادیر بسیاری متابولیتهای ثانویه در سلولهای گیاهی است. برخی از آنها ممکن است در روند طبیعی جداسازی کروموزومی دخالت کنند و باعث تکرار ژنوم شوند.

در زمانهای اخیر، گیاهان دارای خانوادههای microRNA چشمگیری هستند که در بسیاری از دودمانهای گیاهی حفظ شدهاند. در مقایسه با جانوران، در حالی که شمار خانوادههای miRNA گیاهی کمتر از جانوران است، اندازه هر خانواده بسیار بزرگتر است. ژنهای miRNA نیز در ژنوم بسیار بیشتر از ژنهای جانوران پخش میشوند، جایی که آنها خوشهتر هستند. پیشنهاد شده است که این خانوادههای miRNA با تکثیر نواحی کروموزومی گسترش یافتهاند. بسیاری از ژنهای miRNA که در تنظیم رشد گیاه نقش دارند، میان گیاهان مورد مطالعه کاملاً حفظ شدهاند.
اهلی شدن گیاهانی مانند ذرت، برنج، جو، گندم و غیره نیز نیروی محرکه مهمی در فرگشت آنها بوده است. پژوهشها در مورد منشاء ذرت نشان داده است که این یک مشتق اهلی شده از یک گیاه وحشی از مکزیک به نام تئوسینت است. Teosinte مانند ذرت متعلق به جنس Zea است، اما دارای گل آذین بسیار کوچک، ۵-۱۰ بلال سخت و ساقه بسیار منشعب و گسترده است.

تلاقی میان یک واریته خاص تئوزینت و ذرت، فرزندان بارور به دست میدهد که در فنوتیپ میان ذرت و تئوسینت متوسط هستند. تجزیه و تحلیل QTL همچنین برخی مکانها را نشان داده است که وقتی در ذرت جهش مییابند، ساقههای تئوزینتمانند یا بلالهایی شبیه تئوزینت به دست میآیند. تجزیه و تحلیل ساعت مولکولی این ژنها منشأ آنها را به حدود ۹۰۰۰ سال پیش تخمین میزند که به خوبی مطابق با دیگر سوابق اهلی سازی ذرت است. اعتقاد بر این است که گروه کوچکی از کشاورزان باید حدود ۹۰۰۰ سال پیش در مکزیک مقداری جهش یافته طبیعی تئوسینت مانند ذرت را انتخاب کرده باشند و آن را در معرض انتخاب پیوسته قرار دادهاند تا گیاه ذرت آشنای امروزی را تولید کنند.
گل کلم خوراکی یک نسخه اهلی شده از گیاه وحشی Brassica oleracea است که دارای گل آذین متراکم تمایز نیافته به نام کشک است که گل کلم دارد. گل کلم دارای یک جهش واحد در ژنی به نام CAL است که تمایز مریستم به گل آذین را کنترل میکند. این امر باعث میشود که سلولهای مریستم گل هویت تمایز نیافتهای پیدا کنند و به جای رشد به گل، به تودهای متراکم از سلولهای مریستم گل آذین تبدیل شوند. این جهش حداقل از زمان امپراتوری یونان از طریق اهلی سازی انتخاب شده است.
فرگشت مسیرهای فتوسنتزی[ویرایش]

مسیر متابولیک C۴ یک نوآوری با ارزش اخیر فرگشتی در گیاهان است که شامل مجموعه پیچیدهای از تغییرات تطبیقی در فیزیولوژی و الگوهای بیان ژن است.
فتوسنتز یک مسیر شیمیایی پیچیده است که توسط دامنه گستردهای از آنزیمها و کوآنزیمها تسهیل میشود. آنزیم RuBisCO مسئول «تثبیت» CO۲ است – یعنی آن را به یک مولکول مبتنی بر کربن میچسباند تا قند تشکیل دهد که میتواند توسط گیاه استفاده شود و مولکول اکسیژن آزاد میشود. با این حال، این آنزیم بسیار ناکارآمد است، و با افزایش دمای محیط، به طور فزایندهای اکسیژن را به جای CO۲ در فرآیندی به نام تنفس نوری تثبیت میکند. این از نظر انرژی پرهزینه است زیرا گیاه باید از انرژی استفاده کند تا محصولات حاصل از تنفس نوری را به شکلی تبدیل کند که بتواند با CO۲ واکنش نشان دهد.
کربن غلیظ[ویرایش]
گیاهان C۴ سازوکارهای تمرکز کربن را فرگشت دادند که با افزایش غلظت CO۲ در اطراف RuBisCO و حذف اکسیژن کار میکنند و در نتیجه کارایی فتوسنتز را با کاهش تنفس نوری افزایش میدهند. فرآیند تمرکز CO۲ در اطراف RuBisCO به انرژی بیشتری نسبت به انتشار گازها نیاز دارد، اما تحت شرایط خاص - مانند دمای گرم (بیش از ۲۵ درجه سانتیگراد)، غلظت کم CO۲ یا غلظت بالای اکسیژن - از نظر کاهش از دست دادن قندها پاسخ میدهد. از طریق تنفس نوری
یکی از گونههای متابولیسم C۴ از آناتومی کرانز استفاده میکند. این CO۲ را از طریق یک لایه مزوفیل بیرونی، از طریق دامنه گستردهای از مولکولهای آلی، به سلولهای غلاف بسته مرکزی، جایی که CO۲ آزاد میشود، منتقل میکند. به این ترتیب، CO۲ در نزدیکی محل عملیات RuBisCO متمرکز میشود. از آنجایی که RuBisCO در محیطی با CO۲ بسیار بیشتر از آنچه در غیر این صورت بود کار میکند، کارایی بیشتری دارد.
سازوکار دوم، فتوسنتز CAM، فتوسنتز را به طور موقت از عمل RuBisCO جدا میکند. RuBisCO تنها در طول روز عمل میکند، هنگامی که روزنهها مهر و موم شدهاند و CO۲ از تجزیه مالات شیمیایی تامین میشود. سپس هنگام باز شدن روزنهها، در طول شبهای خنک و مرطوب، CO۲ بیشتری از اتمسفر برداشت میشود و از دست دادن آب کاهش مییابد.
مدرک فرگشتی[ویرایش]
این دو مسیر، با تأثیر یکسان روی RuBisCO، چندین بار به طور مستقل فرگشت یافتند - در واقع، C۴ به تنهایی ۶۲ بار در ۱۸ خانواده گیاهی مختلف ایجاد شد. به نظر میرسد شماری از «پیش انطباق ها» راه را برای C۴ هموار کرده است که منجر به خوشه بندی آن در کلاسههای خاص شده است: اغلب در گیاهانی ابداع شده است که پیشاً دارای ویژگیهایی مانند بافت غلاف بسته آوندی گسترده بودند. بسیاری از مسیرهای فرگشتی بالقوه منجر به فنوتیپ C۴ ممکن است و با استفاده از استنتاج بیزی مشخص شدهاند، که تأیید میکند که سازگاریهای غیرفتوسنتزی اغلب پلههای فرگشتی را برای فرگشت بیشتر C۴ فراهم میکنند.
ساختار C۴ توسط زیر مجموعهای از علفها استفاده میشود، در حالی که CAM توسط بسیاری از ساکولنتها و کاکتوسها استفاده میشود. به نظر میرسد صفت C۴ در الیگوسن، حدود ۲۵ تا ۳۲ میلیون سال پیش ظاهر شده است. با این حال، تا پیش از میوسن، ۶ تا ۷ میلیون سال پیش، از نظر بومشناختی مهم نبودند. به طور چشمگیری، برخی از فسیلهای زغالشده، بافت سازمانیافته در آناتومی کرانز را با سلولهای غلاف دستنخورده حفظ میکنند که امکان شناسایی متابولیسم C۴ را فراهم میکند. نشانگرهای ایزوتوپی برای استنباط توزیع و اهمیت آنها استفاده میشود. گیاهان C۳ ترجیحاً از فندکتر از دو ایزوتوپ کربن موجود در جو، ۱۲C استفاده میکنند که با آسانی بیشتری در مسیرهای شیمیایی دخیل در تثبیت آن دخالت دارد. از آنجایی که متابولیسم C۴ شامل یک مرحله شیمیایی بیشتر است، این اثر تشدید میشود. مواد گیاهی را میتوان برای استنباط نسبت ۱۳ درجه سانتیگراد سنگین تر به ۱۲ درجه سانتیگراد تجزیه و تحلیل کرد. این نسبت δ۱۳C نشان داده شده است. گیاهان C۳ به طور متوسط حدود ۱۴ ‰ (قسمت در هزار) سبک تر از نسبت اتمسفر هستند، در حالی که گیاهان C۴ حدود ۲۸‰ سبک تر هستند. δ۱۳C گیاهان CAM به درصد کربن ثابت در شب نسبت به آنچه در روز ثابت است بستگی دارد، اگر بیشتر کربن را در روز ثابت کنند به گیاهان C۳ نزدیکتر است و اگر همه کربن خود را در شب ثابت کنند به گیاهان C۴ نزدیکتر است.
مواد فسیلی اصلی به مقدار کافی برای تجزیه و تحلیل خود چمن کمیاب است، اما اسبها نماینده خوبی هستند. آنها در دوره مورد علاقه در سطح جهانی گسترده بودند و تقریباً به طور انحصاری روی چمنها مرور میکردند. یک عبارت قدیمی در دیرینه شناسی ایزوتوپی وجود دارد، "شما همان چیزی هستید که میخورید (به علاوه کمی)" - این به این واقعیت اشاره دارد که جانداران ترکیب ایزوتوپی هر چیزی را که میخورند، به علاوه یک ضریب تنظیم کوچک منعکس میکند. سابقه خوبی از دندانهای اسب در سرتاسر جهان وجود دارد، و رکورد δ۱۳C آنها نشاندهنده انحراف منفی شدید در حدود ۶ تا ۷ میلیون سال پیش، در دوره مسینی است که بهعنوان نتیجه ظهور گیاهان C۴ در مقیاس جهانی تفسیر میشود.
مزیت C۴[ویرایش]
در حالی که C۴ کارایی RuBisCO را افزایش میدهد، غلظت کربن بسیار انرژی بر است. این بدان معنی است که گیاهان C۴ تنها در شرایط خاصی نسبت به جانداران C۳ برتری دارند: یعنی دمای بالا و بارندگی کم. گیاهان C۴ همچنین برای رشد به نور خورشید نیاز دارند. مدلها نشان میدهند که بدون آتشسوزی که درختان و درختچههای سایهانداز را از میان میبرد، فضایی برای گیاهان C۴ وجود نخواهد داشت. اما، آتشسوزیهای جنگلی برای ۴۰۰ میلیون سال رخ دادهاند - چرا C۴ اینقدر طول کشید تا بهوجود آمد، و سپس بارها بهطور مستقل ظاهر شد؟ کربونیفر (حدود ۳۰۰ میلیون سال پیش) سطح اکسیژن بسیار بالایی داشت - تقریباً به اندازه کافی برای احتراق خود به خود - و CO۲ بسیار پایین، اما هیچ علامت ایزوتوپی C۴ وجود ندارد. و به نظر نمیرسد که یک محرک ناگهانی برای ظهور میوسن وجود داشته باشد.
در طول میوسن، جو و آبوهوا نسبتاً پایدار بود. در غیر این صورت، CO۲ از ۱۴ تا ۹ میلیون سال پیش به تدریج افزایش یافت و پیش از اینکه به غلظتهایی مشابه هولوسن برسد. این نشان میدهد که نقش کلیدی در فراخوانی فرگشت C۴ نداشته است. خود علفها (گروهی که باعث بروز بیشتر C۴ میشود) احتمالاً برای ۶۰ میلیون سال یا بیشتر وجود داشتهاند، بنابراین زمان بسیاری برای فرگشت C۴ داشتهاند، که در هر صورت، در محدودههای متنوعی وجود دارد. گروهها و بنابراین به طور مستقل فرگشت یافتند. یک سیگنال قوی از تغییر آبوهوا در جنوب آسیا وجود دارد. افزایش خشکی - در نتیجه افزایش فرکانس و شدت آتش - ممکن است به افزایش اهمیت علفزارها منجر شده باشد. با این حال، تطبیق این موضوع با سابقه آمریکای شمالی دشوار است. این امکان وجود دارد که سیگنال کاملاً زیستی باشد و به دلیل شتاب ناشی از آتش (و فیل؟) فرگشت چمن - که هم با افزایش هوازدگی و هم ترکیب کربن بیشتر در رسوبات، سطح CO۲ اتمسفر را کاهش میدهد، ممکن است. در نهایت، شواهدی وجود دارد که نشان میدهد آغاز C۴ از ۹ تا ۷ میلیون سال پیش یک سیگنال مغرضانه است که تنها برای آمریکای شمالی، جایی که بیشتر نمونهها از آنجا سرچشمه میگیرند، صادق است. شواهد در حال ظهور نشان میدهد که علفزارها حداقل ۱۵ میلیون متر پیش از آن در آمریکای جنوبی به یک حالت غالب تبدیل شدهاند.
فرگشت قواعد رونویسی[ویرایش]
عوامل رونویسی و شبکههای تنظیمی رونویسی نقش کلیدی در رشد گیاه و پاسخهای تنش و همچنین فرگشت آنها دارند. در طول فرود گیاه، بسیاری از خانوادههای فاکتورهای رونویسی جدید پدید آمدند و ترجیحاً به شبکههای توسعه چند سلولی، تولیدمثل و توسعه اندام متصل میشوند و به شکلگیری پیچیدهتر گیاهان زمینی کمک میکنند.[۱۳۱]
فرگشت متابولیسم ثانویه[ویرایش]
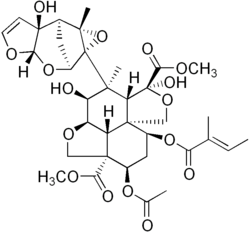
متابولیتهای ثانویه اساساً ترکیباتی با وزن مولکولی کم هستند که گاهی دارای ساختارهای پیچیدهای هستند که برای فرآیندهای طبیعی رشد، نمو یا تولیدمثل ضروری نیستند. آنها در فرآیندهای متنوعی مانند ایمنی، ضد گیاهخواری، جذب گرده افشان، ارتباط میان گیاهان، حفظ ارتباط همزیستی با فلور خاک، یا افزایش سرعت لقاح عمل میکنند و از این رو از دیدگاه evo-devo قابل توجه هستند. متابولیتهای ثانویه از نظر ساختاری و عملکردی متنوع هستند و تخمین زده میشود که صدها هزار آنزیم ممکن است در فرآیند تولید آنها دخیل باشند، با حدود ۱۵ تا ۲۵ درصد از ژنوم کد کننده این آنزیمها، و هر گونه دارای زرادخانه یکتای خود است.[۱۳۲] متابولیتهای ثانویه بسیاری از این متابولیتها، مانند اسید سالیسیلیک، برای انسان اهمیت پزشکی دارند.
هدف از تولید این همه متابولیت ثانویه، با بخش چشمگیری از متابولوم اختصاص داده شده به این فعالیت، نامشخص است. فرض بر این است که بیشتر این مواد شیمیایی به ایجاد ایمنی کمک میکنند و در نتیجه، تنوع این متابولیتها نتیجه یک مسابقه تسلیحاتی ثابت میان گیاهان و انگلهای آنها است. برخی شواهد این مورد را تایید میکند. یک سؤال اصلی شامل هزینه تولیدمثل برای نگهداری چنین موجودی بزرگی از ژنهای اختصاص داده شده به تولید متابولیتهای ثانویه است. مدلهای مختلفی پیشنهاد شدهاند که این جنبه از سؤال را بررسی میکنند، اما اجماع در مورد میزان هزینه هنوز ایجاد نشده است.[۱۳۳] زیرا هنوز پیشبینی اینکه آیا گیاهی با متابولیتهای ثانویه بیشتر بقا یا موفقیت تولیدمثلی خود را در مقایسه با دیگر گیاهان کناری آن افزایش میدهد، دشوار است.
به نظر میرسد تولید متابولیت ثانویه بسیار زود در طول فرگشت بهوجود آمده است. در گیاهان، به نظر میرسد که آنها با استفاده از سازوکارهایی از جمله تکرار ژن یا فرگشت ژنهای جدید گسترش یافتهاند. بهجز این، پژوهشها نشان داده است که تنوع در برخی از این ترکیبات ممکن است به طور مثبت انتخاب شود. اگرچه نقش فرگشت ژن جدید در فرگشت متابولیسم ثانویه روشن است، اما چندین نمونه وجود دارد که متابولیتهای جدید با تغییرات کوچک در واکنش تشکیل شدهاند. بهعنوان مثال، گلیکوزیدهای سیانوژن پیشنهاد شده است که چندین بار در دودمانهای مختلف گیاهی فرگشت یافتهاند. چندین مورد مانند این از فرگشت همگرا وجود دارد. بهعنوان مثال، آنزیمهای سنتز لیمونن - یک ترپن - میان نهاندانگان و بازدانگان بیشتر از آنزیمهای سنتز ترپن خودشان است. این نشان دهنده فرگشت مستقل مسیر بیوسنتزی لیمونن در این دو اصل است.[۱۳۴]
فرگشت فعل و انفعالات گیاه و میکروب[ویرایش]

منشاء میکروبها روی زمین، که به آغاز زندگی بیش از ۳.۵ میلیارد سال پیش بازمیگردد، نشان میدهد که تعاملات میکروب-میکروب به طور پیوسته در طول زمان فرگشت یافته و متنوع شده است، مدتها پیش از اینکه گیاهان در ۴۵۰ میلیون سال پیش آغاز به استعمار زمین کنند. بنابراین، این احتمال وجود دارد که هم فعل و انفعالات میان میکروبی درون و میان پادشاهی، محرکهای قوی ایجاد کنسرسیومهای میکروبی مرتبط با گیاه در سطح مشترک خاک و ریشه باشد. با این وجود، هنوز مشخص نیست که تا چه حد این فعل و انفعالات در ریزوسفر/فیلوسفر و در محفظههای گیاه اندوفیت (بهعنوان مثال، درون میزبان) مجموعههای میکروبی را در طبیعت شکل میدهند و آیا سازگاری میکروبی با زیستگاههای گیاهی، استراتژیهای تعامل میکروب-میکروبی خاص زیستگاه را هدایت میکند. تناسب اندام گیاه بهجز این، ارزیابی سهم تعاملات رقابتی و مشارکتی میکروب- میکروب در ساختار کلی جامعه به دلیل سر و صدای شدید محیطی در طبیعت دشوار است.[۱۳۸]
همفرگشتی گیاهان و پارازیتهای قارچی[ویرایش]
یک عامل کمک کننده اضافی در برخی گیاهان که منجر به تغییرات فرگشتی میشود، نیروی ناشی از فرگشت همزمان با انگلهای قارچی است. در محیطی با یک انگل قارچی که در طبیعت رایج است، گیاهان باید برای اجتناب از اثرات مضر انگل سازگاری داشته باشند.[۱۳۹]
هر زمان که یک قارچ انگلی منابع محدودی را از گیاه دور میکند، فشار انتخابی برای فنوتیپی وجود دارد که بهتر میتواند از حمله انگلی قارچها جلوگیری کند. در عین حال، قارچهایی که برای فرار از دفاع گیاه مجهزتر هستند، سطح آمادگی بیشتری خواهند داشت. ترکیب این دو عامل منجر به یک چرخه بی پایان از تغییرات فرگشتی در سامانه میزبان - پاتوژن میشود.[۱۴۰]
از آنجایی که هر گونه در رابطه تحت تأثیر یک همزیستی پیوسته در حال تغییر است، تغییرات فرگشتی معمولاً با سرعت بیشتری نسبت به هنگامی که گونههای دیگر حضور نداشتند رخ میدهد. این در بیشتر موارد فرگشت همزمان صادق است. این باعث میشود که توانایی یک جمعیت برای فرگشت سریع برای بقای آن حیاتی باشد. همچنین، اگر گونه بیماریزا بیش از حد موفق باشد و بقا و موفقیت تولیدمثلی گیاهان میزبان را تهدید کند، قارچهای بیماریزا در خطر از دست دادن منبع غذایی خود برای نسلهای آینده هستند. این عوامل پویایی ایجاد میکنند که تغییرات فرگشتی را در هر دو گونه نسل به نسل شکل میدهد.[۱۴۱]
ژنهایی که سازوکارهای دفاعی گیاهان را کد میکنند، باید مدام تغییر کنند تا با انگلی که پیوسته برای فرار از دفاع کار میکند، هماهنگی داشته باشند. ژنهایی که سازوکارهای اتصال را کد میکنند، پویاترین هستند و مستقیماً با توانایی فرار قارچها مرتبط هستند.[۱۴۲] هر چه تغییرات در این ژنها بیشتر باشد، تغییر در سازوکار دلبستگی بیشتر میشود. پس از نیروهای انتخابی بر فنوتیپهای حاصل، تغییرات فرگشتی که فرار از دفاع میزبان را ترویج میکند رخ میدهد.
قارچها نه تنها برای جلوگیری از دفاع گیاهان فرگشت مییابند، بلکه سعی میکنند از ایجاد سازوکارهایی برای بهبود سامانه دفاعی گیاه جلوگیری کنند. هر کاری که قارچها میتوانند برای کند کردن روند فرگشت گیاهان میزبان انجام دهند، تناسب اندام نسلهای آینده را بهبود میبخشد زیرا این گیاه نمیتواند با تغییرات فرگشتی انگل هماهنگ شود. یکی از فرآیندهای اصلی که توسط آن گیاهان به سرعت در پاسخ به محیط فرگشت مییابند، تولیدمثل جنسی است. بدون تولیدمثل جنسی، صفات سودمند را نمیتوان به سرعت در میان جمعیت گیاه پخش کرد و به قارچها اجازه داد مزیت رقابتی به دست آورند. به همین دلیل اندامهای تناسلی جنسی گیاهان هدف حمله قارچها هستند. مطالعات نشان دادهاند که بسیاری از گونههای مختلف قارچهای گیاهی انگلی اجباری سازوکارهایی را ایجاد کردهاند که تولیدمثل جنسی گیاهان را از کار میاندازند یا به شکل دیگری تحت تاثیر قرار میدهند. اگر موفقیت آمیز باشد، روند تولیدمثل جنسی برای گیاه کند میشود، بنابراین تغییرات فرگشتی را کند میکند یا در موارد شدید، قارچها میتوانند گیاه را عقیم کنند و مزیتی برای عوامل بیماری زا ایجاد کنند. دقیقاً مشخص نیست که این ویژگی تطبیقی چگونه در قارچها ایجاد شده است، اما واضح است که رابطه با گیاه باعث توسعه این فرآیند شده است.[۱۴۳]
برخی از پژوهشگران همچنین در حال مطالعه چگونگی تأثیر دامنهای از عوامل بر سرعت تغییرات فرگشتی و پیامدهای تغییر در محیطهای مختلف هستند. برای مثال، مانند بسیاری از فرگشتها، افزایش وراثتپذیری در یک جمعیت امکان واکنش فرگشتی بیشتری را در حضور فشار انتخابی فراهم میکند. برای ویژگیهای خاص فرگشت همزمان گیاه و قارچ، پژوهشگران چگونگی تأثیر بیماریزای مهاجم را بر فرگشت همزمان مطالعه کردهاند. مطالعات مربوط به Mycosphaerella graminicola به طور پیوسته نشان دادهاند که حدت یک پاتوژن تأثیر چشمگیری بر مسیر فرگشتی گیاه میزبان ندارد.[۱۴۴]
عوامل دیگری نیز میتواند بر روند فرگشت همزمان تأثیر بگذارد. بهعنوان مثال، در جمعیتهای کوچک، انتخاب نیروی نسبتا ضعیف تری بر جمعیت به دلیل رانش ژنتیکی است. رانش ژنتیکی احتمال داشتن آللهای ثابت را افزایش میدهد که باعث کاهش واریانس ژنتیکی در جمعیت میشود. بنابراین، اگر تنها جمعیت کمی از گیاهان در یک منطقه با توانایی تولیدمثل با هم وجود داشته باشد، رانش ژنتیکی ممکن است اثرات انتخاب را خنثی کند و گیاه را در موقعیت نامطلوبی برای قارچهایی قرار دهد که میتوانند با سرعت طبیعی فرگشت یابند. واریانس در جمعیت میزبان و پاتوژن عامل اصلی موفقیت فرگشتی در مقایسه با گونههای دیگر است. هرچه واریانس ژنتیکی بیشتر باشد، گونهها میتوانند سریعتر فرگشت یابند تا با سازوکارهای دفاعی یا اجتنابی جانداران دیگر مقابله کنند.[۱۳۹]
با توجه به فرآیند گرده افشانی برای گیاهان، اندازه جمعیت مؤثر معمولاً بزرگتر از قارچها است، زیرا گرده افشانها میتوانند جمعیتهای جدا شده را به گونهای پیوند دهند که قارچ قادر به ایجاد آن نباشد. این به این معنی است که صفات مثبتی که در مناطق غیر کناری اما نزدیک فرگشت مییابند، میتوانند به مناطق کناری منتقل شوند. قارچها باید به صورت جداگانه فرگشت یابند تا از دفاع میزبان در هر ناحیه فرار کنند. این بدیهی است که یک مزیت رقابتی واضح برای گیاهان میزبان است. تولیدمثل جنسی با جمعیت واریانس وسیع و بالا منجر به تغییرات سریع فرگشتی و موفقیت باروری بالاتر فرزندان میشود.[۱۴۵]
الگوهای محیطی و آبوهوایی نیز در نتایج فرگشتی نقش دارند. مطالعات روی درختان بلوط و یک انگل قارچی اجباری در ارتفاعات مختلف به روشنی این تمایز را نشان میدهد. برای گونههای مشابه، موقعیتهای ارتفاعی مختلف نرخهای فرگشت و تغییرات در واکنش به پاتوژنها به دلیل جاندار و همچنین در یک محیط انتخابی با توجه به محیط اطرافشان به شدت متفاوت بود.[۱۴۶]
فرگشت همزمان فرآیندی است که به فرضیه ملکه قرمز مربوط میشود. هم گیاه میزبان و هم قارچهای انگلی باید به بقای خود ادامه دهند تا در جایگاه بومشناختی خود باقی بمانند. اگر یکی از دو گونه در رابطه با سرعت چشمگیری سریعتر از دیگری فرگشت یابد، گونه کندتر در یک نقطه ضعف رقابتی قرار خواهد گرفت و خطر از دست دادن مواد مغذی را به همراه خواهد داشت. از آنجایی که دو گونه در این سامانه بسیار به هم مرتبط هستند، آنها با هم به عوامل محیطی بیرونی پاسخ میدهند و هر گونه بر نتیجه فرگشتی دیگری تأثیر میگذارد. به عبارت دیگر، هر گونه فشار انتخابی بر دیگری وارد میکند. اندازه جمعیت نیز یک عامل اصلی در نتیجه است زیرا تفاوت در جریان ژن و رانش ژنتیکی میتواند باعث تغییرات فرگشتی شود که با جهت انتخاب مورد انتظار نیروهای ناشی از جاندار دیگر مطابقت ندارد. فرگشت همزمان یک پدیده مهم است که برای درک رابطه حیاتی میان گیاهان و انگلهای قارچی آنها ضروری است.
منابع[ویرایش]
- ↑ Stewart, W.N.; Rothwell, G.W. (1993). Paleobotany and the evolution of plants (2 ed.). Cambridge University Press. ISBN 978-0-521-23315-6.
- ↑ T. Cavalier Smith 2007, Evolution and relationships of algae major branches of the tree of life. from: Unravelling the algae, by Brodie & Lewis. CRC Press
- ↑ Ševčíková, Tereza; Horák, Aleš; Klimeš, Vladimír; Zbránková, Veronika; Demir-Hilton, Elif; Sudek, Sebastian; Jenkins, Jerry; Schmutz, Jeremy; Přibyl, Pavel (2015). "Updating algal evolutionary relationships through plastid genome sequencing". Scientific Reports. 5: 10134. Bibcode:2015NatSR...510134S. doi:10.1038/srep10134. PMC 4603697. PMID 26017773.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Theodor Cole & Hartmut Hilger 2013 Bryophyte Phylogeny بایگانیشده در ۲۰۱۵-۱۱-۲۳ توسط Wayback Machine
- ↑ Theodor Cole & Hartmut Hilger 2013 Trachaeophyte Phylogeny بایگانیشده در ۲۰۱۶-۰۳-۰۴ توسط Wayback Machine
- ↑ ۶٫۰۰ ۶٫۰۱ ۶٫۰۲ ۶٫۰۳ ۶٫۰۴ ۶٫۰۵ ۶٫۰۶ ۶٫۰۷ ۶٫۰۸ ۶٫۰۹ ۶٫۱۰ ۶٫۱۱ Theodor Cole & Hartmut Hilger 2015 Angiosperm Phylogeny, Flowering Plant Systematics. بایگانیشده در ۱۷ مه ۲۰۱۷ توسط Wayback Machine Freie Universität Berlin
- ↑ ۷٫۰ ۷٫۱ Strother, Paul K.; Battison, Leila; Brasier, Martin D.; Wellman, Charles H. (2011). "Earth's earliest non-marine eukaryotes". Nature. 473 (7348): 505–509. Bibcode:2011Natur.473..505S. doi:10.1038/nature09943. PMID 21490597.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ Knauth, L. Paul; Kennedy, Martin J. (2009). "The late Precambrian greening of the Earth". Nature. 460 (7256): 728–732. Bibcode:2009Natur.460..728K. doi:10.1038/nature08213. PMID 19587681.
- ↑ Rothwell, G. W.; Scheckler, S. E.; Gillespie, W. H. (1989). "Elkinsia gen. nov., a Late Devonian gymnosperm with cupulate ovules". Botanical Gazette. 150 (2): 170–189. doi:10.1086/337763.
- ↑ ۱۰٫۰ ۱۰٫۱ P. Kenrick, P.R. Crane (1997) (1997). The origin and early diversification of land plants. A cladistic study. Smithsonian Institution Press, Washington & London. Washington: Smithsonian Inst. Press. ISBN 978-1-56098-729-1.
- ↑ ۱۱٫۰۰ ۱۱٫۰۱ ۱۱٫۰۲ ۱۱٫۰۳ ۱۱٫۰۴ ۱۱٫۰۵ ۱۱٫۰۶ ۱۱٫۰۷ ۱۱٫۰۸ ۱۱٫۰۹ ۱۱٫۱۰ ۱۱٫۱۱ ۱۱٫۱۲ ۱۱٫۱۳ Raven, J.A.; Edwards, D. (2001). "Roots: evolutionary origins and biogeochemical significance". Journal of Experimental Botany. 52 (90001): 381–401. doi:10.1093/jexbot/52.suppl_1.381. PMID 11326045.
- ↑ Del-Bem, L. E. (2018). "Xyloglucan evolution and the terrestrialization of green plants". New Phytologist. 219 (4): 1150–1153. doi:10.1111/nph.15191. PMID 29851097.
- ↑ Heckman, D. S.; Geiser, D. M.; Eidell, B. R.; Stauffer, R. L.; Kardos, N. L.; Hedges, S. B. (Aug 2001). "Molecular evidence for the early colonization of land by fungi and plants". Science. 293 (5532): 1129–1133. doi:10.1126/science.1061457. ISSN 0036-8075. PMID 11498589.
- ↑ الگو:Walcott 2009
- ↑ Battistuzzi, F. U.; Feijao, A.; Hedges, S. B. (2004). "A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land". BMC Evolutionary Biology. 4: 44. doi:10.1186/1471-2148-4-44. PMC 533871. PMID 15535883.
- ↑ Strother, P.K.; Al-Hajri, S.; Traverse, A. (1996). "New evidence for land plants from the lower Middle Ordovician of Saudi Arabia". Geology. 24 (1): 55–59. Bibcode:1996Geo....24...55S. doi:10.1130/0091-7613(1996)024<0055:NEFLPF>2.3.CO;2.
- ↑ Rubinstein, C. V.; Gerrienne, P.; de la Puente, G. S.; Astini, R. A.; Steemans, P. (2010). "Early Middle Ordovician evidence for land plants in Argentina (eastern Gondwana)". New Phytologist. 188 (2): 365–369. doi:10.1111/j.1469-8137.2010.03433.x. PMID 20731783.
- ↑ Wellman, Charles H.; Osterloff, Peter L.; Mohiuddin, Uzma (2003). "Fragments of the earliest land plants" (PDF). Nature. 425 (6955): 282–285. Bibcode:2003Natur.425..282W. doi:10.1038/nature01884. PMID 13679913.
- ↑ Steemans, P.; Lepota K.; Marshallb, C.P.; Le Hérisséc, A.; Javauxa, E.J. (2010). "FTIR characterisation of the chemical composition of Silurian miospores (cryptospores and trilete spores) from Gotland, Sweden". Review of Palaeobotany and Palynology. 162 (4): 577–590. doi:10.1016/j.revpalbo.2010.07.006.
- ↑ Kump, L. R.; Pavlov, A.; Arthur, M. A. (2005). "Massive release of hydrogen sulfide to the surface ocean and atmosphere during intervals of oceanic anoxia". Geology. 33 (5): 397. Bibcode:2005Geo....33..397K. doi:10.1130/G21295.1.
- ↑ Butterfield, N. J. (2009). "Oxygen, animals and oceanic ventilation: An alternative view". Geobiology. 7 (1): 1–7. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141.
- ↑ Steemans, P.; Herisse, L.; Melvin, J.; Miller, A.; Paris, F.; Verniers, J.; Wellman, H. (Apr 2009). "Origin and Radiation of the Earliest Vascular Land Plants". Science. 324 (5925): 353. Bibcode:2009Sci...324..353S. doi:10.1126/science.1169659. ISSN 0036-8075. PMID 19372423.
{{cite journal}}:|hdl-access=requires|hdl=(help) - ↑ Rubinstein, Claudia; Vajda, Vivi (2019). "Baltica cradle of early land plants? Oldest record of trilete spores and diverse cryptospore assemblages; evidence from Ordovician successions of Sweden". GFF (Journal of the Geological Society of Sweden). 141 (3): 181–190. doi:10.1080/11035897.2019.1636860.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ Gray, J.; Chaloner, W. G.; Westoll, T. S. (1985). "The Microfossil Record of Early Land Plants: Advances in Understanding of Early Terrestrialization, 1970–1984". Philosophical Transactions of the Royal Society B. 309 (1138): 167–195. Bibcode:1985RSPTB.309..167G. doi:10.1098/rstb.1985.0077. JSTOR 2396358.
- ↑ Tomescu, A. M. F. (2006). "Wetlands before tracheophytes: Thalloid terrestrial communities of the Early Silurian Passage Creek biota (Virginia)". Wetlands Through Time (PDF). doi:10.1130/2006.2399(02). ISBN 9780813723990 http://www.humboldt.edu/biosci/docs/faculty/TomescuRothwell2006.pdf. Retrieved 2014-05-28.
{{cite book}}: Missing or empty|title=(help) - ↑ Tomescu, A. M. F.; Honegger, R.; Rothwell, G. W. (2008). "Earliest fossil record of bacterial–cyanobacterial mat consortia: the early Silurian Passage Creek biota (440 Ma, Virginia, USA)". Geobiology. 6 (2): 120–124. doi:10.1111/j.1472-4669.2007.00143.x. PMID 18380874.
- ↑ "First Land Plants and Fungi Changed Earth's Climate, Paving the Way for Explosive Evolution of Land Animals, New Gene Study Suggest". science.psu.edu. Archived from the original on 15 December 2019. Retrieved 9 April 2018.
- ↑ Žárský, J.; Žárský, V.; Hanáček, M.; Žárský, V. (2022-01-27). "Cryogenian Glacial Habitats as a Plant Terrestrialisation Cradle – The Origin of the Anydrophytes and Zygnematophyceae Split". Frontiers in Plant Science. Frontiers. 12: 735020. doi:10.3389/fpls.2021.735020. ISSN 1664-462X. PMC 8829067. PMID 35154170.
- ↑ Kump, Leo R. (2008-01-16). "The rise of atmospheric oxygen". Nature. 451 (7176): 277–278. Bibcode:2008Natur.451..277K. doi:10.1038/nature06587. PMID 18202642.
- ↑ Glasspool, IJ; Edwards, D; Axe, L (2004). "Charcoal in the Silurian as evidence for the earliest wildfire". Geology. 32 (5): 381–383. Bibcode:2004Geo....32..381G. doi:10.1130/G20363.1.
- ↑ Bernstein, H; Byers, GS; Michod, RE (1981). "Evolution of sexual reproduction: Importance of DNA repair, complementation, and variation". The American Naturalist. 117 (4): 537–549. doi:10.1086/283734. S2CID 84568130.
- ↑ Michod, RE; Gayley, TW (1992). "Masking of mutations and the evolution of sex". The American Naturalist. 139 (4): 706–734. doi:10.1086/285354. S2CID 85407883.
- ↑ Szövényi, Péter; Ricca, Mariana; Hock, Zsófia; Shaw, Jonathan A.; Shimizu, Kentaro K. & Wagner, Andreas (2013). "Selection is no more efficient in haploid than in diploid life stages of an angiosperm and a moss". Molecular Biology and Evolution. 30 (8): 1929–39. doi:10.1093/molbev/mst095. PMID 23686659.
- ↑ ۳۴٫۰ ۳۴٫۱ ۳۴٫۲ ۳۴٫۳ Boyce, C. K. (2008). "How green was Cooksonia? The importance of size in understanding the early evolution of physiology in the vascular plant lineage". Paleobiology. 34 (2): 179–194. doi:10.1666/0094-8373(2008)034[0179:HGWCTI]2.0.CO;2. ISSN 0094-8373. S2CID 36688488.
- ↑ Kerp, H.; Trewin, N.H.; Hass, H. (2004). "New gametophytes from the Early Devonian Rhynie chert". Transactions of the Royal Society of Edinburgh. 94 (4): 411–428. doi:10.1017/s026359330000078x. S2CID 128629425.
- ↑ Taylor, T.N.; Kerp, H.; Hass, H. (2005). "Life history biology of early land plants: deciphering the gametophyte phase". Proceedings of the National Academy of Sciences of the United States of America. 102 (16): 5892–5897. Bibcode:2005PNAS..102.5892T. doi:10.1073/pnas.0501985102. PMC 556298. PMID 15809414.
- ↑ Holloway, John E. (1939). "The gametophyte, embryo, and young rhizome of Psilotum triquetrum (Swartz)". Annals of Botany. 3 (2): 313–336. doi:10.1093/oxfordjournals.aob.a085063.
- ↑ Kidston, R. & Lang, W.H. (1920), "On Old Red Sandstone plants showing structure, from the Rhynie Chert Bed, Aberdeenshire. Part II. Additional notes on Rhynia gwynne-vaughani, Kidston and Lang; with descriptions of Rhynia major, n.sp. and Hornea lignieri, n.g., n.sp", Transactions of the Royal Society of Edinburgh, 52 (3): 603–627, doi:10.1017/s0080456800004488
- ↑ Remy, W.; Taylor, T.N.; Hass, H.; Kerp, H. (1994). "4 hundred million year old vesicular-arbuscular mycorrhizae". Proceedings of the National Academy of Sciences of the United States of America. 91 (25): 11841–11843. Bibcode:1994PNAS...9111841R. doi:10.1073/pnas.91.25.11841. PMC 45331. PMID 11607500.
- ↑ Schüßler, A.; et al. (2001). "A new fungal phylum, the Glomeromycota: phylogeny and evolution". Mycol. Res. 105 (12): 1416. doi:10.1017/S0953756201005196.
- ↑ Smith, Sally E.; Read, David J. (2008). Mycorrhizal symbiosis (3 ed.). Academic Press. ISBN 9780123705266.
- ↑ Simon, L.; Bousquet, J.; Lévesque, R.C.; Lalonde, M. (1993). "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Nature. 363 (6424): 67–69. Bibcode:1993Natur.363...67S. doi:10.1038/363067a0. S2CID 4319766.
- ↑ Simon, L.; Bousquet, J.; Lévesque, R. C.; Lalonde, M. (1993). "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Nature. 363 (6424): 67–69. Bibcode:1993Natur.363...67S. doi:10.1038/363067a0. S2CID 4319766.
- ↑ Smith, Sally E.; Read, David J. (2008). Mycorrhizal symbiosis (3 ed.). Academic Press. ISBN 9780123705266.
- ↑ Humphreys, C. P.; Franks, P. J.; Rees, M.; Bidartondo, M. I.; Leake, J. R.; Beerling, D. J. (2010). "Mutualistic mycorrhiza-like symbiosis in the most ancient group of land plants". Nature Communications. 1 (8): 103. Bibcode:2010NatCo...1E.103H. doi:10.1038/ncomms1105. PMID 21045821.
- ↑ ۴۶٫۰۰ ۴۶٫۰۱ ۴۶٫۰۲ ۴۶٫۰۳ ۴۶٫۰۴ ۴۶٫۰۵ ۴۶٫۰۶ ۴۶٫۰۷ ۴۶٫۰۸ ۴۶٫۰۹ ۴۶٫۱۰ ۴۶٫۱۱ ۴۶٫۱۲ ۴۶٫۱۳ ۴۶٫۱۴ ۴۶٫۱۵ ۴۶٫۱۶ Brundrett, M. C. (2002). "Coevolution of roots and mycorrhizas of land plants". New Phytologist. 154 (2): 275–304. doi:10.1046/j.1469-8137.2002.00397.x. PMID 33873429.
- ↑ ۴۷٫۰ ۴۷٫۱ ۴۷٫۲ ۴۷٫۳ Raven, John (1977). "The evolution of vascular land plants in relation to supracellular transport processes". Advances in Botanical Research. 1977: 153–219. doi:10.1016/S0065-2296(08)60361-4. ISBN 9780120059058.
- ↑ Qiu, Y.L.; Li, L.; Wang, B.; Chen, Z.; Knoop, V.; Groth-malonek, M.; Dombrovska, O.; Lee, J.; Kent, L.; Rest, J.; et al. (2006). "The deepest divergences in land plants inferred from phylogenomic evidence". Proceedings of the National Academy of Sciences. 103 (42): 15511–6. Bibcode:2006PNAS..10315511Q. doi:10.1073/pnas.0603335103. PMC 1622854. PMID 17030812.
- ↑ Edwards, D.; Davies, K.L.; Axe, L. (1992). "A vascular conducting strand in the early land plant Cooksonia". Nature. 357 (6380): 683–685. Bibcode:1992Natur.357..683E. doi:10.1038/357683a0. S2CID 4264332.
- ↑ Niklas, K. J.; Smocovitis, V. (1983). "Evidence for a Conducting Strand in Early Silurian (Llandoverian) Plants: Implications for the Evolution of the Land Plants". Paleobiology. 9 (2): 126–137. doi:10.1017/S009483730000751X. JSTOR 2400461. S2CID 35550235.
- ↑ ۵۱٫۰ ۵۱٫۱ ۵۱٫۲ ۵۱٫۳ Niklas, K.; Pratt, L. (1980). "Evidence for lignin-like constituents in Early Silurian (Llandoverian) plant fossils". Science. 209 (4454): 396–397. Bibcode:1980Sci...209..396N. doi:10.1126/science.209.4454.396. PMID 17747811. S2CID 46073056.
- ↑ Niklas, K.; Pratt, L. (1980). "Evidence for lignin-like constituents in Early Silurian (Llandoverian) plant fossils". Science. 209 (4454): 396–397. Bibcode:1980Sci...209..396N. doi:10.1126/science.209.4454.396. PMID 17747811. S2CID 46073056.
- ↑ Pittermann J.; Sperry J.S.; Hacke U.G.; Wheeler J.K.; Sikkema E.H. (December 2005). "Torus-Margo Pits Help Conifers Compete with Angiosperms". Science Magazine. 310 (5756): 1924. doi:10.1126/science.1120479. PMID 16373568.
- ↑ Why Christmas trees are not extinct
- ↑ ۵۵٫۰ ۵۵٫۱ Kenrick, Paul (2001). "Turning over a new leaf". Nature. 410 (6826): 309–310. Bibcode:2001Natur.410..309K. doi:10.1038/35066649. PMID 11268183. S2CID 4335355.
- ↑ ۵۶٫۰ ۵۶٫۱ ۵۶٫۲ Beerling D.; Osborne, C. P.; Chaloner, W. G. (2001). "Evolution of leaf-form in land plants linked to atmospheric CO2 decline in the Late Palaeozoic era" (PDF). Nature. 410 (6826): 352–354. Bibcode:2001Natur.410..352B. doi:10.1038/35066546. PMID 11268207. S2CID 4386118.
- ↑ Crane, P.R.; Kenrick, P. (1997). "Diverted development of reproductive organs: A source of morphological innovation in land plants". Plant Systematics and Evolution. 206 (1): 161–174. doi:10.1007/BF00987946. S2CID 23626358.
- ↑ Zimmermann, W. (1959). Die Phylogenie der Pflanzen (2 ed.). Stuttgart: Gustav Fischer Verlag.
- ↑ Piazza, P.; et al. (2005). "Evolution of leaf developmental mechanisms". New Phytol. 167 (3): 693–710. doi:10.1111/j.1469-8137.2005.01466.x. PMID 16101907.
- ↑ Hagemann, W. 1976. Sind Farne Kormophyten? Eine Alternative zur Telomtheorie. Plant Systematics and Evolution 124: 251–277.
- ↑ Hagemann, W (1999). "Towards an organismic concept of land plants: the marginal blastozone and the development of the vegetation body of selected frondose gametophytes of liverworts and ferns". Plant Systematics and Evolution. 216 (1–2): 81–133. doi:10.1007/bf00985102. S2CID 21483458.
- ↑ Sattler, R (1992). "Process morphology: structural dynamics in development and evolution". Canadian Journal of Botany. 70 (4): 708–714. doi:10.1139/b92-091.
- ↑ Sattler, R. 1998. On the origin of symmetry, branching and phyllotaxis in land plants. In: R.V. Jean and D. Barabé (eds) Symmetry in Plants. World Scientific, Singapore, pp. 775-793.
- ↑ James, P.J. (2009). "'Tree and Leaf': A different angle". The Linnean. 25: 17.
- ↑ "A perspective on the CO2 theory of early leaf evolution". Archived from the original on 2011-06-29. Retrieved 2011-03-08.
- ↑ Kotyk, ME; Basinger, JF; Gensel, PG; de Freitas, TA (2002). "Morphologically complex plant macrofossils from the late Silurian of arctic Canada". American Journal of Botany. 89 (6): 1004–1013. doi:10.3732/ajb.89.6.1004. PMID 21665700.
- ↑ Rickards, R.B. (2000). "The age of the earliest club mosses: the Silurian Baragwanathia flora in Victoria, Australia" (abstract). Geological Magazine. 137 (2): 207–209. Bibcode:2000GeoM..137..207R. doi:10.1017/S0016756800003800. S2CID 131287538. Retrieved 2007-10-25.
- ↑ ۶۸٫۰ ۶۸٫۱ ۶۸٫۲ ۶۸٫۳ ۶۸٫۴ Kaplan, D.R. (2001). "The Science of Plant Morphology: Definition, History, and Role in Modern Biology". American Journal of Botany. 88 (10): 1711–1741. doi:10.2307/3558347. JSTOR 3558347. PMID 21669604.
- ↑ Taylor, T.N.; Hass, H.; Kerp, H.; Krings, M.; Hanlin, R.T. (2005). "Perithecial ascomycetes from the 400 million year old Rhynie chert: an example of ancestral polymorphism". Mycologia. 97 (1): 269–285. doi:10.3852/mycologia.97.1.269. hdl:1808/16786. PMID 16389979.
- ↑ ۷۰٫۰ ۷۰٫۱ ۷۰٫۲ Boyce, C.K.; Knoll, A.H. (2002). "Evolution of developmental potential and the multiple independent origins of leaves in Paleozoic vascular plants". Paleobiology. 28 (1): 70–100. doi:10.1666/0094-8373(2002)028<0070:EODPAT>2.0.CO;2. ISSN 0094-8373. S2CID 1650492.
- ↑ Hao, S.; Beck, C.B.; Deming, W. (2003). "Structure of the Earliest Leaves: Adaptations to High Concentrations of Atmospheric CO2". International Journal of Plant Sciences. 164 (1): 71–75. doi:10.1086/344557. S2CID 84741832.
- ↑ Berner, R.A.; Kothavala, Z. (2001). "Geocarb III: A Revised Model of Atmospheric CO2 over Phanerozoic Time". American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Archived from the original (abstract) on 2009-01-29. Retrieved 2008-04-07.
- ↑ Taylor, T.N.; Taylor, E.L. (1993). "The biology and evolution of fossil plants".
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Shellito, C.J.; Sloan, L.C. (2006). "Reconstructing a lost Eocene paradise: Part I. Simulating the change in global floral distribution at the initial Eocene thermal maximum". Global and Planetary Change. 50 (1–2): 1–17. Bibcode:2006GPC....50....1S. doi:10.1016/j.gloplacha.2005.08.001.
- ↑ Aerts, R. (1995). "The advantages of being evergreen". Trends in Ecology & Evolution. 10 (10): 402–407. doi:10.1016/S0169-5347(00)89156-9. PMID 21237084.
- ↑ Labandeira, C.C.; Dilcher, D.L.; Davis, D.R.; Wagner, D.L. (1994). "Ninety-seven million years of angiosperm-insect association: paleobiological insights into the meaning of coevolution". Proceedings of the National Academy of Sciences of the United States of America. 91 (25): 12278–12282. Bibcode:1994PNAS...9112278L. doi:10.1073/pnas.91.25.12278. PMC 45420. PMID 11607501.
- ↑ Stanley, Morgan (9 June 2011). "Taiga". National Geographic. Retrieved 2021-04-27.
- ↑ Brown V; et al. (1991). "Herbivory and the Evolution of Leaf Size and Shape". Philosophical Transactions of the Royal Society B. 333 (1267): 265–272. doi:10.1098/rstb.1991.0076.
- ↑ Harrison C. J.; et al. (2005). "Independent recruitment of a conserved developmental mechanism during leaf evolution". Nature. 434 (7032): 509–514. Bibcode:2005Natur.434..509H. doi:10.1038/nature03410. PMID 15791256. S2CID 4335275.
- ↑ Jackson D.; Hake S. (1999). "Control of Phyllotaxy in Maize by the ABPHYL1 Gene". Development. 126 (2): 315–323. doi:10.1242/dev.126.2.315. PMID 9847245.
- ↑ Cronk Q. (2001). "Plant evolution and development in a post-genomic context". Nature Reviews Genetics. 2 (8): 607–619. doi:10.1038/35084556. PMID 11483985. S2CID 22929939.
- ↑ Tattersall; et al. (2005). "The Mutant crispa Reveals Multiple Roles for PHANTASTICA in Pea Compound Leaf Development". Plant Cell. 17 (4): 1046–1060. doi:10.1105/tpc.104.029447. PMC 1087985. PMID 15749758.
- ↑ Bharathan, Geeta; Sinha, Neelima Roy (Dec 2001). "The Regulation of Compound Leaf Development". Plant Physiol. 127 (4): 1533–1538. doi:10.1104/pp.010867. PMC 1540187. PMID 11743098.
- ↑ Nath, U; Crawford, BC; Carpenter, R; et al. (2003). "Genetic Control of Surface Curvature". Science. 299 (5611): 1404–1407. CiteSeerX 10.1.1.625.1791. doi:10.1126/science.1079354. PMID 12610308. S2CID 8059321.
- ↑ Li, Chao; Zhang, Baohong (February 2016). "MicroRNAs in Control of Plant Development". Journal of Cellular Physiology. 231 (2): 303–13. doi:10.1002/jcp.25125. PMID 26248304. S2CID 23434501.
- ↑ Mecchia, MA; Debernardi, JM; Rodriguez, RE; Schommer, C; Palatnik, JF (January 2013). "MicroRNA miR396 and RDR6 synergistically regulate leaf development". Mechanisms of Development. 130 (1): 2–13. doi:10.1016/j.mod.2012.07.005. PMID 22889666.
- ↑ de Souza, Rocheli; Ambrosini, Adriana; Passaglia, Luciane M.P. (December 2015). "Plant growth-promoting bacteria as inoculants in agricultural soils". Genetics and Molecular Biology. 38 (4): 401–19. doi:10.1590/S1415-475738420150053. PMC 4763327. PMID 26537605.
- ↑ Mora, C.I.; Driese, S.G.; Colarusso, L.A. (1996). "Middle to Late Paleozoic Atmospheric CO2 Levels from Soil Carbonate and Organic Matter". Science. 271 (5252): 1105–1107. Bibcode:1996Sci...271.1105M. doi:10.1126/science.271.5252.1105. S2CID 128479221.
- ↑ Berner, R.A. (1994). "GEOCARB II: A revised model of atmospheric CO2 over Phanerozoic time". Am. J. Sci. 294 (1): 56–91. Bibcode:1994AmJS..294...56B. doi:10.2475/ajs.294.1.56.
- ↑ ۹۰٫۰ ۹۰٫۱ Algeo, T.J.; Berner, R.A.; Maynard, J.B.; Scheckler, S.E.; Archives, G.S.A.T. (1995). "Late Devonian Oceanic Anoxic Events and Biotic Crises: "Rooted" in the Evolution of Vascular Land Plants?". GSA Today. 5 (3). Archived from the original on 13 اكتبر 2022. Retrieved 13 اكتبر 2022.
{{cite journal}}: Check date values in:|access-date=و|archive-date=(help) - ↑ Retallack, G. J. (1986). Wright, V. P. (ed.). Paleosols: their Recognition and Interpretation. Oxford: Blackwell.
- ↑ "Tracheophyta - 2". Paleos - Life Through Deep Time.
- ↑ Richard M. Bateman, Peter R. Crane, William A. DiMichele, Paul R. Kenrick, Nick P. Rowe, Thomas Speck, and William E. Stein (1998). "EARLY EVOLUTION OF LAND PLANTS: Phylogeny, Physiology, and Ecology of the Primary Terrestrial Radiation". Annual Review of Ecology and Systematics. 29: 263–292. doi:10.1146/annurev.ecolsys.29.1.263. S2CID 44508826.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Hetherington, Alexander J; Dolan, Liam (2017). "Bilaterally symmetric axes with rhizoids composed the rooting structure of the common ancestor of vascular plants". Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1739): 20170042. doi:10.1098/rstb.2017.0042. PMC 5745339. PMID 29254968.
- ↑ ۹۵٫۰ ۹۵٫۱ ۹۵٫۲ ۹۵٫۳ ۹۵٫۴ ۹۵٫۵ ۹۵٫۶ ۹۵٫۷ ۹۵٫۸ Algeo, T.J.; Scheckler, S.E. (1998). "Terrestrial-marine teleconnections in the Devonian: links between the evolution of land plants, weathering processes, and marine anoxic events". Philosophical Transactions of the Royal Society B. 353 (1365): 113–130. doi:10.1098/rstb.1998.0195. PMC 1692181.
- ↑ Hetherington, Alexander J.; Dolan, Liam (2018). "Stepwise and independent origins of roots among land plants". Nature. 561 (7722): 235–238. Bibcode:2018Natur.561..235H. doi:10.1038/s41586-018-0445-z. PMC 6175059. PMID 30135586.
- ↑ Coudert, Yoan; Anne Dievart; Gaetan Droc; Pascal Gantet (2012). "ASL/LBD Phylogeny Suggests that Genetic Mechanisms of Root Initiation Downstream of Auxin Are Distinct in Lycophytes and Euphyllophytes". Molecular Biology and Evolution. 30 (3): 569–72. doi:10.1093/molbev/mss250. ISSN 0737-4038. PMID 23112232.
- ↑ ۹۸٫۰ ۹۸٫۱ Kenrick, P.; Crane, P.R. (1997). "The origin and early evolution of plants on land". Nature. 389 (6646): 33–39. Bibcode:1997Natur.389...33K. doi:10.1038/37918. S2CID 3866183.
- ↑ Alain Pierret, Jean-Luc Maeght, Corentin Clément, Jean-Pierre Montoroi, Christian Hartmann, Santimaitree Gonkhamdee (July 2016). "Understanding deep roots and their functions in ecosystems: an advocacy for more unconventional research". Annals of Botany. 118 (4): 621–635. doi:10.1093/aob/mcw130. PMC 5055635. PMID 27390351.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Gerrienne, Philippe; Gensel, Patricia G.; Strullu-Derrien, Christine; Lardeux, Hubert; Steemans, Philippe; Prestianni, Cyrille (2011). "A simple type of wood in two early Devonian plants". Science. 333 (6044): 837. Bibcode:2011Sci...333..837G. doi:10.1126/science.1208882. PMID 21836008. S2CID 23513139.
- ↑ Kinver, Mark (16 August 2011). "'Early wood' samples reshape plant history". BBC News.
- ↑ Stein, W.E.; Mannolini, F.; Hernick, L.V.; Landing, E.; Berry, C.M. (2007). "Giant cladoxylopsid trees resolve the enigma of the Earth's earliest forest stumps at Gilboa". Nature. 446 (7138): 904–7. Bibcode:2007Natur.446..904S. doi:10.1038/nature05705. PMID 17443185. S2CID 2575688.
- ↑ Retallack, G.J.; Catt, J.A.; Chaloner, W.G. (1985). "Fossil Soils as Grounds for Interpreting the Advent of Large Plants and Animals on Land [and Discussion]". Philosophical Transactions of the Royal Society B. 309 (1138): 105–142. Bibcode:1985RSPTB.309..105R. doi:10.1098/rstb.1985.0074. JSTOR 2396355.
- ↑ Dannenhoffer, J.M.; Bonamo, P.M. (1989). "Rellimia thomsonii from the Givetian of New York: Secondary Growth in Three Orders of Branching". American Journal of Botany. 76 (9): 1312–1325. doi:10.2307/2444557. JSTOR 2444557.
- ↑ Davis, P; Kenrick, P. (2004). Fossil Plants. Smithsonian Books, Washington D.C. ISBN 978-1-58834-156-3.
- ↑ Donoghue, M.J. (2005). "Key innovations, convergence, and success: macroevolutionary lessons from plant phylogeny" (abstract). Paleobiology. 31 (2): 77–93. doi:10.1666/0094-8373(2005)031[0077:KICASM]2.0.CO;2. ISSN 0094-8373. S2CID 36988476. Retrieved 2008-04-07.
- ↑ ۱۰۷٫۰ ۱۰۷٫۱ ۱۰۷٫۲ Bowe, L.M.; Coat, G.; Depamphilis, C.W. (2000). "Phylogeny of seed plants based on all three genomic compartments: Extant gymnosperms are monophyletic and Gnetales' closest relatives are conifers". Proceedings of the National Academy of Sciences. 97 (8): 4092–7. Bibcode:2000PNAS...97.4092B. doi:10.1073/pnas.97.8.4092. PMC 18159. PMID 10760278.
- ↑ ۱۰۸٫۰ ۱۰۸٫۱ ۱۰۸٫۲ Chaw, S.M.; Parkinson, C.L.; Cheng, Y.; Vincent, T.M.; Palmer, J.D. (2000). "Seed plant phylogeny inferred from all three plant genomes: Monophyly of extant gymnosperms and origin of Gnetales from conifers". Proceedings of the National Academy of Sciences. 97 (8): 4086–91. Bibcode:2000PNAS...97.4086C. doi:10.1073/pnas.97.8.4086. PMC 18157. PMID 10760277.
- ↑ ۱۰۹٫۰ ۱۰۹٫۱ ۱۰۹٫۲ Soltis, D.E.; Soltis, P.S.; Zanis, M.J. (2002). "Phylogeny of seed plants based on evidence from eight genes". American Journal of Botany. 89 (10): 1670–81. doi:10.3732/ajb.89.10.1670. PMID 21665594.
- ↑ Friis, E.M.; Pedersen, K.R.; Crane, P.R. (2006). "Cretaceous angiosperm flowers: Innovation and evolution in plant reproduction". Palaeogeography, Palaeoclimatology, Palaeoecology. 232 (2–4): 251–293. Bibcode:2006PPP...232..251F. doi:10.1016/j.palaeo.2005.07.006.
- ↑ Hilton, J.; Bateman, R.M. (2006). "Pteridosperms are the backbone of seed-plant phylogeny". The Journal of the Torrey Botanical Society. 133 (1): 119–168. doi:10.3159/1095-5674(2006)133[119:PATBOS]2.0.CO;2. ISSN 1095-5674. S2CID 86395036.
- ↑ ۱۱۲٫۰ ۱۱۲٫۱ Bateman, R.M.; Hilton, J.; Rudall, P.J. (2006). "Morphological and molecular phylogenetic context of the angiosperms: contrasting the 'top-down' and 'bottom-up' approaches used to infer the likely characteristics of the first flowers". Journal of Experimental Botany. 57 (13): 3471–503. doi:10.1093/jxb/erl128. PMID 17056677.
- ↑ ۱۱۳٫۰ ۱۱۳٫۱ Frohlich, M.W.; Chase, M.W. (2007). "After a dozen years of progress the origin of angiosperms is still a great mystery". Nature. 450 (7173): 1184–9. Bibcode:2007Natur.450.1184F. doi:10.1038/nature06393. PMID 18097399. S2CID 4373983.
- ↑ Magallón, Susana; Castillo, Amanda (2009-01-01). "Angiosperm diversification through time". American Journal of Botany. 96 (1): 349–365. doi:10.3732/ajb.0800060. PMID 21628193. Archived from the original on 13 اكتبر 2022. Retrieved 2021-04-27.
{{cite journal}}: Check date values in:|archive-date=(help) - ↑ Gerrienne, P.; Meyer-Berthaud, B.; Fairon-Demaret, M.; Streel, M.; Steemans, P. (2011). "Science Magazine". Runcaria, A Middle Devonian Seed Plant Precursor. American Association for the Advancement of Science. 306 (5697): 856–858. doi:10.1126/science.1102491. PMID 15514154. S2CID 34269432. Retrieved March 22, 2011.
- ↑ A Late Devonian Fertile Organ with Seed Plant Affinities from China | Scientific Reports
- ↑ ۱۱۷٫۰ ۱۱۷٫۱ ۱۱۷٫۲ Mapes, G.; Rothwell, G.W.; Haworth, M.T. (1989). "Evolution of seed dormancy". Nature. 337 (6208): 645–646. Bibcode:1989Natur.337..645M. doi:10.1038/337645a0. S2CID 4358761.
- ↑ Bawa, KS; Webb, CJ (1984). "Flower, fruit and seed abortion in tropical forest trees. Implications for the evolution of paternal and maternal reproductive patterns". American Journal of Botany. 71 (5): 736–751. doi:10.2307/2443371. JSTOR 2443371.
- ↑ Cheah KS, Osborne DJ (April 1978). "DNA lesions occur with loss of viability in embryos of ageing rye seed". Nature. 272 (5654): 593–9. Bibcode:1978Natur.272..593C. doi:10.1038/272593a0. PMID 19213149. S2CID 4208828.
- ↑ Koppen G, Verschaeve L (2001). "The alkaline single-cell gel electrophoresis/comet assay: a way to study DNA repair in radicle cells of germinating Vicia faba". Folia Biol. (Praha). 47 (2): 50–4. PMID 11321247.
- ↑ Bray CM, West CE (December 2005). "DNA repair mechanisms in plants: crucial sensors and effectors for the maintenance of genome integrity". New Phytol. 168 (3): 511–28. doi:10.1111/j.1469-8137.2005.01548.x. PMID 16313635.
- ↑ Bernstein C, Bernstein H. (1991) Aging, Sex, and DNA Repair. Academic Press, San Diego. شابک ۰۱۲۰۹۲۸۶۰۴ شابک ۹۷۸−۰۱۲۰۹۲۸۶۰۶
- ↑ Feild, T. S.; Brodribb, T. J.; Iglesias, A.; Chatelet, D. S.; Baresch, A.; Upchurch, G. R.; Gomez, B.; Mohr, B. A. R.; Coiffard, C.; Kvacek, J.; Jaramillo, C. (2011). "Fossil evidence for Cretaceous escalation in angiosperm leaf vein evolution". Proceedings of the National Academy of Sciences. 108 (20): 8363–8366. Bibcode:2011PNAS..108.8363F. doi:10.1073/pnas.1014456108. PMC 3100944. PMID 21536892.
- ↑ Lawton-Rauh, A.; Alvarez-Buylla, E.R.; Purugganan, M.D. (2000). "Molecular evolution of flower development". Trends in Ecology and Evolution. 15 (4): 144–149. doi:10.1016/S0169-5347(99)01816-9. PMID 10717683.
- ↑ Chinese Academy of Sciences (18 December 2018). "Flowers originated 50 million years earlier than previously thought". EurekAlert!. Retrieved 18 December 2018.
- ↑ Coiro, Mario; Doyle, James A.; Hilton, Jason (2019-01-25). "How deep is the conflict between molecular and fossil evidence on the age of angiosperms?". New Phytologist (به انگلیسی). 223 (1): 83–99. doi:10.1111/nph.15708. PMID 30681148.
- ↑ Nam, J.; Depamphilis, CW; Ma, H; Nei, M (2003). "Antiquity and Evolution of the MADS-Box Gene Family Controlling Flower Development in Plants". Mol. Biol. Evol. 20 (9): 1435–1447. doi:10.1093/molbev/msg152. PMID 12777513.
- ↑ Crepet, William L. (2000-11-21). "Progress in understanding angiosperm history, success, and relationships: Darwin's abominably "perplexing phenomenon"". Proceedings of the National Academy of Sciences of the United States of America. 97 (24): 12939–12941. ISSN 0027-8424. PMID 11087846.
{{cite journal}}: line feed character in|title=at position 59 (help) - ↑ Sun, G.; Ji, Q.; Dilcher, D.L.; Zheng, S.; Nixon, K.C.; Wang, X. (2002). "Archaefructaceae, a New Basal Angiosperm Family". Science. 296 (5569): 899–904. Bibcode:2002Sci...296..899S. doi:10.1126/science.1069439. PMID 11988572. S2CID 1910388.
- ↑ In fact, Archaefructus probably didn't bear true flowers: see
- Friis, E.M.; Doyle, J.A.; Endress, P.K.; Leng, Q. (2003). "Archaefructus—angiosperm precursor or specialized early angiosperm?". Trends in Plant Science. 8 (8): 369–373. doi:10.1016/S1360-1385(03)00161-4. PMID 12927969.
- ↑ Jin, JP; He, K; Tang, X; Li, Z; Lv, L; Zhao, Y; Luo, J; Gao, G (July 2015). "An Arabidopsis transcriptional regulatory map reveals distinct functional and evolutionary features of novel transcription factors". Molecular Biology and Evolution. 32 (7): 1767–1773. doi:10.1093/molbev/msv058. PMC 4476157. PMID 25750178.
- ↑ Pichersky E.; Gang D. (2000). "Genetics and biochemistry of secondary metabolites in plants: an evolutionary perspective". Trends Plant Sci. 5 (10): 439–445. doi:10.1016/S1360-1385(00)01741-6. PMID 11044721.
- ↑ Nina Theis; Manuel Lerdau (2003). "The evolution of function in plant secondary metabolites". Int. J. Plant Sci. 164 (S3): S93–S102. doi:10.1086/374190. S2CID 85705162.
- ↑ Bohlmann J.; et al. (1998). "Plant terpenoid synthases: molecular and phylogenetic analysis". Proc. Natl. Acad. Sci. U.S.A. 95 (8): 4126–4133. Bibcode:1998PNAS...95.4126B. doi:10.1073/pnas.95.8.4126. PMC 22453. PMID 9539701.
- ↑ Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". Microbiome, 6(1): 58. doi:10.1186/s40168-018-0445-0.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. - ↑ Lucking, R., Huhndorf, S., Pfister, D.H., Plata, E.R. and Lumbsch, H.T. (2009) "Fungi evolved right on track". Mycologia, 101(6): 810–822. doi:10.3852/09-016.
- ↑ Heckman, D.S., Geiser, D.M., Eidell, B.R., Stauffer, R.L., Kardos, N.L. and Hedges, S.B. (2001) "Molecular evidence for the early colonization of land by fungi and plants". Science, 293(5532): 1129–1133. doi:10.1126/science.1061457.
- ↑ Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". Microbiome, 6(1): 58. doi:10.1186/s40168-018-0445-0.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. - ↑ ۱۳۹٫۰ ۱۳۹٫۱ Capelle, J.; Neema, C. (Nov 2005). "Local adaptation and population structure at a micro-geographical scale of a fungal parasite on its host plant". Journal of Evolutionary Biology. 18 (6): 1445–1454. doi:10.1111/j.1420-9101.2005.00951.x. PMID 16313457. S2CID 12986653.
- ↑ Burdon, J.J.; Thrall, P.H. (2009). "Co-evolution of plants and their pathogen in natural habitats". Science. 324 (5928): 755–756. Bibcode:2009Sci...324..755B. doi:10.1126/science.1171663. PMC 2689373. PMID 19423818.
- ↑ Burdon, J.J.; Thrall, P.H. (2009). "Co-evolution of plants and their pathogen in natural habitats". Science. 324 (5928): 755–756. Bibcode:2009Sci...324..755B. doi:10.1126/science.1171663. PMC 2689373. PMID 19423818.
- ↑ Sahai, A.S.; Manocha, M.S. (1992). "Chitinases of fungi and plants: their involvement in morphogenesis and host-parasite interaction". FEMS Microbiology Reviews. 11 (4): 317–338. doi:10.1111/j.1574-6976.1993.tb00004.x.
- ↑ Clay, Keith (1991). "Parasitic castration of plants by fungi". Trends in Ecology & Evolution. 6 (5): 162–166. doi:10.1016/0169-5347(91)90058-6. PMID 21232447.
- ↑ Zhan, J.; Mundt, C.C.; Hoffer, M.E.; McDonald, B.A. (2002). "Local adaptation and effect of host genotype on the rate of pathogen evolution: an experimental test in a plant pathosystem". Journal of Evolutionary Biology. 15 (4): 634–647. doi:10.1046/j.1420-9101.2002.00428.x. S2CID 83662474.
- ↑ Delmotte, F.; Bucheli, E.; Shykoff, J.A. (1999). "Host and parasite population structure in a natural plant-pathogen system". Heredity. 82 (3): 300–308. doi:10.1038/sj.hdy.6884850. PMID 10336705.
- ↑ Desprez-Loustau, M.-L.; Vitasse, Y.; Delzon, S.; Capdevielle, X.; Marcais, B.; Kremer, A. (2010). "Are plant pathogen populations adapted for encounter with their host? A case study of phenological synchrony between oak and an obligate fungal parasite along an altitudinal gradient" (PDF). Journal of Evolutionary Biology. 23 (1): 87–97. doi:10.1111/j.1420-9101.2009.01881.x. PMID 19895655. S2CID 25006120.


 French
French Deutsch
Deutsch
