فلج دورهای تیروتوکسیک - ویکیپدیا، دانشنامهٔ آزاد
| فلج دورهای تیروتوکسیک | |
|---|---|
 | |
| فلج دورهای تیروتوکسیک زمانی رخ میدهد که غده تیروئید مقادیر زیادی تیروکسین (هورمون تیروئید) آزاد میکند. | |
| تخصص | غدد درونریز |
| نشانهها | گرفتگی ماهیچهها، ضعف و فلجشدن. در مواردی کاهش وزن، تپش قلب، رعشه، تعریق، بیماری تیروئید چشمی و درموپاتی تیروئیدی |
| دورهٔ معمول آغاز | معمولاً ۲۰ تا ۴۰ سالگی |
| علت | جهشهای ژنتیکی |
| عوامل خطر | بیماریهای تیروئیدی، فعالیت بدنی، مصرف الکل، کربوهیدرات یا نمک به مقدار زیاد |
| روش تشخیص | بر اساس علائم و نشانگرهای زیستی |
| تشخیص افتراقی | سایر انواع فلج دورهای، به ویژه فلج دورهای هیپوکالمی |
| دارو | بتابلاکرها مانند پروپرانولول |
| فراوانی | در مردان ۱۷ تا ۷۰ برابر زنان |
| طبقهبندی و منابع بیرونی | |
فلج دورهای تیروتوکسیک (به انگلیسی: Thyrotoxic periodic paralysis) که به صورت مخفّف TPP هم نامیده میشود، وضعیتی است که در آن حملات فلج عضلانی در زمان پرکاری تیروئید بروز پیدا میکند. هیپوکالمی (کاهش سطح پتاسیم در خون) معمولاً در طول حملات وجود دارد. در این حملات اگر ضعف ماهیچههای تنفسی منجر به نارسایی تنفسی شود یا سطح پایین پتاسیم منجر به آریتمیهای قلبی (بینظمی در ضربان قلب) شود، این وضعیت ممکن است تهدیدکنندهٔ زندگی باشد. اگر این بیماری درمان نشود، معمولاً بهطور مکرر عود میکند.
بروز این بیماری با جهشهای ژنتیکی در ژنهای کدگذاریکنندهٔ کانالهای یونی مخصوص انتقال الکترولیتها (سدیم و پتاسیم) از طریق غشای سلولی، مرتبط است. اصلیترینِ این کانالهای یونی، کانال کلسیم نوع-L زیرواحد-α۱ و کانال یکسوکنندهٔ داخلیِ پتاسیم ۲٫۶ است. درگیری این کانالها به عنوان یک کانالوپاتی طبقهبندی میشود؛ تصور میشود که ناهنجاری در این مجراها — در شرایطی که سطح تیروکسین (هورمون تیروئید) زیاد است و یک عامل اضافی تسریعکننده حضور دارد — منجر به ورود پتاسیم بهدرون سلولها میشود.
درمان هیپوکالمی و اصلاح پرکاری تیروئید، منجر به رفع کامل حملات میشود. این بیماری بیشتر در مردان چینی، ژاپنی، ویتنامی، فیلیپینی و کرهای مشاهده میشود. فلج دورهای تیروتوکسیک یکی از چندین بیماری است که میتواند باعث فلج دورهای شود.
علائم و نشانهها[ویرایش]
حمله اغلب با درد ماهیچه، گرفتگی و سفتشدنِ ماهیچهها شروع میشود.[۱] پس از آن، ضعف یا فلجشدن بهسرعت پدیدار میگردد که وقوع آن در اواخر عصر یا ساعات اولیهٔ صبح رایجتر است. ضعف معمولاً در دو طرف بدن متقارن است[۱] و بیشترِ ماهیچههای اندامهای نزدیک به تنه (پروگزیمال[الف]) درگیر میشوند. این ضعف از پاها شروع شده و به بازوها میرسد. ماهیچههای دهان و گلو، چشمها و اندام تنفسی معمولاً تحت تأثیر قرار نمیگیرند، اما گاهی ضعف عضلات تنفسی میتواند باعث نارسایی تنفسی شود که خطرساز است. این حملات بهطور معمول طی چند ساعت تا چند روز، حتی بدون درمان، برطرف میشوند.[۱][۲][۳] معاینه حین حمله عصبی، ضعف و سستی اندامها را مشخص میکند. رفلکسها معمولاً کاهش مییابند، هر چند، دستگاه حسی تحت تأثیر قرار نمیگیرد[۱][۲] و وضعیت ذهنی و ادراکی نیز دچار اختلال نمیشود.[۱]
حملات ممکن است در اثر فعالیت بدنی، نوشیدن الکل یا خوردن غذای حاوی کربوهیدرات یا نمکِ زیاد، تحریک شوند. این موضوع میتواند دلیل خوبی برای توجیه این باشد که چرا بسیاری از حملات در تابستان رخ میدهد، درست همان هنگامی که افراد معمولاً فعالیت و ورزش بیشتری میکنند و در همان حین نوشیدنیهای شیرین مینوشند. حملات مرتبط با فعالیتهای ورزشی، معمولاً پس از استراحتِ بلافاصله پس از تمرین رخ میدهد؛ از این رو، ممکن است برای قطع حمله توصیه شود که بیمار ورزش را ادامه دهد.[۲]
ممکن است علائم بیشفعالی تیروئید مانند کاهش وزن، تپش قلب، رعشه و تعریق وجود داشته باشد؛[۲][۳] اما این علائم فقط در نیمی از موارد فلج دورهای تیروتوکسیک مشاهده میشود.[۱] شایعترین نوع پرکاری تیروئید یعنی بیماری گریوز ممکن است مشکلات چشمی مثل آفتالموپاتی گریوز و عارضههای پوستی همچون درموپاتی گریوز را نیز ایجاد کند.[۴] بیماری تیروئید همچنین میتواند باعث ضعف عضلانی به شکل میوپاتی تیروتوکسیک شود، اما این حالت بهشکل پیوسته و نه دورهای است.[۱]
علل[ویرایش]
عوامل ژنتیکی[ویرایش]
جهشهای ژنتیکی در کانال کلسیم نوع L زیرواحد α۱ در ساکنان جنوب چین که مبتلا به این بیماری هستند، مشاهده است. جهشهای ژنی این بیماری در قسمت مجزایی از همان ژنی روی میدهد که برخی جهشهای دیگرش سبب بروز فلج دورهای میگردد. در بیماری فلج دورهای تیروتوکسیک، جهشهای توصیف شده، پُلیمورفیسم تک نوکلئوتیدی هستند که در جایگاه عامل واکنشدهنده به هورمون تیروئید قرار دارند، و این بدان معناست که رونویسی ژن و تولید کانالهای یونی ممکن است با افزایش سطح هورمون تیروئید تغییر کند. علاوه بر این، جهشهایی در ژنهای رمزگذار مجرای پتاسیم دریچهدار وابسته به ولتاژ، زیر خانواده مربوط به شا، عضو ۴ (Kv۳٫۴) و پروتئین کانال سدیم نوع ۴، زیرواحد آلفا (Na41.4) گزارش شدهاست.[۲]
از میان افراد مبتلا به فلج دورهای تیروتوکسیک، نزدیک به ۳۳٪ دارای جهش در KCNJ18 هستند که ژن رمزگذار کانال Kir2.6 میباشد که نوعی کانال یونیِ یکسوکنندهٔ جریانِ پتاسیم به داخل سلول است.[ب] این ژن نیز دارای عامل واکنش به هورمون تیروئید است.[۵]
برخی از اشکال آنتیژن لکوسیت انسانی (HLA) - بهویژه B46، DR9، DQB1*0303، A2، Bw22، AW19، B17 و DRW8 - در فلج دورهای تیروتوکسیک شیوع بیشتری دارد. ارتباط بیماری با انواع خاص از HLA که نقش مهمی در پاسخ ایمنی دارند، مطرحکنندهٔ این فرضیه است که دستگاه ایمنی بدن ممکن است در بروز این بیماری نقش داشته باشد؛ اما مشخص نیست که آیا این امر مستقیماً باعث بروز فلج دورهای تیروتوکسیک میشود یا آن که ابتلا به بیماری گریوز را افزایش میدهد که یک بیماری خود ایمنی شناخته شدهاست.[۲]
بیماری[ویرایش]
شایعترین شکل بیماری تیروئید مرتبط با فلج دورهای تیروتوکسیک، بیماری گریوز است که سندرم ناشی از واکنش خودایمنی است و منجر به تولید بیش از حد هورمون تیروئید میشود.[۴] فلج دورهای تیروتوکسیک همچنین در افراد مبتلا به سایر مشکلات تیروئید همچون تیروئیدیت، گواتر مولتیندولار سمی[پ]، آدنوم تیروئید، آدنوم هیپوفیز تولیدکنندهٔ TSH، مصرف بیش از حد تیروکسین یا ید،[۲] و پرکاری تیروئید ناشی از آمیودارون دیده میشود.[۳]
سازوکار[ویرایش]
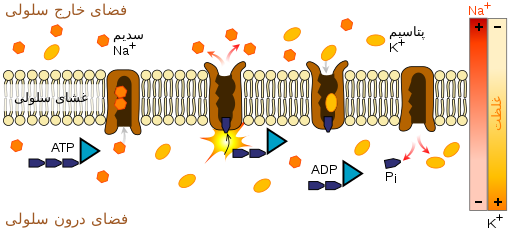
دلیل اصلیِ فلجِ عضلانی و افزایش خطر آریتمی قلب در فلج دورهای تیروتوکسیک، کاهش قابل توجه سطح پتاسیم در جریان خون است. پتاسیم در واقع از بدن دفع نمیشود اما افزایش فعالیت پمپ سدیم-پتاسیم (آنزیمی که پتاسیم را به داخل سلولها منتقل میکند و سدیم را در خون نگه میدارد) منجر به حرکتِ پتاسیم به سمت بافتها شده و مقدار آن را در گردش خون کاهش میدهد. در سایر انواع اختلالات پتاسیم، تعادل اسید و باز معمولاً مختل میشود، چنانکه فرد مبتلا دچار آلکالوز متابولیک یا اسیدوز متابولیک است. در فلج دورهای تیروتوکسیک این اختلالات معمولاً وجود ندارند. کاهش پتاسیم خون منجر به هایپرپلاریزاسیون[ت] سلولهای ماهیچهای میشود و باعث میشود اتصال عصبی-ماهیچهای به پالسهای عصبی طبیعی کمتر پاسخ دهد و در نتیجه، منجر به کاهش انقباض عضلات شود.[۲]
هنوز مشخص نیست که نقصهای ژنتیکی توصیفشده، چگونه فعالیت پمپ سدیم-پتاسیم را افزایش میدهند، اما گمان میرود که این آنزیم به دلیل افزایش سطح هورمون تیروئید فعالتر شود. پرکاری تیروئید سطوح کاتکول آمینها (مانند آدرنالین) را در خون و فعالیت پمپ سدیم-پتاسیم را افزایش میدهد. فعالیت آنزیم در ادامه توسط عوامل تسریعکننده افزایش مییابد.[۱] به عنوان مثال افزایش مصرف کربوهیدرات منجر به افزایش سطح انسولین میشود که سبب فعال کردن پمپ سدیم-پتاسیم میگردد.[۲] هنگامی که این عامل تسریعکننده برداشته میشود، فعالیت آنزیم به سطح طبیعی بازمیگردد. فرض بر این است که هورمونهای مردانه (برای مثال آندروژن) فعالیت پمپ سدیم-پتاسیم را افزایش میدهند و همین موضوع، میتواند نشان دهد که چرا مردان، بیش از زنان در معرض ابتلا به فلج دورهای تیروتوکسیک هستند، حتی با وجود آنکه بیماری تیروئید در زنان شایعتر است.[۳]
فلج دورهای تیروتوکسیک نمونهای از اختلالات مشابه تحت عنوان «کانالوپاتی» است که با جهش در کانالهای یونی ارتباط دارند. اکثر این اختلالات بهصورت گاهبهگاه و اتفاقی رخ میدهند.[۵]
تشخیص[ویرایش]
هیپوکالمی (سطح پایین پتاسیم خون) معمولاً در طول حملات رخ میدهد؛ در این حالت سطح پتاسیم به کمتر از ۳٫۰ میلیمول در لیتر میرسد. سطح منیزیم و فسفات نیز اغلب کاهش مییابد. سطح کراتین کیناز در دو سوم موارد افزایش مییابد که معمولاً به دلیل آسیب عضلانی است. افزایش شدیدِ کراتین کیناز در موارد نادر، نشاندهندهٔ رابدومیولیز (تخریب بافت ماهیچهای) است.[۲][۳] نوار قلب ممکن است تپش قلب شدید به دلیل بیماری تیروئید، ناهنجاریهای ناشی از آریتمی قلب (فیبریلاسیون دهلیزی، تندتپشی بطنی)، و تغییرات مرتبط با هیپوکالمی (امواج U، پهنشدن QRS، طولانی شدن QT و صاف شدن موج T) را نشان دهد.[۳] نوار عصب و عضله تغییراتی مشابه آنچه در میوپاتی (بیماریهای عضلانی) مشاهده میشود با کاهش دامنه پتانسیل عمل جامع عضله (CMAP) را نشان میدهد که با شروع درمان برطرف میشوند.[۲][۶]
فلج دورهای تیروتوکسیک با انجامِ آزمایش خونی عملکرد تیروئید از سایر انواع فلج دورهای (به ویژه فلج دورهای هیپوکالمی) متمایز میشود. آزمایش عملکرد تیروئید در سایر اشکال فلج دورهای، طبیعی است و در پرکاری تیروئید سطوح تیروکسین و تری یدوتیرونین افزایش مییابد و در نتیجه تولید هورمون محرکه تیروئید توسط غده هیپوفیز متوقف میشود. آزمایشهای مختلف دیگری عمدتاً برای تمایز و تشخیص علل مختلف پرکاری تیروئید انجام میشود.[۴]
درمان[ویرایش]
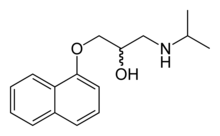
در مرحلهٔ حاد حمله، تجویز پتاسیم میتواند بهسرعت قدرت عضلات را بازیابی و از عوارض جلوگیری نماید. با این حال این تجویزی است که با احتیاط توصیه میشود چرا که در این بیماری، مقدار کل پتاسیم در بدن کاهش نمییابد و حتی ممکن است در ادامه سطح پتاسیم بیش از حد افزایش پیدا کند (هایپرکالمی برگشتی). بنابراین، توصیه مناسب میتواند «تزریق آهسته» پتاسیم کلرید در کنار درمانهای جانبی و همزمان دیگر باشد.[۲]
عوارض افزایش سطح هورمون تیروئید معمولاً به تجویز بتابلاکرهای غیراختصاصی مانند پروپرانولول پاسخ میدهد (زیرا بیشتر علائم ناشی از افزایش سطح آدرنالین بوده و تأثیر آن بر گیرندههای β-آدرنرژیک است). تا زمانی که بیماری تیروئید بهطور مناسب تحت درمان است، میتوان با اجتناب از عوامل تسریعکنندهٔ حملات مانند مصرف زیاد نمک یا کربوهیدرات، از وقوع حملات بعدی جلوگیری کرد.[۲]
درمان بیماری تیروئید معمولاً باعث کاهش حملات ناشی از فلج عضلانی میشود. بسته به ماهیت بیماری، درمان ممکن است شامل تایروستاتیکها (داروهای ضدتیروئید یا داروهایی که تولید هورمون تیروئید را کاهش میدهند)، ایزوتوپهای یُد یا گاهی اوقات جراحی تیروئید باشد.[۲][۳]
همهگیرشناسی[ویرایش]
فلج دورهای تیروتوکسیک عمدتاً در مردان چینی، ژاپنی، ویتنامی، فیلیپینی و کرهای[۲] و به میزان قابلتوجهی در تایلندیها بروز پیدا میکند،[۵] و همچنین با نرخ بسیار پایینتری در سایر اقوام هم رخ میدهد.[۲] ۱٫۸ تا ۱٫۹ درصد افراد چینی و ژاپنیِ مبتلا به پرکاری تیروئید، دچار بیماری فلج دورهای تیروتوکسیک میشوند. این موضوع در آمریکای شمالی صدق نمیکند و مطالعات میزان ۰٫۱ تا ۰٫۲ درصد را گزارش میکنند.[۲][۳] بومیان آمریکایی که دارای شباهت ژنتیکی با آسیاییهای شرقی هستند، در معرض خطر بیشتری قرار دارند.[۲]
سن شروع بیماری بهطور معمول بین ۲۰ تا ۴۰ سالگی برآورد میشود. مشخص نیست چرا مردان بیشتر تحت تأثیر این بیماری قرار میگیرند و میزان این بیماری در مردان ۱۷ تا ۷۰ برابر زنان است، علیرغم اینکه پرکاری تیروئید در زنان بسیار شایعتر است.[۲][۳]
تاریخچه[ویرایش]

پس از چندین مورد گزارش در قرنهای ۱۸ و ۱۹، متخصص مغز و اعصاب آلمانی کارل فردریش اوتو وستفال (۱۸۳۳–۱۸۹۰) در سال ۱۸۸۵ برای نخستین بار فلج دورهای را شرح داد.[۷][۸] در سال ۱۹۲۶، پزشک ژاپنی تتسوشیرو شینوساکی[ث]، اهل فوکوئوکا دریافت که بیماری تیروئید در ژاپنیهای مبتلا به فلج دورهای زیادتر است.[۹][۱۰] اولین گزارش انگلیسی زبان، در سال ۱۹۳۱، توسط دانلاپ و کپلر، پزشکان مؤسسهٔ مایو کلینیک تهیه شد. آنان این اختلال را در فردی که نشانههای بیماری گریوز را داشت، توصیف کردند.[۳][۱۰] در سال ۱۹۳۷ مشخص گردید که فلج دورهای، با هیپوکالمی در ارتباط است و علائم آن با گلوکز و انسولین، تسریع میشود.[۱۱][۱۲] این پدیده به عنوان یک آزمایش تشخیصی مورد استفاده قرار گرفتهاست.[۱۲]
در سال ۱۹۷۴ معلوم گردید که پروپرانولول میتواند از حملات جلوگیری کند.[۱۳] مفهوم کانالوپاتیها و ارتباط با جهشهای کانال یونی خاص در پایان سده بیستم میلادی پدیدار شد.[۲][۵][۶]
یادداشتها[ویرایش]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ ۱٫۵ ۱٫۶ ۱٫۷ Lin SH (January 2005). "Thyrotoxic periodic paralysis". Mayo Clinic Proceedings. 80 (1): 99–105. doi:10.4065/80.1.99. PMID 15667036. Archived from the original (PDF) on 27 April 2020. Retrieved 17 September 2021.
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ ۲٫۱۱ ۲٫۱۲ ۲٫۱۳ ۲٫۱۴ ۲٫۱۵ ۲٫۱۶ ۲٫۱۷ ۲٫۱۸ ۲٫۱۹ Kung AW (July 2006). "Clinical review: Thyrotoxic periodic paralysis: a diagnostic challenge". The Journal of Clinical Endocrinology and Metabolism. 91 (7): 2490–5. doi:10.1210/jc.2006-0356. PMID 16608889. Archived from the original on 13 December 2009. Retrieved 4 September 2021.
- ↑ ۳٫۰۰ ۳٫۰۱ ۳٫۰۲ ۳٫۰۳ ۳٫۰۴ ۳٫۰۵ ۳٫۰۶ ۳٫۰۷ ۳٫۰۸ ۳٫۰۹ Pothiwala, Pooja; Levine, Steven N. (March 2010). "Analytic review: thyrotoxic periodic paralysis: a review". Journal of Intensive Care Medicine. 25 (2): 71–77. doi:10.1177/0885066609358849. ISSN 1525-1489. PMID 20089526.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ Weetman, A. P. (2000-10-26). "Graves' disease". The New England Journal of Medicine. 343 (17): 1236–1248. doi:10.1056/NEJM200010263431707. ISSN 0028-4793. PMID 11071676.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ ۵٫۳ Ryan, Devon P.; Ptácek, Louis J. (2010-10-21). "Episodic neurological channelopathies". Neuron. 68 (2): 282–292. doi:10.1016/j.neuron.2010.10.008. ISSN 1097-4199. PMID 20955935.
- ↑ ۶٫۰ ۶٫۱ Fontaine, Bertrand (2008). "Periodic paralysis". Advances in Genetics. 63: 3–23. doi:10.1016/S0065-2660(08)01001-8. ISSN 0065-2660. PMID 19185183.
- ↑ Westphal CF (1885). "Über einen merkwürdigen Fall von periodischer Lähmung aller vier Extremitäten mit gleichzeitigem Erlöschen der elektrischen Erregbarkeit während der Lähmung (in German)". Berl. Klin. Wochenschr. 22: 489–91 and 509–11.
- ↑ Weber F, Lehmann-Horn F (28 April 2009). Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (eds.). "Hypokalemic Periodic Paralysis". GeneReviews. PMID 20301512. Archived from the original on 18 January 2017. Retrieved 17 September 2021.
- ↑ Shinosaki, Tetsushiro (1926-12-01). "Klinische studien über die periodische extremitätenlähmung (in German)". Zeitschrift für die gesamte Neurologie und Psychiatrie. 100 (1): 564–611. doi:10.1007/BF02970940. ISSN 0303-4194.
- ↑ ۱۰٫۰ ۱۰٫۱ DUNLAP, HAROLD F.; KEPLER, EDWIN J. (November 1931). "A SYNDROME RESEMBLING FAMILIAL PERIODIC PARALYSIS OCCURRING IN THE COURSE OF EXOPHTHALMIC GOITER". Endocrinology. 15 (6): 541–546. doi:10.1210/endo-15-6-541. ISSN 0013-7227.
- ↑ Aitken RS, Allott EN, Castleden LI, Walker M (1937). "Observations on a case of familial periodic paralysis". Clin. Sci. 3: 47–57.
- ↑ ۱۲٫۰ ۱۲٫۱ McFadzean, A. J.; Yeung, R. (1967-02-25). "Periodic paralysis complicating thyrotoxicosis in Chinese". British Medical Journal. 1 (5538): 451–455. doi:10.1136/bmj.1.5538.451. ISSN 0007-1447. PMC 1840834. PMID 6017520.
- ↑ Yeung, R. T.; Tse, T. F. (October 1974). "Thyrotoxic periodic paralysis. Effect of propranolol". The American Journal of Medicine. 57 (4): 584–590. doi:10.1016/0002-9343(74)90010-2. ISSN 0002-9343. PMID 4432863.


 French
French Deutsch
Deutsch