گاهشمار توبروز اسکلروزیس - ویکیپدیا، دانشنامهٔ آزاد

گاهشمار توبروز اسکلروزیس (انگلیسی: Timeline of tuberous sclerosis) گاهشمار وقایع مرتبط با بیماری توبروز اسکلروزیس (TSC) است که تاریخچهٔ پژوهشهای مرتبط به آن کمتر از ۲۰۰ سال عمر دارد. این بیماری، یک اختلال ژنتیکی نادر و چند سیستمی است که میتواند سبب ایجاد تومورهای خوشخیم در مغز و سایر اعضای حیاتی بدن همچون کلیه، قلب، چشم، ریهها و پوست شود. مجموعهای از علائم، از جمله حمله صرع، کمتوانی ذهنی، مشکلات رفتاری، ناهنجاریهای پوستی و بیماریهای کلیه و ریه در این بیماری دیده میشوند. توبروز اسکلروزیس در اثر جهش در یکی از دو ژن TSC1 یا TSC2 ایجاد میشود که بهترتیب پروتئینهای هامارتین و توبرین را کدگذاری میکنند. این پروتئینها سرکوبگر تومور هستند و تکثیر و تمایز سلولی را تنظیم و کنترل میکنند.[۱] این ژنها و پروتئینها در آغاز، شگرفههای نادر آسیبشناسی بودند، اما امروزه کانون تمرکز پژوهشی در زمینه چگونگی تشکیل و سرکوب تومور هستند.
تاریخچه پژوهش در زمینه توبروز اسکلروزیس به چهار دوره تقسیم میشود.[۲] در اواخر سده نوزدهم میلادی، پزشکان برجستهٔ شاغل در بیمارستانهای آموزشی اروپا، ابتدا علامات و نشانههای مغزی و پوستی جداگانهای را شرح دادند. برخی از نشانههای بیماری به افتخار این پزشکان نامگذاری شدهاند، مثل «بیماری بورنویل»[۳] و «آدنوم پرینگل».[۴] در آغاز سده بیستم میلادی، پژوهشگران دریافتند که این علائم و نشانهها، همگی مربوط به یک بیماری واحد هستند. همچنین درگیری اعضا و احشای دیگر نیز مشخص شد و پزشکان فهمیدند که شدت و حدت بیماری و علائمش بسیار متفاوت است. در اواخر سده بیستم میلادی، پیشرفتهای شگرفی در روشهای تصویربرداری عصبی حاصل شد و دو ژن ایجادکنندهٔ بیماری نیز کشف شدند. سرانجام با آغاز سده بیست و یکم میلادی، پژوهشگران درک بهتری از بیماری در سطح مولکولی یافتند و درمانهای غیرجراحی بالقوهای برای این بیماری مطرح شد.
سده نوزدهم[ویرایش]
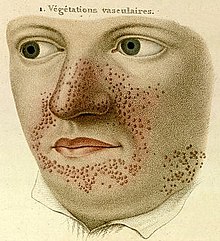
- ۱۸۳۵
- متخصص پوست فرانسوی پییر فرانسوا اولیو رِیه کتاب مصوری از بیماریهای پوستی منتشر کرد. این کتاب دارای ۲۲ لوح گراور و ۵۰۰ عکس از اختلالات فراگیر پوستی بود. عکس اول در صفحهٔ ۲۰ کتاب، تصویری بود که نخستین توصیف از توبروز اسکلروزیس محسوب میشود.[۵] عنوان این عکس «رویشهای عروقی»[الف] بود و مؤلف کتاب دربارهٔ آنها نوشته بود «عروق کوچک به شکل سفتدانه، با رشد گسترده بر روی بینی و اطراف دهان».[۶] هیچ اشارهای به بیماری ایجادکننده این ضایعات پوستی نشده بود.
- ۱۸۵۰
- دو متخصص پوست انگلیسی با نامهای توماس آدیسون و ویلیام گال در بیمارستان گایز بیماری یک دختر ۴ ساله را که دارای «جوشهای پوستی عجیب بر روی بینی و تا حدی گونهها» بود شرح دادند و نامش را «ویتیلیگویدا توبروزا» نهادند.[۷]
- ۱۸۶۲
- فیزیولوژیست آلمانی فریدریش دانیل فون رکلینگهاوزن که دستیار رودلف ویرشو در «مؤسسهٔ آسیبشناسی تشریحی برلین» بود،[۸] به معرفی یک نمونه بیماری در «انجمن زنان و زایمان» شهر پرداخت.[۹] قلب نوزادی که بلافاصله پس از چندین نفس اولِ زندگی، فوت نمود، دارای چندین تومور بود. او این تومورها را «میوماتا» نام نهاد که یکی از آنها به اندازهٔ تخم کبوتر بود.[۷] وی همچنین متوجه شد که مغز نوزاد، «تعداد فراوانی اسکلروز (تصلب) دارد».[۵] این یافته به احتمال قریب به یقین رابدومیوم قلبی و تصلبهای تکمهای قشر مغز بودند که در توبروز اسکلروزیس دیده میشود. البته او نفهمید که این یافتهها مربوط به یک بیماری خاص است و آن را یک یافتهٔ عجیب تشریحی-آسیبشناسی دانست.[۱۰] در عوض، بعدها نام فون رکلینگهاوزن به دنبال نگارش مقالهای در سال ۱۸۸۱ میلادی با بیماری نوروفیبروماتوز گره خورد.[۸]
- ۱۸۶۴
- آسیبشناس آلمانی رودلف ویرشو یک اثر سه جلدی دربارهٔ تومورها منتشر کرد که در آن کودکی را شرح داد که دچار تصلبهای تکمهای مغز و رابدومیوم قلب بود. این توصیف، در برگیرندهٔ نخستین ظن پزشکی به این موضوع بود که ممکن است این عارضه مربوط به یک بیماری ارثی باشد. خواهر این کودک نیز در اثر تومور مغزی درگذشته بود.[۱۱]
- ۱۸۸۰
- نام عصبشناس فرانسوی دزیره مگلوآر بورنِـویل که بهطور تصادفی با این بیماری برخورد داشت، بر آن ماندگار شد. در آن هنگام، او به عنوان دستیار غیررسمی ژان-مارتن شارکو در بیمارستان پیتی-سالپترییر کار میکرد.[۱۰] یک روز که بهجای استادش لویی دولاسیووْ کشیک میداد، بر بالین دختری ۱۵ ساله به نام ماری حاضر شد که دچار عقبماندگی حرکتی-روانی، صرع و «جوشهای عروقی، برجسته و بههم ملحقشونده بر روی بینی، گونهها و پیشانی» بود. این دختر از نوزادی سابقه تشنج داشت و در سن ۱۳ سالگی به بیمارستان کودکان برده شد و در آنجا گفته بودند که امیدی به درمانش نیست. او دچار مشکلات یادگیری بود و قادر به راه رفتن و حرف زدن هم نبود. هنگامی که ماری تحت مراقبت و درمان بورنِـویل بود، تعداد تشنجهایش بهشدت افزایش یافت و بهصورت انبوه رخ میداد. ماری را با شراب کینکینا، برومید کافور، آمیل نیتریت و قراردادن زالو در پشت گوشهایش، تحت درمان قرار دادند. ماری در ۷ مه ۱۸۷۹ در بیمارستان درگذشت. پس از کالبدگشایی، معلوم شد تکمههای سفت و سختی در مغز وجود دارد که بورنِـویل نامشان را «تصلبهای تکمهای چینهای مغز» نهاد. او گفت که اینها دلیل روی دادن صرعهای این دختر بودند. علاوه بر اینها، تودههای سفید و سختی «به اندازه یک گردو» در هر دو کلیهٔ او مشاهده شد.[۱۲]
- ۱۸۸۱
- پزشک آلمانی هارتدیگن یک نوزاد ۲ روزه را شرح داد که در اثر بحران صرعی درگذشته بود. آزمایشهای پس از کالبدشکافی مشخص کرد که تومورهای کوچکی در بطنهای طرفی مغز و همچنین نواحی دچار تصلب (اسکلروز) در مغز موجود بود که نامش را «گلیوم مادرزادی سلولهای گانگلیونی مغز» نهاد.[۱۳][۱۴]

- ۱۸۸۱
- بورنِـویل و ادوار بریسو دختر ۴ سالهای را در بیمارستان بیستر معاینه کردند. همچون قبل، بیمار تکههای تصلبی مغز، صرع و مشکلات یادگیری داشت. او سوفل قلب هم داشت و بهدنبال کالبدشکافی پس از مرگ، معلوم شد که تومورهای کوچک و سختی در دیوارهٔ دستگاه بطنی قلب و تومورهای کوچکی نیز در کلیهها داشتهاست (آنژیومیولیپوما).[۱۵]
- ۱۸۸۵
- پزشکان فرانسوی فلیکس بالزر و پییر اوژن منتریه نمونهای از یک «آدنوم غدد چربی پوست صورت و سر» را توصیف کردند.[۱۶] امروزه میدانیم که این نامگذاری صحیح نیست چرا که نه آدنوم است و نه از غدد چربی پوست برمیخیزد. این راشهای برجستهٔ پوستی را امروزه «آنژیوفیبرومای پوست» مینامند.[۱۷]
- ۱۸۸۵
- متخصصان پوست فرانسوی فرانسوا آنری آلوپو و امیل لِـرِد موردی از یک آدنوم غدد چربی را منتشر کردند که ماهیتی سفت و فیبروزی داشت. آنها این پلاکهای پوستی چرمی را شرح دادند و بعدها متوجه شدند رابطهای میان آنها و صرع موجود است.[۷][۱۸]
- ۱۸۹۰
- متخصص پوست اسکاتلندی جان جیمز پرینگل که در لندن کار میکرد شرح خالی از یک زن ۲۵ ساله با بهرهٔ هوشی پائینتر از طبیعی و ضایعات پوستی سفت دستها و پاها و راشهای صورت ارائه نمود. این موضوع سبب شد تا دوباره کانون توجهها به سوی پنج گزارش قبلی جلب شود که البته دو تای آنها منتشر نشده بود.[۱۹] «آدنوم سباسئوم» پرینگل بعدها نامی برای این ضایعات پوستی شد.
سدهٔ بیستم[ویرایش]
اوایل سده[ویرایش]


- ۱۹۰۱
- پزشک ایتالیایی «جووانی باتیستا پلیتسی» دربارهٔ آسیبشناسی ضایعات مغزی تحقیق کرد. وی متوجهٔ ماهیت دیسپلاستیک آنها، دگرجایی قشر مغز[ب] و نقص در میلین شد. پلیتسی این تکمههای تصلبی را به دو گروه ۱ (با سطح صاف) و ۲ (با فرورفتگی مرکزی) تقسیمبندی کرد.[۲۰][۲۱]
- ۱۹۰۳
- پزشک آلمانی «ریشارد کوته» فیبرومهای اطراف ناخن[پ] را شرح داد که البته بعدها در سال ۱۹۳۲ میلادی، توسط پزشک هلندی «یوهانس کونن» بازکشف و تشریح شد و امروزه آن را با نام «تومورهای کونن» میشناسیم.[۲۲]
- ۱۹۰۶
- متخصص اعصاب استرالیایی آلفرد والتر کمبل که در انگلستان طبابت میکرد، گمان برد که ضایعات مغز، پوست، قلب و کلیه این بیماران همگی ناشی از یک بیماری واحد است. او همچنین ضایعاتی در چشم این بیماران را توصیف کرد. کمبل با بررسی ۲۰ گزارش قبلی از این بیماری، سه علامت تشخیصی برای این بیماری پیشنهاد نمود که امروزه ابداع آن را، به هاینریش فوگت نسبت میدهند.[۲۳]
- ۱۹۰۸
- متخصص آلمانی اعصاب کودکان هاینریش فوگت معیارهای تشخیصی توبروز اسکلروزیس را محقق کرد و قویاً راشهای پوستی صورت را با تکمههای قشر مغز مرتبط دانست.[۲۴][۲۵] معیار تشخیصی سهگانه «تشنج، نقص عقلانی شدید و آدنوم سباسئوم» به مدت ۶۰ سال پابرجا بود تا آنکه پژوهشهای مانوئل رودریگس گومس ثابت کرد که کمتر از یک سوم مبتلایان به توبروز اسکلروزیس، هر سه علامت را با هم دارند.[۵]
- ۱۹۱۰
- «یوزف کیرپیتسنیک» نخستین کسی بود که متوجه شد توبروز اسکلروزیس یک بیماری ژنتیکی است. او نمونههایی از دوقلوهای همسان و غیرهمسان مبتلا و همچنین یک خانواده را که در سه نسل متوالی گرفتار این بیماری بودند، شرح داد.[۲۶]
- ۱۹۱۱
- «ادوارد شِـرلاک»، وکیل دعاوی و مدرس زیستشناسی، ۹ مورد از «سستذهنی» را در کتابش شرح داد. او واژه «اپیلولا» را ابداع نمود که یک تکواژ چندوجهی برای اپیلپسی (صرع) و آنویا (فقدان عقل) است.[۲۷] این واژه امروزه دیگر برای توبروز اسکلروزیس بهکار نمیرود. متخصص ژنتیک «رابرت جیمز گورلین» در سال ۱۹۸۱ پیشنهاد کرد که از این واژه بهعنوان معادلی برای مجموعهٔ «صرع، کمتوانی ذهنی و آدنوم سباسئوم» استفاده شود.[۲۸]
- ۱۹۱۳
- گفته میشود که «هرمان برگ» آلمانی، نخستین کسی است که اعلام نمود توبروز اسکلروزیس ارثی است و انتقال آن را در دو یا سه نسل مورد توجه قرار داد.[۲۹]
- ۱۹۱۴
- «پ. شوستر» آلمانی یک نمونه از بیماری را گزارش کرد که صرع و آدنوم سباسئوم داشت، اما مشکل ذهنی-هوشی نداشت. این تظاهر فنوتیپی تقلیلیافته را «شکل ناهنجار»[ت] میگویند.[۳۰]
- ۱۹۱۸
- پزشک فرانسوی «رنه لوتمباشر» نخستین گزارش از بیماری کیستی ریهها را در مبتلایان به توبروز اسکلروزیس ارائه کرد. بیمار زن ۳۶ سالهای بود که در اثر پنوموتوراکس دوطرفه درگذشت. لوتمباشر فکر میکرد که این کیستها و ندولها ناشی از متاستاز تومور فیبروسارکوم کلیه است. امروزه میدانیم که این عارضه تنها در زنان رخ میدهد و نامش لنفانژیولیومیوماتوز (LAM) است.[۳۱][۳۲]
- ۱۹۲۰
- چشمپزشک هلندی یان وان دِر هوفه تومورهای هامارتوم شبکیه (فاکوما) را شرح داد. او توبروز اسکلروزیس و نوروفیبروماتوز را در دستهٔ فاکوماتوزها قرار داد (که بعدها سندرمهای عصبی-جلدی نام گرفتند).[۳۳]
- ۱۹۲۴
- «اچ. مارکوس» متوجه شد که مشخصههای ویژهٔ توبروز اسکلروزیس همچون کلسیفیکاسیونهای داخل جمجمهای، در عکسهای رادیوگرافی با اشعه ایکس قابل مشاهده است.[۳۴]
میانهٔ سده[ویرایش]
- ۱۹۳۲
- مکدانلد کریچلی و «چارلز جی.سی. ارل» ۲۹ بیمار بستری در یک بیمارستان روانپزشکی را بررسی کردند. آنها رفتارهایی همچون حرکات غیرعادی دستها، نگرشهای نامأنوس و غریب و حرکات تکرارشونده را شرح دادند که امروزه به آنها علائم اوتیسمی می گویند. با این حال، ۱۱ سال گذشت تا لیو کَـنر واژه «اوتیسم» را پیشنهاد داد. او همچنین متوجه نقاط سفیدرنگی در پوست شد (ماکولهای هایپوملانیک).[۳۵]
- ۱۹۳۴
- برکویتس و ریگلر ثابت کردند که میتوان از روش «پرتونگاری مغز بعد از تزریق هوا یا گاز بداخل بطنهای آن» (پنوموآنسفالوگرافی) برای تشخیص ندولهای غیرکلسیفیه تحتاپاندیمی استفاده کرد و توبروز اسکلروزیس را تشخیص داد. این شبیه به «اشک موم بر روی یک شمع روشن» است که در بطنهای جانبی مغز قابل مشاهده است.[۳۶]
- ۱۹۴۲
- «سیلوان ئی مولتن» عنوان «کمپلکس توبروز اسکلروزیس» را پیشنهاد داد که امروزه نام ترجیحی بیماری است و ماهیت چندعضوی این بیماری را نشان میدهد. مولتن برای توصیف آسیبشناسی آن سه واژه ابداع کرد: ضایعهٔ اصلی «هامارتیال» است که یا تبدیل به ضایعهای شبه تومور (هامارتوم) میشود یا آنکه به یک ضایعهٔ سرطانی حقیقی (هامارتوبلاستوما) مبدل میشود.[۳۷]
- ۱۹۵۴
- آسیبشناس نروژی «ریدار ایکر» نژادی از موش صحرایی قهوهای را پرورش داد که مستعد ابتلا به آدنوم کلیه بود. این گونه موش تبدیل به نمونهٔ مهمی از وراثت اتوزومال غالب سرطانها شد.[۳۸]
- ۱۹۶۶
- دو جراح مغز و اعصاب با نامهای «فانور پرو» و «برایس ویر» یک روش جراحی برای درمان صرعِ ناشی از توبروز اسکلروزیس ابداع کردند. از هفت بیماری که با این روش جراحی شدند (برداشتن تکمههای قسر مغز)، ۲ نفر بهکلی از صرع رهایی یافتند. پیش از این، تنها ۴ نفر بهمنظور درمان صرع توبروز اسکلروزیس، تحت عمل جراحی قرار گرفته بودند.[۳۹]
- ۱۹۶۷
- «خورخه کُلوما لاگوس» و مانوئل رودریگس گومس ۷۱ نمونه از بیماران مبتلا به توبروز اسکلروزیس را بررسی کردند و دریافتند که ۳۸٪ آنها هوش طبیعی دارند.[۱۳][۴۰]
- ۱۹۷۱
- متخصص ژنتیک آمریکایی آلفرد جی. نادسون فرضیه دو ضربهای[ث] خود را برای توضیح علت تشکیل تومور شبکیه در کودکان و بزرگسالان تکوین نمود. کودکان مبتلا، یک جهش مادرزادی در سلولهای زایا داشتند که با اضافه شدن یک جهش سوماتیک در اوایل زندگی، دچار این تومور میشدند. این مدل به بسیاری از بیماریهای دیگر که ژن سرکوبگر تومور را در برمیگیرند (همچون توبروز اسکلروزیس) قابل تعمیم است.[۴۱] در دههٔ ۱۹۸۰ میلادی، پژوهشهای نادسون بر روی «موشهای ایکر» صحت این فرضیه را قوت بخشید.[۴۲]
- ۱۹۷۵
- «جوزپه پامپیلیونه» و «ادوارد پیو» در نامهای به مجلهٔ لنست اعلام کردند که ۶۹٪ نوزادان مبتلا به توبروز اسکلروزیس دچار «اسپاسمهای صرعی نوزادی» هستند.[۴۳]
- ۱۹۷۵
- «یورگن فردیناند ریمان» برای نخستین بار از سونوگرافی برای بررسی کلیههای متأثر از توبروز اسکلروزیس در زنی ۳۵ ساله استفاده کرد که به نارسایی کلیوی مزمن مبتلا بود.[۴۴]
اواخر سده[ویرایش]


- ۱۹۷۶
- معلوم شد که سیتی اسکن مغزی (که در سال ۱۹۷۲ ابداع شده بود) یک وسیلهٔ تشخیصی عالی برای یافتن تومورهای مغزی کودکان است، از جمله آنهایی که در بیماری توبروز اسکلروزیس دیده میشود.[۴۵]
- ۱۹۷۷
- اَن مرسی هانت و همکارانش «انجمن توبروز اسکلروزیس»[ج] را در بریتانیا پایهگذاری کردند که خودیاری و بودجه برای پژوهش فراهم مینمود.[۴۶]
- ۱۹۷۹
- مانوئل گومس یک تکنگاشت تحت عنوان «توبروز اسکلروزیس» منتشر کرد که بهمدت ۲ دهه و طی ۳ ویرایش، کتاب جامع استاندارد این بیماری شد. این کتاب برای نخستین بار، توصیف جامعی از علائم بالینی بیماری ارائه میکرد و معیارهای تشخیصی جدیدی بنا نهاد که جایگزین علائم سهگانه فوگت شد.[۱۳][۴۷]
- ۱۹۸۲
- متخصص پوست آمریکایی «کنث آلفرد آرنت» با موفقیت آنژیوفیرومای صورت را با استفاده از لیزر آرگون درمان نمود.[۴۸]
- ۱۹۸۳
- برشنگاری با گسیل پوزیترون (که در سال ۱۹۸۱ اختراع شده بود) با نوار مغزی و سیتی اسکن مقایسه شد و مشخص گردید که قادر است تا محل تکمههای تصلبی صرعزا را در قشر مغز هویدا سازد که قابل تشخیص با روشهای دیگر نبود.[۴۹]
- ۱۹۸۵
- امآرآی (که در سال ۱۹۸۰ اختراع شده بود) برای نخستین بار در تشخیص نواحی مغزی مبتلا به توبروز اسکلروزیس در یک دختر مبتلا به این بیماری استفاده شد.[۵۱]
- ۱۹۸۷
- معلوم شد که امآرآی حساسیت و اختصاصیت بیشتری نسبت به سیتیاسکن دارد. در یک مطالعه بر روی ۱۵ بیمار، امآرآی توانست در ۱۲ بیمار، ندولهای تحتاپاندیمی را که به درون بطنهای جانبی رشد کرده بود، تغییر ساختاری قشر مخ در ۱۰ بیمار (که با تکمههای تصلبی مطابقت داشت) و گشادشدگی بطنهای مغزی را در ۵ بیمار تشخیص دهد و یک تومور آستروسیتوم اثباتشدهٔ قبلی را از ندولهای تحتاپاندیمی در یک بیمار تمیز دهد.[۵۲]
- ۱۹۸۷
- مشخص شد که امآرآی قادر است شدت بیماری را پیشبینی کند (صرع و تأخیر تکاملی). در یک پژوهش بر روی ۲۵ بیمار، ثابت شد که رابطهای میان تعداد تکمههای قشر مغز و شدت بیماری وجود دارد. در مقابل، سیتیاسکن پیشبینیکنندهٔ مفیدی نیست، اما نسبت به امآرآی در تشخیص ندولهای کلسیفیه برتری دارد.[۵۳]
- ۱۹۸۷
- تحلیل پیوستگی ژنتیکی در ۱۹ خانوادهٔ مبتلا به توبروز اسکلروزیس، مکان احتمالی یک ژن بیماری را بر روی کروموزوم ۹ نشان داد.[۵۴]
- ۱۹۸۸
- در مطالعهای بر روی ۶ کودک مبتلا به این بیماری، مشخص شد تکمههای قشری که در امآرآی یافت میشود، دقیقاً همان کانونهای پُربسامد نوار مغزی هستند. بهویژه تکمههای لوب پیشانی، با بروز تشنجهای سخت و دیردرمان مرتبط هستند.[۵۵]
- ۱۹۹۰
- معلوم گردید که ویگاباترین، یک داروی بسیار مؤثر ضد صرع در درمان «اسپاسمهای صرعی نوزادی» در کودکان مبتلا به توبروز اسکلروزیس است.[۵۶] پس از کشف عارضهٔ جانبی «محدودیت میدان بینایی» ناشی از این دارو در سال ۱۹۹۷ میلادی، درمان تکدارویی ویگاباترین امروزه تنها محدود به این بیماران خاص است.[۵۷]
- ۱۹۹۲
- تحلیل پیوستگی ژنتیکی، یک ژن دیگر را در بازوی کوتاه کروموزوم ۱۶ نشان داد که احتمالاً در نزدیکی ژن پلیسیستین ۱ (عامل ایجاد «بیماری کلیه پلیکیستیک نوع ۱») قرار داشت.[۵۸]
- ۱۹۹۳
- «کنسرسیوم اروپایی کروموزم ۱۶ توبروز اسکلروزیس» اعلام کرد که موفق به نسخهبرداری و تعیین ژن TSC2 شدهاند که پروتئین «توبرین» را میسازد.[۵۹]
- ۱۹۹۴
- معلوم شد که موش ایکر، مدل حیوانی مناسبی برای توبروز اسکلروزیس است چرا که دارای جهشی است که معادل ژن TSC2 است.[۶۰]
- ۱۹۹۵
- ثابت شد که برای تشخیص تکمههای کوچک تصلبی مغز، بهویژه آنهایی که تحت قشری هستند، روش تصویربرداری فِـلِـیر[چ] در امآرآی، به مراتب بهتر از روش استاندارد تی ۲[ح] است.[۶۱][۶۲]
- ۱۹۹۷
- کنسرسیوم TSC1 اعلام نمود که توانسته ژن TSC1 را نسخهبرداری و تعیین نماید. این ژن پروتئین «هامارتین» را میسازد.[۶۳]
- ۱۹۹۷
- پژوهشگران کشف کردند که ژن پلیسیستین ۱ که سبب بروز بیماری کلیه پلیکیستیک نوع ۱ میشود و ژن TSC2 در مجاورت هم بر روی بازوی کوتاه کروموزوم ۱۶ هستند. تیمی مستقر در «مؤسسهٔ ژنتیک پزشکی» در ولز ۲۷ بیمار غیر خویشاوند مبتلا به توبروز اسکلروزیس و بیماری کیستی کلیه را بررسی کردند. آنها متوجه شدند که بیماری شدید کلیوی در کسانی که مبتلا به توبروز اسکلروزیس هستند در اثر حذف مجاورتی این دو ژن روی میدهد. آنها همچنین دریافتند که بیماری اینها شدیدتر و زودهنگامتر از بیماری کلیه پلیکیستیک نوع ۱ رخ میدهد و بیمارانی که دارای ژن TSC1 هستند، اصلاً دچار بیماری کیستی شدید نمیشوند.[۶۴]
- ۱۹۹۷
- «پاتریک بولتون» و «پال گریفیث» ۱۸ بیمار مبتلا به توبروز اسکلروزیس را بررسی کردند که نیمیشان اوتیسم داشتند. آنها رابطه مستحکمی میان تکمههای لوب گیجگاهی و ابتلا به اوتیسم یافتند.[۶۵]
- ۱۹۹۸
- کنفرانس اجماع برای توبروز اسکلروزیس، معیارهای تشخیصی بازنگریشدهای برای توبروز اسکلروزیس را منتشر کردند.[۶۶]
- ۱۹۹۸
- یک تیم ایتالیایی از مگنتوانسفالوگرافی[خ] برای بررسی سه بیمار مبتلا به توبروز اسکلروزیس و صرع پارشیال استفاده کردند. در ترکیب با امآرآی، آنها توانستند رابطهٔ میان نواحی تکمهای مغز، اختلالات کارکردی عصبی و نواحی صرعزا را پیدا کنند.[۶۷] پژوهشهای بعدی ثابت کرد که مگنتوانسفالوگرافی نسبت به نوار مغزی، در تشخیص تکمههای تشنجزا (که میتوانند نامزد جراحی و برش باشند) بهتر است.[۶۸]
سده بیست و یکم[ویرایش]

- ۲۰۰۱
- یک مطالعه همگروهی چندکانونی بر روی ۲۲۴ بیمار انجام شد تا جهش ژنی و شدت بیماری بررسی شود. افرادی که ژن TSC1 داشتند، شدت بیماریشان کمتر از آنهایی که بود ژن TSC2 داشتند. میزان بروز تشنج و کمتوانی ذهنی هم در افراد دارای TSC1 کمتر بود. برخی از علائم توبروز اسکلروزیس نیز در آنها وجود نداشت یا نادر بود. نتیجه آنکه جهش در سلولهای زایا و سوماتیک در TSC1 ناشایعتر از TSC2 است.[۶۹]
- ۲۰۰۲
- چند گروه پژوهشی تحقیق نمودند که چگونه محصولات ژنهای TSC1 و TSC2 (توبرین و هامارتین) به کمک یکدیگر، مسیر پیامرسانی سلولی mTOR را مهار میکنند. این مسیر مهم، تنظیمکنندهٔ تکثیر سلول و سرکوب تومور است.[۷۰]
- ۲۰۰۲
- معلوم گشت که درمان با راپامایسین سیرولیموس، اندازهٔ تومور در موشهای ایکر (ژن TSC2)[۷۱] و موشهای مبتلا به توبروز اسکلروزیس (TSC1)[۷۲] را کاهش میدهد.
- ۲۰۰۶
- نتایج کارآزماییهای بالینی محدود نشان داد که راپامایسین قادر به کوچک کردن تومور آنژیومیولیپوما[۷۳] و آستروسیتوم[۷۴] است. چندین کارآزمایی بالینی بزرگ شروع شد که در آنها، لنفانژیولیومیوماتوز (LAM)[۷۵] و آنژیومیولیپوم کلیه (AML)[۷۶] با راپامایسین و همچنین آستروسیتوم سلول غولآسا با یکی از مشتقات راپامایسین به نام اورولیمس درمان شد.[۷۷]
- ۲۰۱۲
- یک کنفراس برای اجماعیابی برگزار و معیارهای جدید تشخیص و مدیریت توبروز اسکلروزیس تعیین و منتشر شد.[۷۸][۷۹]
واژهنامه[ویرایش]
منابع[ویرایش]
- ↑ "Tuberous Sclerosis Fact Sheet". NINDS. 11 April 2006. Archived from the original on 21 January 2007. Retrieved 9 January 2007.
- ↑ Rott (2005), page 2 - Introduction.
- ↑ Enersen, Ole Daniel. "Désiré-Magloire Bourneville". Who Named It?. Archived from the original on 11 November 2018. Retrieved 30 April 2007.
- ↑ Enersen, Ole Daniel. "John James Pringle". Who Named It?. Archived from the original on 11 November 2018. Retrieved 30 April 2007.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ Curatolo (2003), chapter: "Historical Background".
- ↑ Rayer, Pierre François (1835). Traité des maladies de la peau / atlas (به فرانسوی). Paris: J.B. Baillière. p. 20. Archived from the original on 26 September 2007. Retrieved 9 December 2006.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ Jay V (2004). "Tuberous sclerosis". Pediatric and Developmental Pathology. 2 (2): 197–8. doi:10.1007/s100249900110. PMID 9949228. S2CID 72130332.
- ↑ ۸٫۰ ۸٫۱ Enersen, Ole Daniel. "Friedrich Daniel von Recklinghausen". Who Named It?. Archived from the original on 16 November 2018. Retrieved 10 December 2006.
- ↑ von Recklinghausen F (1862). "Ein Herz von einem Neugeborene welches mehrere theils nach aussen, theils nach den Höhlen prominirende Tumoren (Myomen) trug". Monatschr Geburtsheilkd (به آلمانی). 20: 1–2.(As cited in Curatolo (2003))
- ↑ ۱۰٫۰ ۱۰٫۱ Jansen FE, van Nieuwenhuizen O, van Huffelen AC (May 2004). "Tuberous sclerosis complex and its founders". Journal of Neurology, Neurosurgery, and Psychiatry. 75 (5): 770. doi:10.1136/jnnp.2003.027524. PMC 1763558. PMID 15090576.
- ↑ Virchow R (July 1863). Die Krankhaften Geschwülste. Vol II. Berlin: August Hirschwald. p. 148.(As cited in Acierno (1994))
- ↑ Bourneville D (1880). "Sclérose tubéreuse des circonvolutions cérébrales: Idiotie et épilepsie hemiplégique". Archives de Neurologie (به فرانسوی). 1: 81–9l. Archived from the original on 25 February 2012. Retrieved 22 August 2009.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ Sancak, Özgür (2005). Tuberous Sclerosis Complex: Mutations, Functions and Phenotypes. Stichting Tubereuze Sclerose Nederland. pp. 11–2. ISBN 978-90-902019-3-1.
- ↑ Hartdegen A (February 1881). "Ein Fall von multipler Verhärtung des Grosshirns nebst histologisch eigenartigen harten Geschwülsten der Seitenventrikel ("Glioma gangliocellulare") bei einem Neugeborenen". European Archives of Psychiatry and Clinical Neuroscience. 11 (1): 117–31. doi:10.1007/BF02054825. S2CID 41145503.
- ↑ Bourneville D, Brissaud É (1881). "Encéphalite ou sclérose tubéreuse des circonvolutions cérébrales". Archives de Neurologie. 1: 390–412.(As cited in Curatolo (2003))
- ↑ Balzer F, Ménétrier P (1885). "Étude sur un cas d'adénomes sébacés de la face et du cuir". Archives de Physiologie Normale et Pathologique. Third Series. 6: 564–76.(As cited in Curatolo (2003))
- ↑ Sanchez NP, Wick MR, Perry HO (December 1981). "Adenoma sebaceum of Pringle: a clinicopathologic review, with a discussion of related pathologic entities". Journal of Cutaneous Pathology. 8 (6): 395–403. doi:10.1111/j.1600-0560.1981.tb01028.x. PMID 6278000.
- ↑ Hallopeau F, Leredde É (1885). "Sur un cas d'adenomes sébacés à forme sclereuse". Ann Dermatol Syph. 6: 473–9.(As cited in Curatolo (2003))
- ↑ Pringle JJ (1890). "A case of congenital adenoma sebaceum". British Journal of Dermatology. 2: 1–14. Archived from the original on 24 April 2020. Retrieved 22 August 2009.
- ↑ Pellizzi GB (1901). "Contributo allo studio dell'idiozia: rivisita sperimentale di freniatria e medicina legale delle alienazioni mentali". Riv Sper Freniat. 27: 265–9.(As cited in Curatolo (2003))
- ↑ Braffman BH, Bilaniuk LT, Naidich TP, Altman NR, Post MJ, Quencer RM, Zimmerman RA, Brody BA (April 1992). "MR imaging of tuberous sclerosis: pathogenesis of this phakomatosis, use of gadopentetate dimeglumine, and literature review". Radiology. 183 (1): 227–38. doi:10.1148/radiology.183.1.1549677. PMID 1549677.
- ↑ Kothe R (1903). "Zur Lehre der Talgdrüsengeschwülste". Archiv für Dermatologie und Syphilis (به آلمانی). 68 (3): 273–8. doi:10.1007/BF01829939. S2CID 8643541.(As cited in Rott (2005))
- ↑ Campbell AW (1906). "Cerebral sclerosis". Brain. 28 (3–4): 382–96. doi:10.1093/brain/28.3-4.367.
- ↑ Enersen, Ole Daniel. "Heinrich Vogt". Who Named It?. Archived from the original on 30 November 2018. Retrieved 11 December 2006.
- ↑ Vogt H (1908). "Zur Diagnostik der tuberösen Sklerose". Zeitschrift für die Erforschung und Behandlung des Jugendlichen Schwachsinns Auf Wissenschaftlicher Grundlage, Jena. 2: 1–16.(As cited in Curatolo (2003) and fully cited by Who Named It?)
- ↑ Kirpicznik J (1910). "Ein Fall von Tuberoser Sklerose und gleichzeitigen multiplen Nierengeschwùlsten". Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medizin (به آلمانی). 202 (3): 358–376. doi:10.1007/BF01993975. S2CID 42104267.(As cited in Curatolo (2003))
- ↑ Sherlock, Edward Birchall (1911). The Feeble-minded, A Guide to Study and Practice. Macmillan & Co.(As cited in Jay (2004))
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) Tuberous Sclerosis -191100
- ↑ Berg H (1913). "Vererbung der tuberösen Sklerose durch zwei bzw. drei Generationen". Z Ges Neurol Psychiatr (به آلمانی). 19: 528–39. doi:10.1007/BF02909909.(As cited in Curatolo (2003))
- ↑ Schuster P (1914). "Beiträge zur Klinik der tuberösen Sklerose des Gehirns". Dtsch Z Nervenheilkd (به آلمانی). 50: 96–133.(As cited in Curatolo (2003))
- ↑ Lutembacher R (1918). "Dysembryomes métatypique des reins. Carcinose submiliaire aigue du poumon avec emphysème généralisé et double pneumothorax". Annals of Medicine (به فرانسوی). 5: 435–50.(As cited in Curatolo (2003))
- ↑ Abbott GF, Rosado-de-Christenson ML, Frazier AA, Franks TJ, Pugatch RD, Galvin JR (2005). "From the archives of the AFIP: lymphangioleiomyomatosis: radiologic-pathologic correlation". Radiographics. 25 (3): 803–28. doi:10.1148/rg.253055006. PMID 15888627.
- ↑ Van der Hoeve J (1920). "Eye symptoms in tuberous sclerosis of the brain". Trans Ophthalmol Soc UK. 40: 329–34.(As cited in Curatolo (2003))
- ↑ Marcus H (1924). Svenska Làk Sallsk Forth.(As cited by Dickerson WW (1945). "Characteristic roentgenographic changes associated with tuberous sclerosis". Archives of Neurology and Psychiatry. 53 (3): 199–204. doi:10.1001/archneurpsyc.1945.02300030036005., as cited in Curatolo (2003) and Gómez (1995))
- ↑ Critchley M, Earl CJ (1932). "Tuberose sclerosis and allied conditions". Brain. 55 (3): 311–46. doi:10.1093/brain/55.3.311.
- ↑ Berkwitz NJ, Rigler LG (1934). "Tuberous sclerosis diagnosed with cerebral pneumography". Archives of Neurology and Psychiatry. 35: 833–8.(As cited in Gómez (1995))
- ↑ Moolten SE (1942). "Hamartial nature of tuberous sclerosis complex and its bearings on the tumor problem: report of a case with tumor anomaly of the kidney and adenoma sebaceum". Arch Intern Med. 69 (4): 589–623. doi:10.1001/archinte.1942.00200160040005.
- ↑ Eker R (1954). "Familial renal adenomas in Wistar rats; a preliminary report". Acta Pathologica et Microbiologica Scandinavica. 34 (6): 554–62. doi:10.1111/j.1699-0463.1954.tb00301.x. PMID 13206757.(As cited in Yeung (1994))
- ↑ Perot P, Weir B, Rasmussen T (November 1966). "Tuberous sclerosis. Surgical therapy for seizures". Archives of Neurology. 15 (5): 498–506. doi:10.1001/archneur.1966.00470170052005. PMID 5955139.(As cited in Bebin EM, Kelly PJ, Gomez MR (1993). "Surgical treatment for epilepsy in cerebral tuberous sclerosis". Epilepsia. 34 (4): 651–7. doi:10.1111/j.1528-1157.1993.tb00442.x. PMID 8330575.)
- ↑ Lagos JC, Gomez MR (January 1967). "Tuberous sclerosis: reappraisal of a clinical entity". Mayo Clinic Proceedings. 42 (1): 26–49. PMID 5297238.(As cited in Curatolo (2003))
- ↑ Knudson AG (April 1971). "Mutation and cancer: statistical study of retinoblastoma". Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 820–3. Bibcode:1971PNAS...68..820K. doi:10.1073/pnas.68.4.820. PMC 389051. PMID 5279523.(As cited in Rott (2005))
- ↑ Yeung RS (December 2004). "Lessons from the Eker rat model: from cage to bedside". Current Molecular Medicine. 4 (8): 799–806. doi:10.2174/1566524043359791. PMID 15579026.
- ↑ Pampiglione G, Pugh E (November 1975). "Letter: Infantile spasms and subsequent appearance of tuberous sclerosis syndrome". Lancet. 2 (7943): 1046. doi:10.1016/S0140-6736(75)90343-8. PMID 53537. S2CID 44703965.
- ↑ Riemann JF, Mörl M, Rott HD (June 1975). "[Chronic renal failure in bourneville-pringle's disease (author's transl)]". Medizinische Klinik (به آلمانی). 70 (26): 1128–32. PMID 1223616.(As cited in Rott (2005))
- ↑ Berger PE, Kirks DR, Gilday DL, Fitz CR, Harwood-Nash DC (July 1976). "Computed tomography in infants and children: intracranial neoplasms". AJR. American Journal of Roentgenology. 127 (1): 129–37. doi:10.2214/ajr.127.1.129. PMID 180824.
- ↑ McFarlane, Isobel (2014-07-30). "Ann Hunt obituary". The Guardian (به انگلیسی). ISSN 0261-3077. Archived from the original on 14 August 2019. Retrieved 2019-08-14.
- ↑ Gómez, Manuel R (1979). Tuberous Sclerosis (1st ed.). New York: Raven Press. ISBN 978-0-89004-313-4.(As cited in Özgür (2005))
- ↑ Arndt KA (July 1982). "Adenoma sebaceum: successful treatment with the argon laser". Plastic and Reconstructive Surgery. 70 (1): 91–3. doi:10.1097/00006534-198207000-00021. PMID 7089113.(As cited in Rott (2005))
- ↑ Szelies B, Herholz K, Heiss WD, Rackl A, Pawlik G, Wagner R, Ilsen HW, Wienhard K (December 1983). "Hypometabolic cortical lesions in tuberous sclerosis with epilepsy: demonstration by positron emission tomography". Journal of Computer Assisted Tomography. 7 (6): 946–53. doi:10.1097/00004728-198312000-00002. PMID 6415136. S2CID 40010942.(As cited in Rott (2005))
- ↑ Dulac O, Lemaitre A, Plouin P (1984). "The Bourneville syndrome: clinical and EEG features of epilepsy in the first year of life". Boll Lega Ital Epil. 45/46: 39–42.(As cited in Curatolo (2003))
- ↑ Kandt RS, Gebarski SS, Goetting MG (August 1985). "Tuberous sclerosis with cardiogenic cerebral embolism: magnetic resonance imaging". Neurology. 35 (8): 1223–5. doi:10.1212/wnl.35.8.1223. PMID 4022361. S2CID 73135293.(As cited in Rott (2005))
- ↑ McMurdo SK, Moore SG, Brant-Zawadzki M, Berg BO, Koch T, Newton TH, Edwards MS (April 1987). "MR imaging of intracranial tuberous sclerosis". AJR. American Journal of Roentgenology. 148 (4): 791–6. doi:10.2214/ajr.148.4.791. PMID 3493666.
- ↑ Roach ES, Williams DP, Laster DW (March 1987). "Magnetic resonance imaging in tuberous sclerosis". Archives of Neurology. 44 (3): 301–3. doi:10.1001/archneur.1987.00520150047020. PMID 3827681.(As cited in Curatolo (2003))
- ↑ Fryer AE, Chalmers A, Connor JM, Fraser I, Povey S, Yates AD, Yates JR, Osborne JP (March 1987). "Evidence that the gene for tuberous sclerosis is on chromosome 9". Lancet. 1 (8534): 659–61. doi:10.1016/S0140-6736(87)90416-8. PMID 2882085. S2CID 46007790.
- ↑ Curatolo P, Cusmai R (September 1988). "[Magnetic resonance imaging in Bourneville's disease: relation to the EEG]". Neurophysiologie Clinique = Clinical Neurophysiology (به فرانسوی). 18 (5): 459–67. doi:10.1016/s0987-7053(88)80056-x. PMID 3185465. S2CID 53192058.(As cited in Curatolo (2003))
- ↑ Chiron C, Dulac O, Luna D, Palacios L, Mondragon S, Beaumont D, Mumford JP (February 1990). "Vigabatrin in infantile spasms". Lancet. 335 (8685): 363–4. doi:10.1016/0140-6736(90)90660-W. PMID 1967808. S2CID 30019639.
- ↑ Vigabatrin Paediatric Advisory Group (May 2000). "Guideline for prescribing vigabatrin in children has been revised. Vigabatrin Paediatric Advisory Group". BMJ. 320 (7246): 1404–5. doi:10.1136/bmj.320.7246.1404. PMC 1118061. PMID 10858057.
- ↑ Kandt RS, Haines JL, Smith M, Northrup H, Gardner RJ, Short MP, Dumars K, Roach ES, Steingold S, Wall S (September 1992). "Linkage of an important gene locus for tuberous sclerosis to a chromosome 16 marker for polycystic kidney disease". Nature Genetics. 2 (1): 37–41. doi:10.1038/ng0992-37. PMID 1303246. S2CID 37460974. Archived from the original on 31 December 2018. Retrieved 29 March 2021.
- ↑ European Chromosome 16 Tuberous Sclerosis Consortium (December 1993). "Identification and characterization of the tuberous sclerosis gene on chromosome 16". Cell. 75 (7): 1305–15. doi:10.1016/0092-8674(93)90618-Z. PMID 8269512. S2CID 29476292.(As cited in Rott (2005))
- ↑ Yeung RS, Xiao GH, Jin F, Lee WC, Testa JR, Knudson AG (November 1994). "Predisposition to renal carcinoma in the Eker rat is determined by germ-line mutation of the tuberous sclerosis 2 (TSC2) gene". Proceedings of the National Academy of Sciences of the United States of America. 91 (24): 11413–6. Bibcode:1994PNAS...9111413Y. doi:10.1073/pnas.91.24.11413. PMC 45241. PMID 7972075.
- ↑ Maeda M, Tartaro A, Matsuda T, Ishii Y (1995). "Cortical and subcortical tubers in tuberous sclerosis and FLAIR sequence". Journal of Computer Assisted Tomography. 19 (4): 660–1. doi:10.1097/00004728-199507000-00033. PMID 7622707.
- ↑ Takanashi J, Sugita K, Fujii K, Niimi H (October 1995). "MR evaluation of tuberous sclerosis: increased sensitivity with fluid-attenuated inversion recovery and relation to severity of seizures and mental retardation". AJNR. American Journal of Neuroradiology. 16 (9): 1923–8. PMID 8693996. Archived from the original on 27 September 2011. Retrieved 29 March 2021.
- ↑ van Slegtenhorst M, de Hoogt R, Hermans C, Nellist M, Janssen B, Verhoef S, et al. (August 1997). "Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34". Science. 277 (5327): 805–8. doi:10.1126/science.277.5327.805. PMID 9242607.
- ↑ Sampson JR, Maheshwar MM, Aspinwall R, Thompson P, Cheadle JP, Ravine D, Roy S, Haan E, Bernstein J, Harris PC (October 1997). "Renal cystic disease in tuberous sclerosis: role of the polycystic kidney disease 1 gene". American Journal of Human Genetics. 61 (4): 843–51. doi:10.1086/514888. PMC 1716004. PMID 9382094.
- ↑ Bolton PF, Griffiths PD (February 1997). "Association of tuberous sclerosis of temporal lobes with autism and atypical autism". Lancet. 349 (9049): 392–5. doi:10.1016/S0140-6736(97)80012-8. PMID 9033466. S2CID 37260017.
- ↑ Roach ES, Gomez MR, Northrup H (December 1998). "Tuberous sclerosis complex consensus conference: revised clinical diagnostic criteria". Journal of Child Neurology. 13 (12): 624–8. doi:10.1177/088307389801301206. PMID 9881533. S2CID 22310240.
- ↑ Peresson M, Lopez L, Narici L, Curatolo P (October 1998). "Magnetic source imaging and reactivity to rhythmical stimulation in tuberous sclerosis". Brain & Development. 20 (7): 512–8. doi:10.1016/S0387-7604(98)00034-5. PMID 9840671. S2CID 38974140.
- ↑ Jansen FE, Huiskamp G, van Huffelen AC, Bourez-Swart M, Boere E, Gebbink T, Vincken KL, van Nieuwenhuizen O (January 2006). "Identification of the epileptogenic tuber in patients with tuberous sclerosis: a comparison of high-resolution EEG and MEG". Epilepsia. 47 (1): 108–14. doi:10.1111/j.1528-1167.2006.00373.x. PMID 16417538. Archived from the original on 2012-12-17.
- ↑ Dabora SL, Jozwiak S, Franz DN, Roberts PS, Nieto A, Chung J, Choy YS, Reeve MP, Thiele E, Egelhoff JC, Kasprzyk-Obara J, Domanska-Pakiela D, Kwiatkowski DJ (January 2001). "Mutational analysis in a cohort of 224 tuberous sclerosis patients indicates increased severity of TSC2, compared with TSC1, disease in multiple organs". American Journal of Human Genetics. 68 (1): 64–80. doi:10.1086/316951. PMC 1234935. PMID 11112665.
- ↑ Tee AR, Fingar DC, Manning BD, Kwiatkowski DJ, Cantley LC, Blenis J (October 2002). "Tuberous sclerosis complex-1 and -2 gene products function together to inhibit mammalian target of rapamycin (mTOR)-mediated downstream signaling". Proceedings of the National Academy of Sciences of the United States of America. 99 (21): 13571–6. Bibcode:2002PNAS...9913571T. doi:10.1073/pnas.202476899. PMC 129715. PMID 12271141.
- ↑ Kenerson HL, Aicher LD, True LD, Yeung RS (October 2002). "Activated mammalian target of rapamycin pathway in the pathogenesis of tuberous sclerosis complex renal tumors". Cancer Research. 62 (20): 5645–50. PMID 12384518. Archived from the original on 3 June 2007. Retrieved 29 March 2021.
- ↑ Kwiatkowski DJ, Zhang H, Bandura JL, Heiberger KM, Glogauer M, el-Hashemite N, Onda H (March 2002). "A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, and up-regulation of p70S6 kinase activity in Tsc1 null cells". Human Molecular Genetics. 11 (5): 525–34. doi:10.1093/hmg/11.5.525. PMID 11875047. Archived from the original on 13 February 2006. Retrieved 29 March 2021.
- ↑ Wienecke R, Fackler I, Linsenmaier U, Mayer K, Licht T, Kretzler M (September 2006). "Antitumoral activity of rapamycin in renal angiomyolipoma associated with tuberous sclerosis complex". American Journal of Kidney Diseases. 48 (3): e27-9. doi:10.1053/j.ajkd.2006.05.018. PMID 16931204.
- ↑ Franz DN, Leonard J, Tudor C, Chuck G, Care M, Sethuraman G, Dinopoulos A, Thomas G, Crone KR (March 2006). "Rapamycin causes regression of astrocytomas in tuberous sclerosis complex". Annals of Neurology. 59 (3): 490–8. doi:10.1002/ana.20784. PMID 16453317. S2CID 20466190. Archived from the original on 2012-12-17.
- ↑ "Multicenter International Lymphangioleiomyomatosis Efficacy of Sirolimus Trial (The MILES Trial)". ClinicalTrials.gov (NIH). 6 January 2007. Archived from the original on 4 January 2019. Retrieved 10 January 2007.
- ↑ "Sirolimus in Treating Patients With Angiomyolipoma of the Kidney". ClinicalTrials.gov (NIH). 21 November 2006. Archived from the original on 4 January 2019. Retrieved 10 January 2007.
- ↑ "Everolimus (RAD001) Therapy of Giant Cell Astrocytoma in Patients With Tuberous Sclerosis Complex". ClinicalTrials.gov (NIH). 13 December 2006. Archived from the original on 4 January 2019. Retrieved 10 January 2007.
- ↑ Krueger DA, Northrup H (October 2013). "Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference". Pediatric Neurology. 49 (4): 255–65. doi:10.1016/j.pediatrneurol.2013.08.002. PMC 4058297. PMID 24053983.
- ↑ Northrup H, Krueger DA (October 2013). "Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference". Pediatric Neurology. 49 (4): 243–54. doi:10.1016/j.pediatrneurol.2013.08.001. PMC 4080684. PMID 24053982.


 French
French Deutsch
Deutsch