Einsteinium — Wikipédia
| Einsteinium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
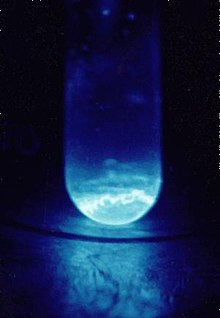 Tube de quartz (diamètre : 9 mm) contenant environ 300 µg d'einsteinium 253. La lumière produite est le résultat de intense émission de particules alpha issues de sa désintégration. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 99 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 7e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Actinide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Rn] 5f11 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 32, 29, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 252 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 6,42 eV | 2e : 12,0 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 8,840 g·cm-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | cubique à faces centrées[1] ou Hexagonal[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Blanche argentée | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 859,85 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioélément à activité notable | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'einsteinium (symbole Es) est l'élément chimique de numéro atomique 99, ainsi nommé en l'honneur d'Albert Einstein[5]. C'est un élément transuranien de la famille des actinides, radioactif et synthétique.

Propriétés[modifier | modifier le code]
Dans les conditions normales de température et de pression, le corps simple est un métal blanc argenté, de structure cristalline cubique à faces centrées. Sa température de fusion est de 860 °C[6]. Il forme différents composés avec l'oxygène et les halogènes : Es2O3, EsF3, EsF4, EsCl3, EsBr3, EsI3 et EsOCl.
L'einsteinium a été découvert en 1952 par Albert Ghiorso sous la forme de son isotope 253, récupéré dans les débris résultant d'une explosion thermonucléaire. Il est produit en bombardant des actinides plus légers avec des neutrons. Plus particulièrement, on obtient de faibles quantités d'einsteinium 253 en bombardant des atomes de plutonium 239 avec des neutrons thermiques :
Comme pour tous les éléments synthétiques, les isotopes de l’einsteinium sont tous extrêmement radioactifs et doivent être considérés comme hautement dangereux pour la santé par ingestion. Le moins instable est 252Es avec une demi-vie d'environ 471,7 jours.
Selon une étude parue en 2021 dans la revue Nature[7], une équipe du laboratoire national Lawrence-Berkeley réussit à créer environ 200 ng de l'isotope 254Es et étudier sa longueur de liaison ainsi que les comportements spécifiques d’émission, non observés jusqu’alors avec d’autres actinides de numéro atomique inférieur[8].
Historique[modifier | modifier le code]
L'einsteinium a été découvert en 1952 en même temps que le fermium lors de l'explosion thermonucléaire Mike. Les travaux autour de l'einsteinium n'ont été déclassifiés et publiés dans la littérature scientifique qu'en 1955[9].
Le symbole de l'einsteinium n'a pas toujours été Es, il a d'abord été E[10].
Composés[modifier | modifier le code]

On connaît différents composés de l'einsteinium avec l'oxygène et les halogènes (Es2O3, EsF3, EsF4, EsCl3, EsBr3, EsI3 et EsOCl), ainsi qu'un complexe organique[11],[12].
Isotopes[modifier | modifier le code]
Dix-neuf isotopes sont connus, de masse atomique 240 à 258, plus trois isomères. Le moins instable est 252Es avec une demi-vie d'environ 471,7 jours.
Dans la fiction[modifier | modifier le code]
L'einsteinium est utilisé dans le jeu Singularity sous l'ancienne dénomination E. Il aurait été découvert par les soviétiques en 1952 sur l'île fictive Katorga 12.
L'einsteinium est un des minéraux du jeu vidéo Motherload. Il se présente sous la forme de polygones gris-bleu. Assez curieusement, il n'a pas l'air radioactif, puisqu'il est même utilisé comme coque de bonne qualité. Il se vend plutôt cher, à mi-chemin entre le prix du platine et de l'émeraude.
Notes et références[modifier | modifier le code]
- (en) R. G. Haire et R. D. Baybarz, « Studies of einsteinium metal », Journal de Physique Colloques, vol. 40, no C4, , p. 101-102 (DOI 10.1051/jphyscol:1979431, lire en ligne)
- (en) R. G. Haire, « Preparation, properties, and some recent studies of the actinide metals », Journal of the Less Common Metals, vol. 121, , p. 379-398 (DOI 10.1016/0022-5088(86)90554-0, lire en ligne)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Description de l'einsteinium sur webelements.com, consulté le 04/02/2015
- (en) « Einsteinium - EniG. Tableau périodique des éléments » (consulté le )
- (en) Korey P. Carter et al., « Structural and spectroscopic characterization of an einsteinium complex », sur Nature, (consulté le )
- Fleur Brosseau, « Des scientifiques effectuent les toutes premières mesures sur l’einsteinium ! », sur Trust My Science, (consulté le )
- (de) Siegfried Flügge, Handbuch der Physik, vol. 42, p. 283.
- (en) Modern Alchemy: Selected Papers of Glenn T. Seaborg, vol. 2, Hackensack, New Jersey, World Scientific Publishing Company, , p. 6.
- (en) Johanna L. Miller, « Einsteinium chemistry captured », Physics Today, vol. 74, no 4, , p. 14 (DOI 10.1063/PT.3.4717).
- .(en) Korey P. Carter, Katherine M. Shield, Kurt F. Smith, Zachary R. Jones, Jennifer N. Wacker et al., « Structural and spectroscopic characterization of an einsteinium complex », Nature, vol. 590, , p. 85-88 (DOI 10.1038/s41586-020-03179-3)
Voir aussi[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) « Technical data for Einsteinium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |


 French
French Deutsch
Deutsch