Hypophosphite de sodium — Wikipédia
| Hypophosphite de sodium | |
 | |
| Identification | |
|---|---|
| Nom UICPA | hypophosphite de sodium |
| No CAS | (monohydrate |
| No ECHA | 100.028.791 |
| No RTECS | SZ5640000 (monohydrate) |
| PubChem | 16129646 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche[1] |
| Propriétés chimiques | |
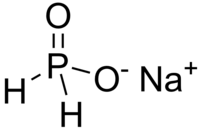
| Formule | NaPO2H2 |
| Masse molaire[2] | 87,978 2 ± 0,000 7 g/mol H 2,29 %, Na 26,13 %, O 36,37 %, P 35,21 %, |
| Propriétés physiques | |
| T° fusion | 310 °C (décomp., monohydrate)[3] |
| Solubilité | eau : 744 g·l-1 à 20 °C[1], soluble dans l'éthanol[4] |
| Masse volumique | 1,77 g·cm-3[1] |
| Écotoxicologie | |
| DL50 | 7640 mg·kg−1 (rat, oral)[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L'hypophosphite de sodium ou phosphinate de sodium, NaPO2H2, est le sel de sodium de l'acide hypophosphoreux et est souvent rencontré sous forme mono-hydratée, NaPO2H2.H2O. C'est un solide à la température ambiante apparaissant sous forme de cristaux blancs, il est sans odeur et soluble dans l'eau. Il absorbe facilement l'humidité de l'air.
Il est obtenu à partir de la réaction du phosphore avec de la soude caustique et de la chaux.[réf. souhaitée]
L'hypophosphite de sodium doit être conservé dans un endroit frais et loin de toutes substances oxydantes, il se décompose en phosphine, un gaz toxique et en hydrogénophosphate de sodium.
- 2 NaH2PO2 → PH3 + Na2HPO4
Utilisation[modifier | modifier le code]
L'hypophosphite de sodium est utilisé principalement dans le nickelage électrolytique (Ni-P)[6] qui consiste en un dépôt électrolytique de solutions aqueuses de différents sels sur un matériau pour en améliorer ses diverses qualités.
Celui-ci est capable de réduire les ions nickel présents en solution en nickel métallique[7].
Il est également utilisé comme agent de blanchiment ainsi que comme catalyseurs dans l'industrie de la fibre de verre.
Notes et références[modifier | modifier le code]
- Entrée « Natriumphosphinat » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 mars 2016 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- William M. Haynes, CRC Handbook of Chemistry and Physics, 96e édition, CRC Press, 2015, p.91. (ISBN 978-1-4822-6097-7), page sur googlebook.
- (de) « Natriumphosphinat », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Fiche Sigma-Aldrich du composé Sodium hypophosphite monohydrate, ≥99%, consultée le 9 mars 2016. + (pdf) fiche SDS.
- L. M. Abrantes, « On the Mechanism of Electroless Ni-P Plating », Journal of the Electrochemical Society, vol. 141, no 9, , p. 2356 (DOI 10.1149/1.2055125)
- D. Rich & M. Smith, Electroless Deposition of Nickel, Cobalt and Iron, IBM Corp (1971)


 French
French Deutsch
Deutsch