Rougeole — Wikipédia
| Causes | Virus de la rougeole (Genre Morbillivirus / Famille Paramyxoviridae) |
|---|---|
| Transmission | Transmission aéroportée (d) |
| Incubation min | 6 j ou 7 j |
| Incubation max | 19 j ou 21 j |
| Symptômes | Fièvre, toux, rhinorrhée, éruption maculopapuleuse (en), adénopathie, anorexie, diarrhée, Signe de Köplik, conjonctivite et catarrhe oculo-nasal (d) |
| Prévention | Vaccination |
|---|---|
| Traitement | Soins de support (d) |
| Spécialité | Infectiologie |
| CISP-2 | A71 |
|---|---|
| CIM-10 | B05 |
| CIM-9 | 055 |
| DiseasesDB | 7890 |
| MedlinePlus | 001569 |
| eMedicine | 966220 emerg/389ped/1388 |
| MeSH | D008457 |
| Patient UK | Measles-pro |
La rougeole (également appelée parfois première maladie[1],[2]) est une infection virale éruptive aiguë. Elle atteint essentiellement les enfants à partir de l’âge de 5-6 mois et les jeunes adultes[3]. La vaccination contre la rougeole vise surtout à éviter les complications de l'infection, comme les encéphalites qui peuvent avoir des séquelles importantes voire létales, et à prévenir un affaiblissement immunitaire lié à la maladie.
Histoire[modifier | modifier le code]
Origines[modifier | modifier le code]
Pour persister durablement (assurer une chaîne continue de transmission), une maladie infectieuse a besoin d'une population humaine minimum. Dans le cas de la rougeole, on estime qu'il faut au moins une population vierge (non immunisée) de 250 000 à 500 000 individus ayant des interactions fréquentes, typiquement des habitants d'un territoire relativement restreint. Une telle densité humaine n'a été atteinte qu'autour de 2 500 ans avant J.-C., par les premières civilisations urbaines de Mésopotamie[4],[5].
Il est aujourd'hui admis, par des études phylogénétiques, que le virus de la rougeole correspond à l’adaptation à l’espèce humaine du virus de la peste bovine, officiellement éradiquée de la planète en 2011[6]. La datation de cette divergence est discutée : vers le XIe siècle apr. J.-C.[5], ou dès le VIe siècle av. J.-C. selon une étude récente[7].
Dans les textes médicaux de l'Antiquité gréco-romaine, comme ceux de l'Antiquité chinoise, on ne retrouve pas de mention précise d'une maladie évoquant la rougeole. La maladie est considérée comme absente du bassin méditerranéen dans l'Antiquité[8].

La première description de la rougeole est attribuée à Rhazès, médecin persan du Xe siècle, dans son fameux traité, daté de 910, où il la distingue de la variole. Avicenne précise ces différences vers l'an 1000, en distinguant aussi une « rougeole atténuée », qui sera interprétée plus tard comme étant en fait une rubéole[4].
Au Moyen Âge, la rougeole est désignée sous le terme latin de « morbilli », diminutif de « morbus », ou « petite maladie ». Ce terme recouvre des aspects similaires de plusieurs maladies éruptives de façon plus ou moins confuse (variole, lèpre, scarlatine...). Il reste employé dans le français médical moderne « morbilliforme » (qui ressemble à l'éruption de la rougeole)[9].
Les épidémies de rougeole suivent les épidémies de variole chez les Amérindiens lors des conquêtes espagnoles (chute de l'Empire aztèque ; conquête de l'Empire inca en 1530 et 1531)[4].
Temps modernes[modifier | modifier le code]
Les premières descriptions modernes d'épidémies de rougeole (1670, 1674) sont celles de l'anglais Thomas Sydenham, qui les rassemble dans On the Measles, de ses œuvres complètes publiées en 1692. Il officialise le terme « measles » venant de l'anglais médiéval « mesles » du latin « misella », diminutif de « miser » (misère)[4].
En 1758, le médecin écossais Francis Home (en) démontre le caractère contagieux de la maladie, et tente d'obtenir une prévention en appliquant un principe analogue à la variolisation en utilisant du sang de rougeoleux.
Au XIXe siècle, de grandes épidémies de rougeole chez les autochtones sont décrites lors de l'occupation de régions insulaires : les Iles Féroé (1846), Hawaï (1848), les îles Fidji (1876), les îles Samoa (1911), ainsi que le sud du Groenland en 1951. Ces populations insulaires ou isolées étaient non-immunisées par absence de rougeole (population vierge ou « naïve »). La rougeole frappe alors plus de 9 personnes sur 10 avec une forte mortalité pouvant aller jusqu'à 20 à 25 % de la population : Hawaï en 1848, les Fidji en 1876[4].
En Europe des épidémies sévirent en 1840, 1860 et 1880.
La description clinique, précise et complète, de la rougeole, avec ses différentes complications, est achevée au tournant du XXe siècle. En 1896, Henry Koplik décrit le signe de Koplik, signe précoce caractéristique de la rougeole.
La nature virale de la maladie est démontrée en 1911 par John F. Anderson (en) et Joseph Goldberger. La culture cellulaire du virus est réalisée à partir de 1938. Le virus est isolé en 1954 par John Enders, qui en obtient une souche atténuée en 1958.
Le premier vaccin vivant atténué contre la rougeole est homologué aux États-Unis en 1963, et en 1974, l'OMS introduit la vaccination contre la rougeole dans son programme élargi de vaccination.
Virus de la rougeole[modifier | modifier le code]

Le virus de la rougeole est un morbillivirus de la famille des Paramyxoviridae. Il appartient à la même famille que le virus des oreillons. C’est un virus strictement humain, dont l'unique réservoir naturel est l'homme (la personne atteinte de l'infection, même asymptomatique). Il peut aussi infecter le singe, mais dans des conditions de laboratoire[10],[11].
C'est un virus à ARN monocaténaire anti-messager non segmenté, enveloppé, avec une capside hélicoïdale. Sa taille varie entre 120 et 250 nm.
Ce virus est rapidement inactivé par la chaleur (30 minutes à 56 °C) ou la lumière ultraviolette. Il est en outre sensible à de nombreux désinfectants (alcool à 70 % par exemple).
En 2017, on lui connait 24 génotypes différents, identifiés par séquençage de l'ARN. Cela permet de distinguer l'origine géographique d'une souche virale, de suivre sa transmission, sa diffusion et son élimination, lors des études épidémiologiques[10].
Sa structure antigénique est particulièrement stable, et ne comporte qu'un seul type, ce qui facilite l'efficacité vaccinale[10].
Transmission et contagiosité[modifier | modifier le code]
Le virus de la rougeole se transmet directement par voie aérienne en bioaérosol (gouttelettes de salive en suspension dans l'air). Il se propage également par contact direct avec les sécrétions du nez ou de la gorge de personnes infectées. Le virus ainsi éjecté reste dangereux au moins trente minutes et jusqu'à près de deux heures, en milieu aérien fermé (comme celui d'un cabinet médical)[12], ou sur les objets et les surfaces[13].
La période de propagation du virus commence deux à six jours avant l'apparition de l'éruption cutanée. L'installation du virus dans l'organisme se fait au cours de la période d'incubation. Le virus est présent dans les sécrétions respiratoires dès la fin de l'incubation, jusqu'au cinquième jour après l'éruption[11]. Le risque de transmission diminue à partir du deuxième jour suivant l'apparition de l'éruption.
On sait depuis le XIXe siècle que cette maladie est « hautement contagieuse »[14]. La période de contagiosité débute cinq jours avant et dure jusqu'à cinq jours après l'éruption. Le taux de reproduction de la rougeole (calcul du nombre moyen d'individus qu'une personne infectée peut contaminer tant qu'elle sera contagieuse) dans une population non-immunisée est estimé entre 12 et 18, ce qui en fait l'une des plus contagieuses[11].
Signes cliniques et évolution[modifier | modifier le code]
La rougeole se caractérise par quatre phases : incubation silencieuse, invasion avec catarrhe fébrile, éruption dite morbilliforme, suivie d'une desquamation avec état de fatigue persistant.
La maladie est apparente dans 90 % des cas. Les formes asymptomatiques (sans symptômes) et les réinfections sont rares. La première phase correspond à une période d'incubation silencieuse d'une durée moyenne d'un peu plus de douze jours[15] (dix à quatorze jours)[11].
Forme commune et habituelle[modifier | modifier le code]
Phase d'invasion[modifier | modifier le code]
C'est la seconde phase qui dure de deux à quatre jours. L'enfant est atteint d'une fièvre rapidement progressive, jusqu'à 39,5 - 40 °C, avec malaise général et maux de tête.
Il présente un catarrhe (inflammation avec écoulements) oculorespiratoire : conjonctivite et yeux larmoyants, rhinite et écoulement nasal, toux… L'enfant est très irritable, présentant un faciès « grognon ». Ce catarrhe diffus des muqueuses doit être présent à ce stade pour évoquer un diagnostic de rougeole[16].
L'atteinte des muqueuses digestives est fréquente avec diarrhées, douleurs abdominales et vomissements. Des signes neurologiques sont possibles (convulsions, syndrome méningé)[11].
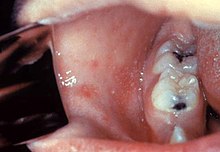
Pendant l'invasion, le sujet est contagieux. Le signe de Köplik apparaît vers la 36e heure après le début du catarrhe et jusqu'à la phase éruptive, de façon inconstante (70 % des cas)[17]. Il est fugace, souvent présent moins de 24 heures. Il consiste en l'apparition sur la muqueuse buccale, à la hauteur des prémolaires inférieures, de petites taches rouges irrégulières avec un petit point central blanc.
Cet énanthème, décrit par Henry Koplik en 1896, est pathognomonique de la maladie, lorsqu'il est présent.
Phase éruptive[modifier | modifier le code]

L'éruption de la rougeole est caractéristique. Elle se fait en une seule poussée. Elle débute au niveau de la tête, derrière les oreilles, autour de la bouche, puis s'étend à toute la face. Son extension est descendante en trois à quatre jours : elle atteint le cou, les épaules, et la partie supérieure du thorax. Au 3e jour, le tronc et les membres supérieurs sont atteints. L'éruption s'étend à l'abdomen puis aux membres inférieurs à partir du 4e jour. Une atteinte de la paume des mains et de la plante des pieds est présente dans 20 à 50 % des cas[11].
Il s'agit d'un exanthème consistant en l'apparition progressive de petites plaques (rouges sur les peaux blanches) plus ou moins en relief, de quelques millimètres de diamètre, dites maculopapules (faites de macules et de papules), sans ou avec peu de démangeaisons et s'effaçant à la pression[11].
Ces petites plaques rouges confluent en larges plages arrondies, avec des contours irréguliers, mais en laissant toujours entre elles des intervalles de peau saine.
Sur peau noire, l'éruption donne un aspect de peau granitée et œdémateuse[18].
La fièvre, d'abord élevée, diminue progressivement jusqu'au troisième ou quatrième jour de l'éruption (retour à la normale).
Phase de desquamation[modifier | modifier le code]
Durant la quatrième et dernière phase, l'éruption cutanée laisse, avant de s'effacer, une coloration brune tirant sur le cuivre. Elle peut faire place, de façon inconstante, à une desquamation fine visible quelques jours[16]. La fièvre a disparu, mais la convalescence dure encore une dizaine de jours durant lesquels l'enfant, souvent fatigué, peut tousser.
Autres formes[modifier | modifier le code]
L'enfant d'une femme enceinte atteinte par la rougeole pendant la grossesse peut présenter une rougeole dite congénitale si l'éruption est présente dès la naissance ou postnatale si elle survient dans les 10 premiers jours de vie[19]. La prévention de la rougeole du nouveau-né repose sur l'administration d'immunoglobulines polyvalentes dans les 6 jours après une exposition de la femme enceinte non immunisée contre la maladie à un cas de rougeole [20].
Des rougeoles atténuées et atypiques peuvent se voir chez des sujets vaccinés (ou des nourrissons possédant encore des anticorps maternels à faibles taux[21]), avec catarrhe discret et exanthème peu net. L'éruption débute aux extrémités et épargne la tête[11].
Les formes de l'adolescent et de l'adulte sont plus graves que celles de l'enfant, à cause de la plus grande fréquence des complications pulmonaires et hépatiques[21].
Les formes malignes sont exceptionnelles en France. D'évolution fatale, elles se manifestent par une insuffisance respiratoire aiguë, des complications neurologiques graves, et des troubles de la coagulation[11].
Diagnostic[modifier | modifier le code]
Diagnostic positif[modifier | modifier le code]
Il est essentiellement clinique. Il se base sur la notion de contage (cas déjà connus dans l'entourage), l'absence ou l'insuffisance de vaccination, la présence du catarrhe et du signe de Koplik, et les caractères de l'exanthème (débutant au niveau de la tête, et descendant en une seule poussée)[22].
Dans les cas douteux, la sérologie peut confirmer le diagnostic par la présence d'anticorps de type IgM spécifiques qui apparaissent lors de l'éruption. Une sérologie négative dans les trois premiers jours de l'éruption ne permet pas d'éliminer le diagnostic. Ces IgM spécifiques peuvent être retrouvés dans la salive entre la première et la sixième semaine qui suit le début de la maladie[23].
La présence d'immunoglobuline G spécifique aide au diagnostic lorsque 2 prélèvements espacés de 10 jours (entre la phase aiguë et la convalescence) montrent une ascension significative (multiplication par quatre)[23], sinon leur simple présence indique seulement que la personne a déjà été au contact du virus morbilleux (soit par infection ancienne, soit par vaccination).
Les techniques de PCR peuvent confirmer le diagnostic par prélèvement des sécrétions oculorespiratoires, du sang et de la salive, jusqu'au 5e jour après le début de l'éruption[23]. L'isolement du virus est possible, ainsi que sa caractérisation génétique, permettant une identification de la souche responsable dans un but épidémiologique.
Diagnostic différentiel[modifier | modifier le code]
C'est d'abord celui des exanthèmes morbilliformes : la rougeole doit être distinguée de la rubéole, le mégalérythème épidémique, la mononucléose infectieuse, infections à entérovirus, à adénovirus... Puis celui d'autres érythèmes : roséole infantile, scarlatine, Kawasaki, ou encore d'une éruption d'origine médicamenteuse.
Complications[modifier | modifier le code]
Les complications de la rougeole peuvent être de quatre ordres : respiratoire, neurologique, digestif et oculaire.
Dans les pays développés, chez l'enfant, les complications les plus fréquentes sont l'otite moyenne aiguë (7-9 % des cas), la diarrhée 8 %, et la pneumonie 1 à 6 %[24].
Surinfections bactériennes[modifier | modifier le code]
Elles sont causées surtout par des streptocoques (Streptococcus pneumoniae et S. pyogenes), staphylocoque doré, et Haemophilus influenzae[11]. Elles se manifestent au niveau ORL et pulmonaires, et peuvent être à l'origine de détresse respiratoires. Historiquement, avant l'ère des antibiotiques, elles étaient la première cause de mortalité de la rougeole. Elles restent toujours responsables de près de la moitié des décès par pneumonies au cours de la rougeole[25].
Complications neurologiques[modifier | modifier le code]
La plus fréquente est l’encéphalite aiguë post-éruptive ou post-infectieuse qui survient trois à dix jours après l’éruption, dans un cas pour mille[26]. Elle n'est pas due à une multiplication du virus dans le cerveau, mais elle s'explique probablement par un mécanisme auto-immun[27]. Son taux de mortalité est de 10 %.
L'encéphalite à inclusion survient chez les patients immunodéprimés, deux à six mois après l'infection.
La panencéphalite sclérosante subaiguë survient en moyenne huit ans (neuf mois à quinze ans) après l'infection aiguë, dans un cas pour 10 000 à 25 000 enfants[11] ou 100 000[24]. Elle se caractérise par une dégradation progressive des fonctions supérieures et motrices aboutissant au décès[11],[21].
Autres complications[modifier | modifier le code]
La pneumonie dite interstitielle à cellules géantes (par fusion des cellules infectées) se voit chez les enfants ayant un déficit immunitaire.
Les kérato-conjonctivites sont fréquentes et peuvent se compliquer de cécité, plus particulièrement dans les pays en voie de développement, en cas de déficit en vitamine A, avec près de 15 000 à 60 000 cas de cécités annuels dans le monde[28]. S'en rapprochent l'otite moyenne aiguë et les cas de surdité[23].
L'hépatite de la rougeole se voit surtout chez l'adulte[23].
Les formes les plus sévères de la rougeole apparaissent chez le jeune enfant souffrant de malnutrition, surtout avec déficit immunitaire ou en vitamine A. D'autre part, la rougeole conduit fréquemment à la malnutrition par ses manifestations digestives (diarrhées, vomissements...)[16]. Dans les pays en développement, la mortalité de la rougeole est de l'ordre de 1 à 15 % (selon la malnutrition et l'accès aux soins)[17].
Rougeole et immunité[modifier | modifier le code]
Certaines études scientifiques montrent une association entre risque d'atopie plus faible et rougeole dans l'enfance, ce qui suggère que l'infection pourrait avoir un effet protecteur contre les allergies[29],[30],[31]. D'autres études ne retrouvent pas d'effet protecteur de la rougeole dans l'enfance contre le risque d'atopie[32],[33],[34], voire trouvent un effet protecteur de la vaccination[34],[35]. Le lien de causalité n'est pas établi et les différences observées entre les études pourraient être liées à d'autres facteurs[35].
Selon une étude épidémiologique de 2015, le virus de la rougeole réinitialise le système immunitaire en « effaçant » toutes les immunités acquises par l'organisme au préalable. Il affaiblirait donc de façon importante le système immunitaire de l'enfant qui, durant environ 2 ans, redevient plus vulnérable à d'autres infections contre lesquelles il était protégé avant la crise de rougeole, c'est pourquoi la vaccination contre la rougeole pourrait améliorer aussi la résistance de l'enfant à plusieurs autres maladies[36].
Le virus de la rougeole peut tuer les cellules qui fabriquent des anticorps et affaiblir le système immunitaire pendant plusieurs années selon de nouveaux travaux de 2019[37],[38].
Traitement de la rougeole[modifier | modifier le code]
Traitement[modifier | modifier le code]
Un patient atteint de rougeole doit être isolé, en raison de la forte contagiosité[39].
Le traitement de la rougeole est uniquement symptomatique : en 2021, aucun traitement antiviral n'a prouvé son efficacité contre les formes sévères ou non de rougeole[40].
Le plus souvent, on donnera au patient de quoi soulager les différents symptômes, comme la toux, les démangeaisons ou la fièvre... avec, selon les cas, un soutien nutritionnel et une réhydratation. En cas de surinfection bactérienne (comme lors d'une pneumonie), un antibiotique adapté est alors donné[39].
L'OMS préconise l'administration d'au moins deux doses de vitamine A orale, à 24 h d'intervalle chez tout enfant atteint de rougeole, afin de prévenir les complications oculaires (cécité) et réduire la mortalité[39],[41]. Aux États-Unis, l'Académie américaine de pédiatrie recommande la vitamine A chez tout enfant hospitalisé pour rougeole grave[17].
Prévention[modifier | modifier le code]
En France, la rougeole est une maladie à déclaration obligatoire depuis 2005. L'éviction scolaire est préconisée jusqu'à 5 jours après le début de l'éruption[23].
Vaccination[modifier | modifier le code]
Les vaccins utilisés contre la rougeole sont des vaccins vivants à virus atténué dont la virulence est diminuée par l'apparition de mutations inactivant les gènes de virulence.
Avant 1963, le monde était parcouru de vagues épidémiques de rougeole tuant environ 2,6 millions de personnes par an, en moyenne[42]. La découverte d'un vaccin, en 1963, permet désormais d'éviter cette maladie, et d'espérer l'éradiquer un jour (l'OMS estime que c'est possible)[43]. Selon une estimation rapportée par l'OMS, la diffusion à grande échelle du vaccin a permis d'éviter 20,4 millions de décès entre 2000 et 2016[42].
Sur le plan de la prévention, la vaccination contre la rougeole est obligatoire en France, chez les enfants depuis le [44] : une première dose du vaccin contre la rougeole à l'âge de 12 mois (ou 9 mois en cas de vie en collectivité). Le vaccin obligatoire, appelé « ROR », protège également contre deux autres maladies, la rubéole et les oreillons (c’est ce qu’on appelle un vaccin trivalent). Une deuxième dose de ce vaccin doit être faite en France entre 13 mois et 24 mois (ou entre 12 et 15 mois en cas de vie en collectivité). Cette deuxième dose n'est pas un rappel, l'immunité obtenue après une première dose étant de longue durée. Elle constitue un rattrapage pour les enfants n'ayant pas séroconverti contre la rougeole, la rubéole ou les oreillons après la première injection. En effet, une vaccination à une seule dose entraîne une immunité chez 90 à 95 % des personnes, tandis que deux doses permettent d'obtenir une immunité chez plus de 98 % des personnes vaccinées[45].
La durée d'immunité est largement supérieure à plusieurs décennies, et probablement au-delà, le calcul étant fondé sur la mesure de la persistance des immunoglobulines spécifiques[46].
Le vaccin est en règle générale bien toléré, avec moins de 5 % de fièvre et quelques cas de rashs cutanés[26]. Il peut exister des cas rares de diminution transitoire du nombre de plaquettes sanguines[47].
Prévention post-exposition[modifier | modifier le code]
L'administration d'une dose de vaccin, dans les 72 heures qui suivent un contact avec un cas, peut éviter la survenue de la maladie. Elle reste préconisée même si ce délai est dépassé (efficacité d'autant plus réduite, mais toujours utile). Cela concerne les personnes potentiellement réceptives (pas encore, non ou mal vaccinées) comme les enfants âgés de 6 à 11 mois, personne née après 1980 et non à jour, professionnel de santé ou de l'enfance non vacciné deux doses ou sans antécédent de rougeole[23],[20].
Pour les sujets présentant des contre-indications, ou ne pouvant être vaccinés, la prévention se fait par immunoglobulines humaines (principalement IgG) dans les 6 jours après un contact. C'est le cas pour les nourrissons âgés de moins de 6 mois nés de mère non immune, ceux de 6 à 11 mois non encore vaccinés ainsi que les personnes à risque de rougeole grave (femme enceinte, immunodéprimés)[23],[39].
Épidémiologie[modifier | modifier le code]
Modalités[modifier | modifier le code]
Le nouveau-né est relativement protégé du fait de la transmission des anticorps maternels[48], lesquels déclinent en quelques mois, ces derniers étant à des niveaux plus élevés si la mère a attrapé naturellement la rougeole plutôt que si elle a été vaccinée[49]. Cette protection maternelle peut donc varier selon les pays et les contextes et elle est importante à évaluer pour déterminer l'âge de la première vaccination contre la rougeole[50].
L'âge moyen auquel on contracte la rougeole dépend de l'immunité de la population, du taux de natalité, et de facteurs biologiques et environnementaux. Dans les pays en développement où le taux de couverture vaccinale est faible et chez les enfants des pays industrialisés d'avant la vaccination, la majorité des rougeoles surviennent chez le petit enfant, souvent avant l'âge de 2 ans[16].
La maladie est d'autant plus grave avant l'âge de 3 ans, avec un risque de complication plus élevé chez les jeunes adultes. La gravité de la rougeole est aussi liée au milieu social, d'autant plus grave en milieu précaire : promiscuité, malnutrition en particulier la carence en vitamine A, immunodéficiences comme celle du SIDA[24].
Lorsque la couverture vaccinale augmente, l'âge moyen se déplace vers les adolescents et jeunes adultes, en raison de la moindre circulation du virus et de leur l'absence ou insuffisance d'immunisation (par défaut de vaccination ou de contact avec le virus durant leur enfance)[43].
Si la couverture vaccinale progresse en restant insuffisante, on observe une période de déclin, dite «de lune de miel» où la maladie parait en voie d'élimination (faible circulation du virus), mais une population vulnérable (tranches d'âge non ou pas assez vaccinées) s'accumule jusqu'à entraîner un rebond épidémique[51].
La forte contagiosité de la rougeole, alors même que l'efficacité vaccinale d'une dose est de 95 %, explique la nécessite d'une couverture vaccinale très élevée (plus de 95 % avec deux doses) pour interrompre la chaîne de transmission dans une zone géographique donnée[52].
Ce seuil de protection collective pour la rougeole varie selon les contextes, entre 89 et 94 % de personnes vaccinées, par exemple 92-95 % pour les États-Unis. Cette couverture vaccinale (moyenne au niveau national) ne doit pas comporter de lacunes, elle doit être au moins de 80 % au niveau de chaque district[24] (troisième niveau d'administration selon l'OMS, soit l'équivalent du niveau départemental en France). Faute de quoi, le virus continue de circuler dans les communautés non ou insuffisamment vaccinées.
Période prévaccinale[modifier | modifier le code]
Dans les pays tempérés, à l'ère prévaccinale, les épidémies étaient saisonnières, plus fréquentes en hiver et au printemps[51] ; dans les pays tropicaux, les cas de rougeole surviennent le plus souvent en saison sèche[43].

Au début du XXe siècle, en France, la rougeole était la première cause de mortalité infantile par infection, plus que la diphtérie, la scarlatine et la coqueluche réunies. Les victimes sont surtout les très jeunes enfants de moins de trois ans[53].
À la veille de l'introduction du vaccin, les épidémies de rougeole en France survenaient tous les trois ans environ, touchant de 300 000 à 500 000 sujets par an, soit de façon quasi-inéluctable pour tous les enfants, la mortalité annuelle par rougeole ayant déjà chuté jusqu'à 15-30 cas par an vers 1980[51].
Cette baisse de la mortalité (et non de la morbidité, nombre de malades) dans les pays développés est attribuée à de meilleures conditions de vie (nutrition, habitat, diminution de la promiscuité, moins d'enfants par famille) et à l'arrivée des antibiotiques et autres progrès médicaux (traitement des surinfections pulmonaires)[54],[55].
Dans les pays en développement, au début des années 1960, la rougeole reste toujours la première cause mondiale de mortalité par infection (135 millions de cas annuels entraînant 7-8 millions de décès)[54].
En 1974, l'OMS met en place son programme élargi de vaccination en introduisant la vaccination contre la rougeole.
Impact de la vaccination (1980-2000)[modifier | modifier le code]
Perçue comme une maladie bénigne chez un sujet en bonne santé dans les pays développés, la rougeole est en fait une maladie très grave chez les enfants sous-alimentés ou vivant dans de mauvaises conditions d'hygiène : en 1980, 2 600 000 personnes dans le monde sont mortes de cette maladie[56].
Pays en développement[modifier | modifier le code]
En 1988, l'OMS estime que le programme de vaccination a permis d'éviter, pour l'année 1987, 700 000 décès par rougeole dans les pays en développement[57]. En 1997, en Afrique, le nombre de cas et de décès baisse de 40 % (1990-1997)[58].
Il reste cependant encore de très nombreux cas de rougeole, d'une part chez les enfants de moins de neuf mois[59], d'autre part en raison d'une couverture vaccinale non optimale, et de l'absence d'immunité acquise après une seule dose dans 5 % des cas. L'Afrique reste la région où l'incidence de la rougeole est la plus élevée (47,5 cas pour cent mille habitants et par an) et la couverture vaccinale la plus faible (57 % des enfants de moins de cinq ans non vaccinés contre la rougeole)[58].
Pays développés[modifier | modifier le code]
La Finlande est le premier pays à avoir éliminé la rougeole en 1993 (confirmé en 1996), avec une vaccination à deux doses dès 1982 et une couverture vaccinale de 96 % depuis 1991[52]. La comparaison des résultats avec les pays n'ayant établi qu'une vaccination à une seule dose (soit à l'âge de 2 ans, ou vers 5-6 ans, ou vers 11 ans selon les pays) conduit à introduire une deuxième dose dans ces pays.
États-Unis[modifier | modifier le code]
Aux États-Unis et dans plusieurs pays d'Amérique latine la vaccination est obligatoire avant d'aller à l'école, avec dans certains États des États-Unis, des possibilités d'exemption pour raisons religieuses ou philosophiques. La vaccination contre la rougeole se généralise à partir de 1978. Le nombre global de cas diminue de 90 % mais des épidémies persistent en raison des enfants d'âge préscolaire non vaccinés et des échecs de la vaccination (5 % des vaccinés monodose)[60].
En 1989-1991, une résurgence de rougeole se produit : les États-Unis notifient 55 000 cas et 123 décès[12]. Ils adoptent alors une stratégie à deux doses, en ciblant aussi les enfants d'âge préscolaire (une dose à l'âge de 2 ans, une seconde vers 5-6 ans). En 1994, ils notifient 958 cas de rougeole et la transmission autochtone du virus est interrompue dans les années qui suivent[60].
France[modifier | modifier le code]
En France, la vaccination contre la rougeole entre au calendrier vaccinal en 1983[61], et est obligatoire depuis 2018[62]. Une première dose de vaccin est recommandée à l'âge d'un an ; la vaccination doit être complète avant dix-huit mois[63]. La couverture vaccinale augmente régulièrement, et l'on observe une réduction des cas de rougeole à partir de 1987, de près de 400 000 cas à 44 000 cas en 1993. Cependant la couverture vaccinale stagne à 80 % dans les années 1990, avec des disparités départementales, et le virus continue de circuler.
Avec l'augmentation de la couverture vaccinale, on observe un déplacement vers un âge plus avancé, la rougeole survenant relativement plus souvent chez les adolescents et les adultes jeunes[16]. Ces changements ont conduit à des modifications de la stratégie vaccinale, dont le passage à deux doses.
Des travaux de modélisation ont montré qu'un niveau sub-optimal de couverture vaccinale contre la rougeole était propice à la future survenue de bouffées épidémiques, en confirmant la nécessité d'une stratégie de vaccinations à deux doses, en visant une couverture vaccinale d'au moins 95 %[64]. Une deuxième dose du vaccin triple (rougeole-oreillons-rubéole) a donc été introduite en France en 1996[51], remboursé par la sécurité sociale à 100 % en 1999[65].
En 2000, par rapport à la fin des années 1980, le nombre des cas et des décès par rougeole en France a été réduit de plus de 90 % : de l'ordre de 200 000 à 10 000 cas, et de 30 décès à moins de 3[66].
Épidémiologie au XXIe siècle[modifier | modifier le code]
Dans le monde[modifier | modifier le code]
Nombre de cas[modifier | modifier le code]
En 2012, l'OMS se donne pour objectif d’éliminer la rougeole dans quatre des six régions de l’OMS d’ici 2015 et dans cinq régions d’ici 2020. L’élimination de la rougeole dans une zone géographique est définie comme l'interruption de la transmission pendant au moins douze mois. Elle est considérée comme confirmée si cette interruption se maintient au moins trente-six mois[67].
Sur la période 2000-2018, l’incidence mondiale annuelle de la rougeole a diminué de 66 %, de 145 à 49 cas par million d'habitants. En 2018, le nombre de décès a été estimé à 142 300, soit une baisse de 73 % par rapport à l'année 2000. Pour cette période, et selon l'OMS, la vaccination contre la rougeole a permis d’éviter 23,2 millions de décès dans le monde[68].
Cependant, par rapport à 2016, le nombre de cas de rougeole dans le monde a augmenté de 167 %. Et selon les régions, de 246 % en Afrique, de 732 % aux Amériques, de 931 % en Méditerranée orientale, de 1791 % en Europe, et de 26 % en Asie du Sud-Est, mais il a diminué de 49 % dans la Région du Pacifique occidental, principalement en raison de la diminution du nombre de cas en Chine. Ces taux enregistrés en 2018 sont les plus élevés depuis 2011[68].
Couverture vaccinale[modifier | modifier le code]
En 2018, la couverture vaccinale mondiale estimée pour la première dose contre la rougeole est de 86 %, avec de grandes variations selon les régions. Sur la période 2016-2018, les chiffres restent relativement constants : région africaine (74-75 %), Méditerranée orientale (82-83 %), Asie du Sud-Est (88-89 %) ; de même sur la période 2008-2018 : Europe (93-95 %), Pacifique oriental (96-97 %). Dans la région des Amériques, la couverture vaccinale est de 92 % (2016), 88 % (2017) et 90 % (2018)[68].
En 2018, pour la deuxième dose, la couverture vaccinale mondiale n'atteint que 69 %[68]. Dans les pays où la vaccination a fortement réduit l'incidence de la rougeole, l'incapacité à maintenir ou atteindre un fort taux de couverture vaccinale entraîne ou entraînera des résurgences de la maladie[10].
En 2018, les six pays avec le plus grand nombre de nourrissons non vaccinés (zéro dose) sont le Nigéria (2,4 millions), l’Inde (2,3 millions), le Pakistan (1,4 million), l’Éthiopie (1,3 million), l’Indonésie (1,2 million) et les Philippines (0,7 million)[68].
Les causes de la résurgence mondiale de la rougeole en 2017-2018 sont multiples et diffèrent selon les pays[68] :
- faiblesse des systèmes ou programmes de vaccination ; instabilité politique ;
- voyageurs internationaux non vaccinés (rougeole d'importation) : par exemple en Israël (venant d'Ukraine, des Philippines et du Royaume-Uni), et aux États-Unis (venant d'Israël et d'Ukraine) ;
- obstacles liés à l’accès limité ou au coût de la vaccination, les ruptures de stocks de vaccins ;
- manque de sensibilisation des familles à la nécessité de se faire vacciner, les hésitations et la désinformation concernant les vaccins.
En Afrique[modifier | modifier le code]
Dans ces pays, la mortalité est très élevée, immédiate (1 décès sur 10 cas en zone rurale africaine) ou retardée (par aggravation secondaire de la malnutrition). Les infirmités sont nombreuses, les cécités (à la suite de kératites) s’ajoutant aux encéphalopathies.
Entre 2000 et 2005, plus de 300 millions d'enfants âgés de neuf mois à quinze ans ont été vaccinés ou revaccinés. Les politiques de vaccination systématique de masse ont pu être améliorées grâce à la mise en place de système de stockage réfrigéré pour les vaccins et à la création d'un maillage de dispensaires. En Afrique tropicale et en Afrique équatoriale, il a été ainsi observé une diminution de près de trois quarts des décès passant de 506 000 à 126 000.
En 2008, le contrôle de la rougeole s'est dégradé (raisons budgétaires, oppositions à la vaccination...) entrainant une augmentation des cas confirmés en 2009 et 2010[69].
En Amérique[modifier | modifier le code]
En Amérique, des campagnes de vaccination ont permis d'interrompre la transmission de la maladie (cas à virus autochtone) au Canada en 1998[70], aux États-Unis en 2000[71] et sur tout le continent en 2002[72].
Le 27 septembre 2016, l'élimination de la rougeole autochtone est déclarée comme confirmée aux Amériques par l'Organisation panaméricaine de la santé[73], par le maintien d'une incidence de la rougeole inférieure à cinq cas par million d'habitants[74]. Mais depuis 2017, une transmission endémique (non importée) a repris aux Amériques, au Venezuela (en 2018) et au Brésil (2019)[68].
Aux États-Unis, on compte en moyenne 60 cas de rougeole par an jusqu'en 2012, suivi d'une résurgence avec un pic en 2014 de 667 cas, puis 188 cas en 2015, 86 cas en 2016, et 118 cas en 2017[75]. Pour 2019, au 20 juin, on compte 1 077 cas liés à trois épidémies survenues fin 2018 dans des communautés sous-vaccinées (ville de New-York et État de Washington), en rapport avec des cas importés par des voyageurs infectés provenant d'Israël, d'Ukraine et des Philippines[17].
Ces épidémies touchent plus particulièrement des communautés religieuses non vaccinées, comme les Amish de l'Ohio en 2014[75].
Au Canada, une épidémie de 94 cas est survenue en 2007 chez des sujets non-vaccinés[76]. En 2016, l'incidence de la rougeole au Canada était de 0,3 cas pour un million d'individus de la population, avec un total de onze cas déclarés[77].
En Europe[modifier | modifier le code]
En 1998, l'Organisation mondiale de la santé a fixé pour objectif l'élimination de la rougeole en Europe pour 2010[52]. La surveillance de l'évolution de l'incidence en Europe est faite par Euvac.net[78].
Depuis 2005, un nouveau profil épidémiologique est apparu en Europe occidentale avec quelques pays ne parvenant pas à maintenir une couverture vaccinale suffisante, coïncidant avec un activisme anti vaccinal[79]. Alors que d'autres pays ayant une couverture vaccinale très élevée ont déjà ou sont en passe d'éliminer la rougeole (pays scandinaves, Slovénie, Slovaquie, Hongrie)[51],[80].
Euvac.net a comptabilisé plus de 12 000 cas de rougeoles en 2006-2007, près de 85 % d'entre eux concernant seulement cinq pays (Roumanie, Allemagne, Grande-Bretagne, Italie, Suisse)[81].
De 2006 à 2009, la Suisse a connu une longue épidémie de rougeole avec 4 410 cas, soit près du quart du total européen, liée à une couverture vaccinale insuffisante à deux doses de 76 %[82].
Le nombre de cas européens s'est très sensiblement accru en 2010, culminant à plus de 30 000 cas en 2010, plus de la moitié des cas étant français[83].
En 2017, 14 600 cas ont été notifiés par les pays de l'UE/EEE, soit le triple des cas reportés en 2016. La plupart des cas sont signalés en Roumanie (5 608), Italie (5 098), Grèce (967), Allemagne (929) et France (518). Depuis la fin de 2017, au 2 février 2018, la Grèce et la France rapportent une nette augmentation des cas[84]. Les enfants en Roumanie sont sensiblement moins vaccinés[85].
Depuis 2018, une transmission endémique (non importée) a repris en Europe : en Albanie, Grèce, Royaume-Uni et Tchéquie[68].
En France[modifier | modifier le code]
En France, l'incidence était encore de 18 000 cas en 1998, par insuffisance de la politique vaccinale (couverture vaccinale stagnant à moins de 85 %, deuxième dose introduite qu'en 1996)[51]. La surveillance de la maladie était effectuée par le réseau Sentinelles de l'INSERM de 1985 à 2005. Depuis 2005, la rougeole est redevenue une maladie à déclaration obligatoire[86].
Après une période « lune de miel », où l'incidence de la rougeole en France est devenue inférieure à 0,1 cas pour cent mille habitants (40 cas en 2006), une résurgence de rougeole survient à partir de 2008, favorisée par des communautés d'enfants et d'adolescents incomplètement ou non vaccinés[66], en raison de leurs convictions religieuses ou philosophiques comme notamment le mouvement traditionaliste catholique de la Fraternité Saint-Pie-X et le mouvement de l’Anthroposophie[87] : ainsi, les groupes d'enfants non vaccinés ou mal vaccinés se transmettent la maladie.
Selon les données de l'Institut de veille sanitaire, il y a eu 5 000 cas déclarés en 2010 (probablement davantage de cas non-déclarés), parmi lesquels 1 500 ont abouti à une hospitalisation, 9 ont été compliqués d'encéphalite infectieuse et 273 ont été compliqués de pneumopathie. Deux décès sont survenus à la suite d'une complication de la rougeole au cours de l'année 2010, l'un par encéphalite, l'autre par pneumopathie. Les données montrent que les taux d’incidence en 2010 ont plus que triplé chez les moins de 1 an et ont augmenté de près de 5 fois chez les adultes de 20 ans et plus par rapport à 2009. La tendance semble encore s'aggraver au début de l'année 2011. Cette année-là, on y a notifié 15 000 cas, dont 651 pneumopathies graves, 16 cas d'atteintes neurologiques et 6 décès[88].
L'épidémie de rougeole survenue en France de 2008 à 2012 compte 23 000 cas et 10 décès[88] ; 80 % d'entre eux n'étaient pas vaccinés ; 15 % n’avaient reçu qu’une seule dose de vaccin ; 5 % étaient vaccinés mais « mauvais répondeurs », et n'ont pas pu bénéficier d'une immunité de groupe, du fait d'une trop faible couverture vaccinale dans leur milieu[89].
En 2018, à la suite de plusieurs vagues épidémiques meurtrières parcourant le pays, la vaccination contre la rougeole — ROR — devient obligatoire pour les enfants français nés à partir du 1er janvier 2018[90].
Au , on observe depuis novembre 2017 une recrudescence de la rougeole avec 2 817 cas déclarés, notamment en Nouvelle-Aquitaine. L'incidence est la plus élevée chez les enfants de moins de 1 an avec 28 cas pour cent mille habitants. 22 % des cas ont été hospitalisés, 89 % des cas sont non ou mal vaccinés, et 3 décès par rougeole sont survenus depuis le début de l'année[91].
Histoire du vaccin contre la rougeole[modifier | modifier le code]
Inoculation[modifier | modifier le code]
L'idée de recourir à l’inoculation pour prévenir de la rougeole est apparue très tôt. Quand les procédés de variolisation eurent gagné en innocuité et en efficacité, le projet de cette transposition fut facilitée par le fait que la rougeole était alors considérée comme apparentée à la variole. La première tentative faite par Francis Home en 1758 fut publiée en 1759. L'expérience fut peu commentée et peu reprise. En 1841-1842, Von Katona reprend toutefois cette expérience sur une bien plus grande échelle avec des résultats annoncés comme bons. Cette tentative et d'autres plus réduites qui eurent lieu ensuite ne fut pas reprise faute de pouvoir limiter le développement de la maladie induite.
Sérothérapie[modifier | modifier le code]
Dans la foulée des découvertes de Behring, l'attention se porta plus sur la sérothérapie[92]. À la suite des travaux de Nicolle et Conseil en 1916, celle-ci s'effectue par injection de sérum de convalescents ou d'adultes complètement guéris d'une rougeole antérieure[93]. La méthode semble conduire à une guérison rapide et à une forme très atténuée de la maladie pour 90 % des patients si le sérum est injecté très tôt (« dans les premiers jours du contact avec l'enfant infectant »)[93]. La principale difficulté était de disposer d'un stock suffisant de sérum (qui impliquait de faire des saignées à des patients en guérison, qui étaient souvent des enfants, les familles refusant qu'on prenne leur sang).
Au Portugal, le Pr Salazar, s'appuyant sur l'idée déjà bien connue de l'immunité donnée au fœtus par le sang maternel via le placenta, a aussi suggéré que l'on utilise le sang placentaire, facile à recueillir dans les maternités, chez des accouchées en bonne santé uniquement (« sans traces de tuberculose évolutive et avec un Wassermann négatif » précisait-il[93]). Les essais de la méthode dite « du Prof. Salazar de Sousa » ont été selon Jorge (1932) « couronnés de succès »[93].
Premiers vaccins américains[modifier | modifier le code]
La vaccination proprement dite devient possible, lorsque le virus causal est isolé et cultivable, susceptible d'être produit en grande quantité sur culture cellulaire (travaux d'Enders en 1954 ayant permis le développement ultérieur d'un vaccin contre la polio).
Un collaborateur d'Enders, Samuel Katz (en) développe une souche de virus atténué dite Edmonston (du nom de l'enfant d'où le virus a été isolé). Ces virus sont cultivés et atténués par passages sur cellules d'embryons de poulets. Après un essai sur treize enfants handicapés en septembre 1958 puis sur 10 000 enfants — et quelques adultes — dans les trois années qui suivirent[94], ce vaccin, comportant la seule valence rougeoleuse, fut introduit pour la première fois aux États-Unis le 21 mars 1963 sous l’appellation Rubeovax par Merck.
Parmi les enfants ayant reçu le Rubeovax, 30 à 40 % d'entre eux montraient des signes de fièvres élevés et d'éruptions cutanées après la vaccination. Ces effets secondaires pouvaient être atténués par l'administration concomitante de gammaglobulines[95].
Deux vaccins à virus atténué ne nécessitant pas l'administration de gammaglobulines sont adoptés peu après : le vaccin Lirugen, du laboratoire Pitman, basé sur la souche Schwartz — élaboré à partir d'une souche Edmonston A, plus atténuée — est adopté le 2 février 1965 ; le vaccin Attenuvax du laboratoire Merck, basé sur la souche Moraten, à partir d'une souche Edmonston B très atténuée, est adopté le . La vaccination se faisait en une seule injection.
Aux États-Unis, près de 19 millions de doses de vaccins utilisant la souche Edmonston B atténuée ont été distribués de 1963 à 1975, et plus de 300 millions de doses (souche Moraten dérivée de l'Edmonston B) de 1968 à 2005[96].
Concurremment à ces vaccins à virus vivants atténués, deux vaccins à virus inactivés (tués) furent mis sur le marché le 21 mars 1963 : le Pfizer-vax ou Measles-K de Pfizer et le Generic de Lilly. Ces vaccins ne conféraient qu'une immunité insuffisante de courte durée, et provoquant parfois des rougeoles atypiques nécessitant une hospitalisation[97]. Ils furent retirés du marché en 1967, après avoir été injectés à 1,8 million d'enfants[98] ou à deux ou trois fois moins ayant reçu 1,8 million de doses[96].
Le , l'Attenuvax, combiné avec des virus atténués d'oreillons et de rubéole, donne le premier vaccin MMR, qui ne comportait toujours qu'une seule injection. En 1976, la seule souche autorisée pour la vaccination contre la rougeole aux États-Unis est celle de l'Attenuvax (Edmonston B). C'est en 1989 qu'aux États-Unis une deuxième injection fut reconnue nécessaire.
Développement mondial[modifier | modifier le code]
Vaccins non dérivés de la souche Edmonston[modifier | modifier le code]
En 1966, la République populaire de Chine autorise la vaccination avec un vaccin à virus atténué élaboré à partir d'une souche locale Shangaï 191[99].
En 1967, Smorodinstev développe un vaccin à virus atténué à partir de la souche léningrad-16 qui sera le premier vaccin utilisé dans l'Europe de l'Est[96].
Au Japon, les souches utilisées sont CAM-70, AIK-C, TD97, toutes issues de la souche initiale Tanabe[96].
Vaccins dérivés de la souche Edmonston[modifier | modifier le code]
Drago Ikic développe un vaccin à partir d'une souche Edmonston-Zagreb, utilisé en Yougoslavie à partir de 1969[96].
Les autorités du Royaume-Uni ne recommandèrent la vaccination contre la rougeole qu'en 1968 après quatre années d'essais. Leur choix se porta sur deux vaccins. Le premier fut le Wellcovax de Wellcome, produit à partir de la souche Beckingham 3 ; il a été retiré du marché en 1969, à la suite de trois cas d'encéphalite post vaccinale dont l'un fut fatal. D'autres encéphalites seront ultérieurement relevées. Le retrait du Wellcovax eut des répercussions ailleurs, comme en Nouvelle-Zélande. Pfizer propose un vaccin inactivé, le Mesavac.
Le programme anglais de vaccination se poursuit avec un second vaccin de Glaxo, le Mevilin-L, à partir d'une souche différente, mais qui ne peut couvrir tous les besoins : la vaccination est alors réservée à des groupes à risque.
Au début du XXIe siècle, en Europe Occidentale et au Canada, la souche vaccinale utilisée est la souche Schwartz, dérivée de la souche Edmonston A[96].
Notes et références[modifier | modifier le code]
- Ce nom de première maladie provient du fait que, vers la fin du XIXe siècle, lorsqu'on a voulu établir une liste internationale des exanthèmes infantiles, elle a été la première à être énumérée (en) « fourth disease », sur thelancet.com.
- (en) Regina Fölster‐Holst et Hans Wolfgang Kreth, « Viral exanthems in childhood – infectious (direct) exanthems. Part 1: Classic exanthems », JDDG: Journal der Deutschen Dermatologischen Gesellschaft, vol. 7, no 4, , p. 309–316 (ISSN 1610-0387, DOI 10.1111/j.1610-0387.2008.06868.x, lire en ligne, consulté le )
- Par exemple, en France, entre 2008 et 2012, la moitié des personnes atteintes ont plus de 15 ans, selon l'Agence nationale de santé publique (cf. fascicule).
- (en) Robert J. Kim-Farley, Measles, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 873-874.dans The Cambridge World History of Human Disease, K. F. Kiple (dir.).
- (en) Y. Furuse, A. Suzuki, et H. Oshitani, « Origin of measles virus: divergence from rinderpest virus between the 11th and 12th centuries », in Virology Journal, 2010, 7:52 [présentation en ligne].
- François Moutou, « Les zoonoses, entre humains et animaux », sur La vie des idées.fr, (consulté le ).
- Ariane Düx et al., Measles virus and rinderpest virus divergence dated to the sixth century BCE, 2020. DOI 10.1126/science.aba9411
- Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, coll. « Médecine et sociétés », , 527 p. (ISBN 2-228-55030-2), p. 478.
- Garnier Delamare, Dictionnaire illustré des termes de médecine, Paris, Maloine, , 1094 p. (ISBN 978-2-224-03434-4), p. 615.
- OMS, « Note de synthèse de l'OMS sur les vaccins contre la rougeole », Relevé épidémiologique hebdomadaire, vol. 92, no 17, , p. 207-208. (lire en ligne)
- E. Pilly, Maladies Infectieuses et Tropicales : tous les items d'infectiologie, Paris, CMIT, , 720 p. (ISBN 978-2-916641-66-9), p. 480.
- (en-US) « Pinkbook | Measles | Epidemiology of Vaccine Preventable Diseases | CDC », sur www.cdc.gov, (consulté le )
- « Rougeole », sur World Health Organization (consulté le )
- Lacroix, L. (2008). Rougeole: diagnostic et prise en charge d'une maladie toujours d'actualité. Maladies infectieuses, 152(14), 920-924.
- (en) Justin Lessler, Nicholas G Reich, Ron Brookmeyer, Trish M Perl, Kenrad E Nelson, et Derek AT Cummings, « Incubation periods of acute respiratory viral infections: a systematic review », in The Lancet, 2009, vol. 9, no 5, pp. 291-300 [présentation en ligne].
- Dominique Gendrel, « Rougeole », La Revue du Praticien, vol. 48, , p. 1841-1844.
- (en) Peter M. Strebel, « Measles », The New England Journal of Medicine, vol. 381, no 4, , p. 349-357.
- Patrice Plantin, « Sémiologie cutanée des éruptions fébriles de l'enfant », La Revue du Praticien, vol. 47, , p. 1414-1421.
- Haut Conseil de Santé Publique (HCSP), AVIS relatif à la problématique de la rougeole chez la femme enceinte, (lire en ligne)
- Haut Conseil de Santé Publique (HCSP), Guide pour l'immunisation en post-exposition Vaccination et immunoglobulines, (lire en ligne)
- Joël Gaudelus, « Maladies éruptives de l'enfant », La Revue du Praticien, vol. 54, , p. 1343-1350.
- E. Pilly 2017, op. cit., p. 145.
- E. Pilly 2017, op. cit., p. 481.
- OMS 28 avril 2017, op. cit., p. 209.
- (en) Duke T, Mgone CS, Measles: not just another viral exanthem, Lancet, 2003;361:763-773
- (en) William J Moss, et Diane E Griffin, « Measles », in The Lancet, 2012, vol. 379, no 9811, pp. 153-164, [présentation en ligne]
- (en) Richard T. Johnson, Diane E. Griffin, Robert L. Hirsch et al, « Measles encephalomyelitis—clinical and immunologic studies », in The New England Journal of Medicine, 1984, 310, pp. 137-141 [présentation en ligne].
- (en) Semba RD, Bloem MW, Measles blindness. Surv Ophthalmol, 2004;49:243-255
- (en) A Goudiaby, « Measles and atopy in Guinea-Bissau - PubMed », The Lancet, vol. 347, no 9018, , p. 1792–1796 (ISSN 0140-6736, PMID 8667923, DOI 10.1016/s0140-6736(96)91617-7, lire en ligne, consulté le ).
- (en) F Pekun, « Frequency of allergic diseases following measles - PubMed », Allergologia et immunopathologia, vol. 34, no 4, , p. 146–149 (ISSN 0301-0546, PMID 16854347, DOI 10.1157/13091040, lire en ligne, consulté le ).
- (en) PARSIFAL Study Group, « Allergic disease and atopic sensitization in children in relation to measles vaccination and measles infection - PubMed », Pediatrics, vol. 123, no 3, , p. 771–778 (ISSN 1098-4275, PMID 19255001, DOI 10.1542/peds.2008-0013, lire en ligne, consulté le ).
- (en) EPAAC Study Group, « Early atopic disease and early childhood immunization--is there a link? - PubMed », Allergy, vol. 63, no 11, , p. 1464–1472 (ISSN 1398-9995, PMID 18925883, DOI 10.1111/j.1398-9995.2008.01696.x, lire en ligne, consulté le ).
- (en) O P Heinonen, « Acute infections, infection pressure, and atopy - PubMed », Clinical and experimental allergy : journal of the British Society for Allergy and Clinical Immunology, vol. 36, no 5, , p. 634–639 (ISSN 0954-7894, PMID 16650049, DOI 10.1111/j.1365-2222.2006.02468.x, lire en ligne, consulté le ).
- P Bager, T Westergaard et al., « Age at childhood infections and risk of atopy », Thorax, vol. 57, no 5, , p. 379 (PMID 11978910, DOI 10.1136/thorax.57.5.379, lire en ligne, consulté le ).
- (en) Tari Haahtela, « Immunization and atopy: possible implications of ethnicity - PubMed », The Journal of allergy and clinical immunology, vol. 113, no 3, , p. 401–406 (ISSN 0091-6749, PMID 15007336, DOI 10.1016/j.jaci.2003.12.010, lire en ligne, consulté le ).
- (en) Mitch Leslie (2015) Measles vaccine protects against other deadly diseases ; News de Science Magazine en ligne : , (consulté le ).
- (en) Michael J. Mina, Tomasz Kula, Yumei Leng et Mamie Li, « Measles virus infection diminishes preexisting antibodies that offer protection from other pathogens », sur science.sciencemag.org, (DOI 10.1126/science.aay6485, consulté le ).
- (en) Velislava N. Petrova, Bevan Sawatsky, Alvin X. Han, Brigitta M. Laksono, Lisa Walz, Edyth Parker et Kathrin Pieper, « Incomplete genetic reconstitution of B cell pools contributes to prolonged immunosuppression after measles », sur immunology.sciencemag.org, (DOI 10.1126/sciimmunol.aay6125, consulté le ).
- OMS 28 avril 2017, op. cit., p. 210-211.
- Hübschen JM, Gouandjika-Vasilache I, Dina J, Measles, Lancet, 2022;399:678-690
- (en) Christopher R. Sudfeld, Ann Marie Navar, Neal A Halsey Effectiveness of measles vaccination and vitamin A treatment, Int. J. Epidemiol. (2010) 39 (suppl 1): i48-i55.
- « Rougeole », sur www.who.int (consulté le ).
- OMS 28 avril 2017, op. cit, p. 206.
- « Calendrier vaccinal 2019 (p. 5 et 29) » [PDF], sur solidarités-sante.gouv.fr.
- http://www.invs.sante.fr/beh/2011/10_11/beh_10_11_2011.pdf
- (en) Amanna IJ, Carlson NE, Slifka MK, Duration of humoral immunity to common viral and vaccine antigens, N Engl J Med, 2007;357:1903-1915
- (en) Mantadakis E, Farmaki E, Buchanan GR, Thrombocytopenic purpura after measles-mumps-rubella vaccination: a systematic review of the literature and guidance for management, J Pediatr, 2010;156:623-628
- (en) Caceres VM, Strebel PM, Sutter RW, Factors determining prevalence of maternal antibody to measles virus throughout infancy: a review, Clin Infect Dis, 2000;31:110-119
- (en) Leuridan E, Hens N, Hutse V, Ieven M, Aerts M, Van Damme P, Early waning of maternal measles antibodies in era of measles elimination: longitudinal study, BMJ, 2010;340:c1626
- OMS 28 avril 2017, op. cit., p. 211 et 214.
- Jean-Noël Gaudelus 2008, op. cit., p. 168-171.
- Joël Gaudelus, Vaccinologie, Rueil-Malmaison, Doin, , 463 p. (ISBN 978-2-7040-1243-5), chap. 13 (« Vaccin anti-rougeoleux : vers l'élimination de la rougeole ? »), p. 166.
- Au début du XXe siècle, en France, la rougeole tuait plus de trois mille enfants par an, selon Jean Paraf et Jean Bernard, « Rougeole » (fascicule 8041), Encyclopédie médico-chirurgicale - maladies infectieuses, , p. 4. Ils indiquent en 1946 que la rougeole est « la maladie contagieuse de l'enfance dont la mortalité baisse le plus lentement, celle qui se montre la plus redoutable pour les enfants français ».
- (en) Global Epidemiology of Infectious Diseases, Clements CL, Hussey GD. Measles In: Murray CJL, Lopez AD, Mathers CD, eds. Geneva: World Health Organization, 2004, p. 75 et 100-101.
- « Enfants: faire reculer la mortalité », sur World Health Organization (consulté le )
- (en) Strebel PM, Cochi SL, Hoekstra E et al. A world without measles, J Infect Dis, 2011;204(suppl 1):S1-S3
- (en) K. Keja, C. Chan, G. Hayden et R. H. Henderson, « Expanded programme on immunization », World Health Statistics Quarterly. Rapport Trimestriel De Statistiques Sanitaires Mondiales, vol. 41, no 2, , p. 59–63 (ISSN 0379-8070, PMID 3176515, lire en ligne, consulté le )
- OMS, « Rougeole », Relevé épidémiologique hebdomadaire, vol. 73, no 50, , p. 389 (lire en ligne [PDF]).
- (en) F.T. Cutts, M. Grabowsky, et L.E. Markowitz, « The effect of dose and strain of live attenuated measles vaccines on serological responses in young infants », in Biologicals, 1995 ; 23(1), pp. 95-106 [présentation en ligne].
- (en) Ciro A. de Quadros, « Measles Elimination in the Americas, Evolving Strategies », Journal of the American Medical Association, vol. 275, no 3, , p. 224-229.
- I. Bonmarin et D. Levy-Bruhl, « La rougeole en France : impact épidémiologique d’une couverture vaccinale sub-optimale », sur eurosurveillance.org, (consulté le )
- « En France, 11 vaccins sont obligatoires », sur ladepeche.fr, (consulté le )
- « Mon carnet de vaccination électronique », sur mesvaccins.net, (consulté le )
- Daniel Levy-Bruhl, « Modélisation de la rougeole en France », Bulletin épidémiologique hebdomadaire, no 29, (lire en ligne).
- F. Baudier, « Vaccination rougeole, oreillons et rubéole », Le Concours Médical, , p. 1951-1956..
- Isabelle Parent du Châtelet, « La rougeole en France 2008 », Bulletin épidémiologique hebdomadaire, nos 39-40. « Numéro thématique - Rougeole », , p. 415..
- OMS 28 avril 2017, op. cit., p. 217.
- Minal K. Patel, « Progrès accomplis dans le monde en vue de l’élimination régionale de la rougeole, 2000-2018 », Relevé épidémiologique hebdomadaire, vol. 94, no 49, , p. 581-590. (lire en ligne)
- OMS, « Flambées de rougeole 2009-2010 », Relevé épidémiologique hebdomadaire, vol. 86, no 14, , p. 131. (lire en ligne)
- Agence de la santé publique du Canada, « Pour les professionnels de la santé : rougeole - Canada.ca », sur www.canada.ca (consulté le )
- (en) « Measles Imported by Returning U.S. Travelers Aged 6--23 Months, 2001--2011 », sur www.cdc.gov (consulté le )
- « Eradication mondiale de la rougeole », sur apps.who.int,
- « Le continent américain a vaincu la rougeole », sur Science et Avenir (consulté le ).
- OMS, « Progrès accomplis dans le monde en vue de l'élimination régionale de la rougeole, 2000-2016. », Relevé épidémiologique hebdomadaire, vol. 92, no 43, , p. 655. (lire en ligne)
- (en-US) « Measles | Cases and Outbreaks | CDC », sur www.cdc.gov, (consulté le )
- (en) Dallaire F, De Serres G, Tremblay FW, Markowski F, Tipples G, Long-lasting measles outbreak affecting several unrelated networks of unvaccinated persons, J Infect Dis, 2009;200:1602-1605
- Agence de la santé publique du Canada et Agence de la santé publique du Canada, « Surveillance de la rougeole au Canada : 2016 », sur aem, (consulté le )
- (en) « EUVAC.Net », sur European Centre for Disease Prevention and Control (consulté le )
- (en) E. Kim Mulholland, « Measles in the 21st Century », The New England Journal of Medicine, vol. 366, no 19, , p. 1755-1757.
- Mark Muscat, « Evaluation épidémiologique de la rougeole en Europe en 2008 », Bulletin épidémiologique hebdomadaire, nos 39-40, , p. 439.
- (en) Muscat M, Bang H, Wohlfahrt J, Glismann S, Mølbak K, the EUVAC.NET group, Measles in Europe: an epidemiological assessment, The Lancet, 2009;73:383-389
- « Rougeole en suisse », sur ge.ch, (consulté le )
- (en) Increased transmission and outbreaks of measles-european region, 2011, JAMA, 2012;307:450-452
- « Evaluation du risque de rougeole en Europe », sur ecdc.europa.eu, (consulté le )
- « Recrudescence de l’épidémie de rougeole en Europe », sur sante.lefigaro.fr, (consulté le )
- Santé publique France - InVS, « Rougeole / Maladies à prévention vaccinale / Maladies infectieuses / Dossiers thématiques / Accueil », sur invs.santepubliquefrance.fr (consulté le )
- « Rougeole : des écoles privées hors contrat à l'origine de l’épidémie entre 2008 et 2012 », sur Franceinfo, (consulté le )
- INPES, Planète vaccination, , 63 p. (lire en ligne)
- « En 2008-2011, la rougeole balaie tout le pays », sur sante.lefigaro.fr, (consulté le )
- « Calendrier vaccinal », sur solidarites-sante.gouv.fr (consulté le )
- Santé publique France - InVS, « Bulletin épidémiologique rougeole. Données de surveillance au 11 juillet 2018. / Points d'actualités / Rougeole / Maladies à prévention vaccinale / Maladies infectieuses / Dossiers thématiques / Accueil », sur invs.santepubliquefrance.fr (consulté le )
- (en) Stanley A. Plotkin, History of Vaccine Development, Springer, 1er juin 2011
- Jorge, R. (1932) Sur la séro-prevention de la rougeole au moyen du sang placentaire. Bull. Office internat. d'hyg. pub., 24, 978. PDF,
- « The American Journal of Public Health (AJPH) from the American Public Health Association (APHA) publications », sur American Public Health Association (APHA) publications (consulté le ).
- (en) Jan Hendriks et Stuart Blume, « Measles Vaccination Before the Measles-Mumps-Rubella Vaccine », American Journal of Public Health, vol. 103, no 8, , p. 1393–1401 (ISSN 0090-0036, PMID 23763422, PMCID 4007870, DOI 10.2105/AJPH.2012.301075, lire en ligne, consulté le )
- (en) Stanley Plotkin, Vaccines, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), chap. 18 (« Measles vaccines »), p. 360-363.
- [PDF]http://repub.eur.nl/res/pub/3869/EF26F9D0d01.pdf
- Baker JP, Katz SL, Childhood vaccine development: An overview, Pediatric Research, 2004;55:347–356
- https://www.jstor.org/pss/4453066
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Hanslik T. et Kernéis S. « La rougeole et l’interniste : une maladie à éliminer ! » La Revue de médecine interne 2010;31(9):593-5.
- Moreau E (2013) Connaissances parentales sur la rougeole et sa vaccination en 2013 (Doctoral dissertation).
Articles connexes[modifier | modifier le code]
- Jules Comby a laissé son nom à un symptôme médical, le « Signe de Comby », qui est une indication précoce de la rougeole.
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Page sur le site Organisation mondiale de la santé
- Info rougeole de l'Institut national de prévention et d'éducation pour la santé (France)


 French
French Deutsch
Deutsch