Sténose trachéale — Wikipédia
| Spécialité | Otorhinolaryngologie |
|---|
| CIM-10 | J39.8 |
|---|---|
| CIM-9 | 519.19 |
| DiseasesDB | 29215 |
| MeSH | D014135 |
Une sténose trachéale est, en médecine humaine, un rétrécissement anormal de la trachée. Lorsque la zone rétrécie s'étend au larynx, vers la région sous-glottique — sous les cordes vocales —, il s'agit par extension d'une sténose laryngotrachéale. La lumière de la trachée, en forme de fer à cheval, a normalement un calibre interne de 1 à 2 cm et permet le passage de l'air jusqu'aux poumons. Une réduction de calibre, appelée sténose, entraîne une difficulté à respirer et une respiration bruyante à type de stridor ou de cornage. Ces signes cliniques apparaissent généralement à partir d'une réduction de calibre de 50 % mais, en cas d'apparition progressive de la sténose, peuvent n'être présents qu'à partir d'une sténose à 75 % de la lumière trachéale. Non traitée, une sténose trachéale peut entraîner une détresse respiratoire.
Chez l'enfant, la sténose peut être d'origine congénitale, ou secondaire à une tumeur le plus souvent bénigne, c'est-à-dire non cancéreuse. Chez l'adulte, elle est peut-être une séquelle d'intubation ou de trachéotomie, voire se produire de manière spontanée. Elle peut également être causée par une tumeur maligne naissant de la trachée, ou bien naissant d'un organe voisin (le plus souvent le poumon) jusqu'à l'envahir. Enfin, le rétrécissement de calibre peut être lié à une compression par un organe extérieur à la trachée, dite « compression extrinsèque », comme un goitre. Le diagnostic nécessite une fibroscopie bronchique et une tomodensitométrie, afin d'évaluer le degré de sténose, sa longueur et d'analyser les tissus adjacents.
La chirurgie de la trachée a pris son essor à partir de la fin des années 1980 sous l'impulsion de chirurgiens comme Hermes Grillo et Peter Goldstraw. L'intervention la plus couramment pratiquée pour une sténose est la résection-anastomose de trachée, où le segment pathologique est retiré et la continuité de la trachée rétablie ; chez l'enfant présentant une sténose longue la trachéoplastie peut être proposée. Le remplacement de trachée par une prothèse ou une greffe est peu pratiqué, et uniquement par des équipes très spécialisées. Le traitement endoscopique par bronchoscopie interventionnelle permet de désobstruer la trachée et de poser une prothèse interne rétablissant la perméabilité des voies aériennes, mais la chirurgie demeure le traitement de première intention.
Rappels anatomiques[modifier | modifier le code]
Anatomie normale de la trachée[modifier | modifier le code]

La trachée est le conduit élastique fibrocartilagineux reliant le larynx aux bronches. Elle sert de passage à l'air lors de la respiration et filtre les particules fines[2]. La trachée naît dans le cou, puis plonge dans le thorax où elle chemine dans le médiastin (à l'arrière du sternum et entre les poumons) avant de se diviser en bronches souches droite et gauche. La bifurcation trachéale est également appelée « carène »[3]. Elle chemine à l'avant de l'œsophage, avec qui elle partage sa microvascularisation.
La partie antérieure de la trachée est rigide, dotée d'anneaux cartilagineux en fer à cheval lui conférant sa solidité, tandis que sa face postérieure, la membraneuse, est beaucoup plus fine. À son extrémité supérieure, le cartilage cricoïde est, lui, un anneau entièrement cartilagineux assurant la jonction avec le larynx, dont il occupe la partie inférieure. Il est surmonté du cartilage thyroïde et des cartilages aryténoïdes où s'insèrent les cordes vocales.
L'intérieur de la trachée est tapissé d'une muqueuse respiratoire dotée de cils et sécrétant du mucus. La vascularisation artérielle, au niveau cervical, est issue des artères thyroïdiennes inférieures et, au niveau thoracique, de plusieurs rameaux artériels variables. Les artérioles forment des arcades circulant de part et d'autre de la trachée, au contact de l'angle postérieur de la cartilagineuse et de la membraneuse[3].
Durant l'embryogenèse, la trachée se forme à partir du début de la quatrième semaine, lorsqu'apparaît un sillon à la face antérieure de l'intestin primitif. Ce sillon est tapissé d'un revêtement appelé endoderme, qui donnera la muqueuse respiratoire. Ensuite, le sillon s'agrandit et forme une poche, le diverticule respiratoire laryngotrachéal. À son extrémité se développera le bourgeon pulmonaire. À la fin de la quatrième semaine, le diverticule respiratoire se sépare de l'intestin primitif par les replis œsotrachéaux. Ceux-ci vont fusionner entre eux pour donner le septum trachéo-œsophagien, qui sépare la trachée, à l'avant, de l'œsophage, à l'arrière. Les anneaux cartilagineux se développent à partir de la dixième semaine[3].
Définition d'une sténose[modifier | modifier le code]
Classification de Myer-Cotton [4]:
- grade I : sténose < 50 % ;
- grade II : sténose de 51 à 70 % ;
- grade III : sténose > 70 % avec persistance d'une lumière ;
- grade IV : pas de lumière trachéale visible.
Le diamètre normal de la trachée est entre 1 et 2 cm pour une longueur d'environ 12 cm chez l'adulte[2].
L'écoulement du flux d'air dans la trachée est laminaire et suit la loi de Poiseuille[5],[6]. Le débit est inversement proportionnel à la puissance 4 du rayon de la trachée. Les résistances augmentent donc considérablement pour une faible réduction de calibre, entraînant une gêne à la respiration ressentie comme une dyspnée[2]. Les signes cliniques apparaissent généralement à partir d'une réduction de moitié du calibre de la trachée ; cependant, lorsque la sténose se constitue sur une longue période, ils peuvent n'apparaître qu'au-delà de 75 % de sténose[7].
Il existe plusieurs classifications permettant de caractériser les sténoses selon leur localisation et leur importance[8], sans qu'aucune ne permette la prise en compte globale de tous les facteurs pronostics[9]. Elles sont ainsi peu utilisées en pratique courante[9],[10]. La classification de McCaffrey précise le niveau de la sténose par rapport à la glotte[11]. La classification de Myer-Cotton[4], utilisée pour les sténoses de la région sous-glottique, évalue le degré d'obstruction.
Au plan morphologique, les sténoses trachéales peuvent présenter plusieurs aspects[8],[10] : fine membrane circonférentielle (sténose dite « en diaphragme »), effondrement de l'arc cartilagineux, bourgeonnement endotrachéal anarchique ou rétrécissement homogène (sténose dite « en sablier »). Elles peuvent être associées à une trachéomalacie, perte de solidité des cartilages responsable d'un aplatissement de la trachée durant l'expiration, et qui entraîne ou majore la dyspnée[8].
- Aspect en fibroscopie. Au premier plan, les cordes vocales avec la sténose à l'arrière.
Causes[modifier | modifier le code]
La plupart des sténoses sont dites « intrinsèques », lorsque l'origine de la sténose est une anomalie de la trachée elle-même. On parle de « compression extrinsèque » lorsque le rétrécissement de calibre est causé par un organe ou une tumeur extérieur à la trachée qui, en appuyant sur la paroi, l'aplatit.
Congénitales[modifier | modifier le code]
La sténose trachéale congénitale est rare[12]. Elle s'observe chez le nourrisson ou le très jeune enfant, et contribue pour moins de 1 % à l'ensemble des sténoses trachéales. Elle peut être isolée ou, dans 60 % des cas, associée à d'autres malformations, en particulier cardiovasculaires[13],[14].
On distingue plusieurs formes de sténoses congénitales[15], classées en plusieurs types[16] selon la longueur de trachée sténosée et la présence d'une implantation anormale de la bronche souche droite. Dans environ 50 % des cas, il s'agit d'une sténose segmentaire s'étendant sur 3 à 4 anneaux. Les sténoses en entonnoir, plus longues, constituent 20 % des sténoses congénitales, tandis que l'hypoplasie généralisée concerne 30 % des cas.
Les causes en sont variables et mal connues[12] ; il est rare qu'une anomalie génétique soit associée[17]. Les anomalies de structure des cartilages ont été souvent mises en cause, notamment la présence d'anneaux complets circulaires et non en fer à cheval, responsable des sténoses segmentaires. La désorganisation des cartilages, associée parfois à une dystrophie fibreuse, entraîne les sténoses en entonnoir et les hypoplasies généralisées.
Non tumorales[modifier | modifier le code]

Chez l'adulte, on distingue plusieurs types de sténoses non tumorales de la trachée, qui entraînent des lésions différentes[7],[9]. Dans la grande majorité des cas[3] les sténoses non tumorales sont des complications d'une intubation ou d'une trachéotomie, parfois ancienne. Un traumatisme de la trachée ou du larynx peut secondairement entraîner, par des mécanismes similaires, une sténose avec les mêmes lésions[18]. Dans une grande série de cas publiés à propos des sténoses non tumorales[19], on constate que 87 % des cas sont secondaires à une intubation ou à une trachéotomie, et 12 % des cas sont de cause inconnue, ce que l'on désigne par le terme « idiopathique. »
Post-intubation[modifier | modifier le code]
L'intubation trachéale est une technique d'anesthésie-réanimation consistant à introduire, généralement par la bouche, une sonde tubulaire dans la trachée. Le but est de permettre la ventilation d'un patient endormi ou présentant des troubles de conscience. Un ballonnet est gonflé autour de la sonde dans la trachée afin d'assurer l'étanchéité, évitant les fuites d'air lors de la ventilation ainsi que le passage de salive ou de liquide gastrique dans l'arbre trachéobronchique.
En cas d'une intubation longue, notamment dans le cadre d'une prise en charge en réanimation, un surgonflage du ballonnet entraîne une ischémie de la paroi trachéale en regard[7]. L'introduction de ballonnets à basse pression a ainsi permis de diminuer le taux de sténose post-intubation, sans toutefois l'éliminer complètement. Une étude de 2007 estime le nombre annuel de nouveaux cas à 4,9 par million d'habitants au Royaume-Uni[20].
Les sténoses post-intubation concernent principalement la partie moyenne de la trachée, en regard de la zone du ballonnet[7]. On en distingue deux types morphologiques[21] : courtes en sablier[7] (< 1 cm) avec une fibrose rétractile de la muqueuse sans atteinte majeure des cartilages, et complexes avec une destruction des cartilages et une part de trachéomalacie associée. La muqueuse apparaît généralement saine[3], mais peut comporter également du tissu de granulation cicatriciel aberrant en plus des destructions et des remaniements des anneaux cartilagineux[7].
Les symptômes peuvent être précoces, peu de temps après l'extubation, mais aussi se développer sur plusieurs mois, voire plusieurs années, après[7].
Post-trachéotomie[modifier | modifier le code]

1. Cordes vocales
2. Cartilage thyroïde
3. Cartilage cricoïde
4. Cartilages de la trachée
5. Ballonnet
La trachéotomie consiste à introduire une sonde tubulaire dans la trachée par une ouverture réalisée dans sa face antérieure. La canule de trachéotomie sort à la peau en bas du cou. Une trachéotomie peut être réalisée dans le cadre d'une prise en charge de réanimation en cas de nécessité de ventilation mécanique prolongée[22], en cas d'intubation impossible, ou dans un contexte chirurgical ORL. Une fois la sonde retirée de manière définitive, la cicatrisation de l'orifice trachéal entraîne la formation de tissu fibreux qui, en se rétractant, peut entraîner un rétrécissement localisé[7]. Le taux de sténoses varie selon les séries publiées entre 1 et 20 %[7].
Les sténoses post-trachéotomies sont courtes et atteignent la trachée haute, avec des remaniements au niveau des cartilages[7]. Elles peuvent être associées à une sténose laryngée, notamment en regard du cartilage cricoïde[7]. Là encore, la muqueuse apparaît normale en fibroscopie[3].
Post-traumatiques[modifier | modifier le code]
Les traumatismes de la trachée et du larynx peuvent entraîner des lésions très variées[23]. Les traumatismes fermés, par compression, écrasement ou strangulation, sont les plus fréquents et ont une mortalité à la phase aiguë de 9 %[23],[24]. Les lésions observées sont le plus souvent une rupture de la trachée, longitudinale ou transversale[25], ou une fracture d'anneaux trachéaux ou des cartilages du larynx[18]. Alors que les plaies traumatiques de trachée, par arme blanche ou par arme à feu, intéressent dans 75 à 80 % des cas la trachée cervicale, la même proportion des traumatismes fermés atteint la trachée basse, proche de la carène[23].
Ces traumatismes sont susceptibles d'entraîner, parfois plusieurs années après, des sténoses laryngotrachéales[18]. Les fractures cartilagineuses se compliquent plus volontiers de sténoses, le délai d'apparition étant compris entre 6 semaines et 6 mois[18].
Idiopathiques[modifier | modifier le code]
Les sténoses trachéales idiopathiques sont des lésions inflammatoires dont le mécanisme est mal expliqué[7],[26]. Le terrain est principalement celui des femmes jeunes sans antécédents médicaux. Une maladie inflammatoire doit être éliminée, notamment une maladie de Wegener[27] et une polychondrite atrophiante[28]. L'évolution naturelle, en particulier la rapidité de la progression de la sténose, est mal connue[29].
Il existe une atteinte circonférentielle de la muqueuse, mais les cartilages sont respectés[26]. Lorsque la sténose est haute, elle peut s'étendre au larynx dans sa partie sous-glottique[7].
Tumorales[modifier | modifier le code]
Intrinsèques[modifier | modifier le code]

Chez l'adulte, les tumeurs de la trachée sont malignes dans environ 90 % des cas[3]. Il s'agit de tumeurs rares, avec 2 à 6 nouveaux cas pour 100 000 personnes chaque année[30],[31]. Parmi les cancers naissant de la trachée, dits « tumeurs primitives », le carcinome adénoïde kystique et le carcinome épidermoïde sont les plus fréquents[32],[30], constituant chacun environ un tiers des diagnostics[30]. Des tumeurs de voisinage peuvent également infiltrer et envahir la trachée, notamment les cancers de l’œsophage et du poumon (20 à 30 % des cas[33]), mais aussi les adénopathies médiastinales[3].
Chez l'enfant, les tumeurs de trachée sont plus souvent bénignes[30].
Les tumeurs de trachée entraînent des expectorations de sang rouge d'abondance variable, allant des crachats striés de quelques filets de sang au saignement important[30]. En fibroscopie, elles apparaissent comme un épaississement de la muqueuse, parfois bourgeonnante et ulcérée[3].
Extrinsèques[modifier | modifier le code]
Chez l'adulte comme chez l'enfant, la compression importante de la trachée — sans envahissement de la paroi — par un goitre, un cancer de la thyroïde[34] ou une tumeur médiastinale peut entraîner une réduction de calibre suffisante pour entraîner des symptômes.
La longueur de la sténose est variable ; la fibroscopie retrouve une muqueuse saine et sans anomalie[3].
- Goitre comprimant la trachée cervicale.
- Rétrécissement trachéal (flèche rouge). Tomodensitométrie (coupe transversale).
- Même tumeur (coupe sagittale).
En cas de compression extrinsèque prolongée, une trachéomalacie peut être associée. Bien que rare, il s'agit d'une complication possible des goitres[35],[36]. Elle se caractérise par la flaccidité du cartilage de support trachéal qui conduit à un effondrement de la trachée lors de l'expiration[37]. Durant l'expiration, la pression intrathoracique augmente et dépasse la pression intratrachéale ; normalement, la rigidité des cartilages de la trachée et des bronches souches contrecarre la pression qui tend à écraser les voies aériennes. En cas de trachéomalacie, la perte de solidité des cartilages entraîne un écrasement de la paroi antérieure de la trachée et donc une réduction de calibre à l'expiration.
Signes cliniques[modifier | modifier le code]
Les symptômes sont les mêmes pour toutes les causes de sténose[10] et sont dominés par deux types de bruits respiratoires, le stridor et le cornage. Le stridor, sifflement accompagnant la respiration, est un signe caractéristique de l'obstruction des sténoses de la trachée haute et du larynx[10]. Il s'agit d'un bruit à prédominance inspiratoire, et à tonalité aiguë et sifflante[38],[39]. Le cornage est lui aussi à prédominance inspiratoire, mais de tonalité plus rauque et présent en cas de sténose uniquement trachéale[38].
Le tableau fonctionnel[10] est dominé par la dyspnée, sensation de difficulté à respirer, majorée à l'effort, et qui est accompagnée de toux ou de crachats dans environ 90 % des cas[40] ainsi que de bradypnée (ralentissement de la fréquence respiratoire), en particulier chez l'enfant[41]. La sensation de dyspnée est généralement stable durant la journée, bien qu'un tiers des patients décrive une aggravation le matin[40]. Lorsque la sténose s'aggrave, la dyspnée, initialement perçue seulement à l'effort, devient gênante au repos[29] et peut être associée à un tirage, qui est un signe de gravité. Un autre signe de gravité particulier à l'enfant est le retard de croissance staturo-pondérale[39]. Chez l'enfant comme chez l'adulte, des épisodes de suffocation peuvent survenir en cas de sténose très serrée[39], par exemple si un crachat se loge en regard de la sténose et obstrue la lumière[42].
Il existe souvent une modification de la voix, pouvant aller jusqu'à la dysphonie vraie[43] en raison de la modification de l'écoulement de l'air.
Le retentissement des symptômes sur la qualité de vie est important[40].
Le tableau des sténoses trachéales est proche de la dyspnée laryngée, avec qui il partage plusieurs caractéristiques, dont la nature de la dyspnée et le stridor[44].
Diagnostic[modifier | modifier le code]
Examens complémentaires[modifier | modifier le code]

La fibroscopie bronchique est le premier examen du diagnostic des sténoses trachéales[3]. Elle permet de visualiser la sténose, de mesurer sa longueur et de préciser sa localisation par rapport aux cordes vocales, mais également de réaliser des biopsies. Lorsque la sténose est serrée, elle ne doit pas être franchie avec le fibroscope, car il risque d'oblitérer la lumière et entraîner une asphyxie[10]. La réalisation de biopsies, en causant un saignement, même minime, peut aussi être à l'origine d'une oblitération de la lumière trachéale, et doit être envisagée avec prudence[10].
La radiographie thoracique visualise mal la trachée et est peu informative dans les sténoses[30],[45]. En raison de sa grande disponibilité, elle est cependant souvent réalisée en débrouillage devant un essoufflement ou une dyspnée[45]. La tomodensitométrie est le seul examen d'imagerie nécessaire, indispensable au diagnostic et à l'évaluation de la sténose[12]. Des reconstructions virtuelles de la trachée et du larynx sont réalisées afin de visualiser tant l'étendue de la sténose que les tissus environnants ; elles permettent de réaliser également une endoscopie virtuelle[46]. L'imagerie par résonance magnétique est peu utilisée, n'apportant rien de plus que la tomodensitométrie avec une résolution spatiale inférieure, excepté chez l'enfant afin de limiter l'exposition aux rayons X[47],[48].
L'exploration fonctionnelle respiratoire est peu utile à la prise en charge[29]. Elle retrouve une obstruction haute, qui se manifeste par une courbe débit-volume aplatie[29].
Diagnostic différentiel[modifier | modifier le code]
Environ un tiers des patients présentant une sténose trachéale sont d'abord traités pour un asthme, la sensation de dyspnée, qui est le principal mode de présentation des sténoses, étant similaire[40]. Toutefois, contrairement à l'asthme, il n'y a pas d'amélioration des symptômes après un traitement par bronchodilatateurs.
L'inhalation d'un corps étranger (en particulier chez l'enfant) peut également être à l'origine d'un stridor et d'une dyspnée, mais il s'agit d'un phénomène le plus souvent aigu[38],[49].
Après une intubation, un œdème laryngé peut lui aussi entraîner un stridor, mais il s'agit là encore d'un phénomène aigu. La fibroscopie retrouve un gonflement des cordes vocales et de la muqueuse laryngée[50]. Le traitement en est médical, principalement par corticothérapie, et la sévérité de l'obstruction peut imposer une nouvelle intubation le temps que le traitement agisse et que l'œdème régresse[51].
Traitement[modifier | modifier le code]
Les formes sévères de sténoses trachéales nécessitent une prise en charge rapide en raison du risque d'asphyxie[12]. Le traitement des sténoses par compression extrinsèque est celui de la cause de la compression : thyroïdectomie totale pour un goître, radiothérapie et chimiothérapie pour un cancer bronchique non à petites cellules ou un lymphome... Dans le cas des sténoses intrinsèques, la chirurgie est le traitement de référence à privilégier, mais n'est cependant pas toujours réalisable[10]. La prise en charge est réalisée par les équipes de chirurgie ORL ou de chirurgie thoracique, souvent en collaboration[40].
Chirurgie[modifier | modifier le code]
Techniques chirurgicales[modifier | modifier le code]
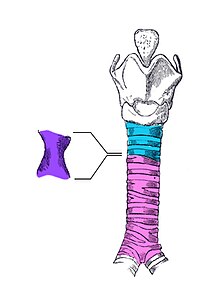
Les sténoses trachéales s'opèrent uniquement en cas de symptômes, chez l'enfant[52] comme chez l'adulte, indépendamment du degré de sténose. La chirurgie est le traitement de référence des sténoses trachéales[9]. Cependant, lorsqu'il s'agit d'une sténose d'origine tumorale, la chirurgie est réservée aux tumeurs localisées, sans envahissement des organes voisins ni des ganglions[53].
Diverses techniques de réparation peuvent être utilisées selon le type et la morphologie de la sténose[54]. La trachéotomie est rarement utilisée en dehors du contexte de la grande urgence, où même la bronchoscopie rigide lui est souvent préférée[55]. On lui préfère soit une chirurgie permettant un traitement complet, soit des mesures d'attente peu invasives avant un traitement médical d'une cause tumorale[55]. La résection-anastomose de trachée est adaptée à la vaste majorité des sténoses bénignes, avec d'excellents résultats fonctionnels et peu de complications[54],[19],[56]. L'intervention, réalisée le plus souvent par cervicotomie, consiste à retirer le segment de trachée pathologique et à suturer ensemble les berges de trachée saine. Lorsque la sténose est étendue au larynx, une opération de Pearson peut être réalisée, voire une laryngoplastie d'élargissement[54], de manière à suturer la trachée au larynx. La mortalité de l'intervention est faible, à environ 1 %[19]. Des complications surviennent sur l'anastomose dans environ 9 % des cas[56],[19],[57] et sont dominées par le bourgeonnement cicatriciel exubérant et la désunion de la suture, qui entraîne une fistule trachéale. La récidive d'une sténose après chirurgie concerne environ 4 % des patients[56].
Une résection-anastomose n'est toutefois possible qu'en cas de sténose courte. Des manœuvres de libération du larynx en haut et des bronches souches en bas permettent de gagner en souplesse, et la longueur de trachée retirée peut ainsi atteindre 5 à 6 centimètres[58]. Si une longueur de trachée trop importante est retirée, la tension excessive sur les sutures rend l'intervention non réalisable[59],[54]. Chez l'enfant, dans le cadre des sténoses congénitales longues, on réalise alors plutôt une trachéoplastie, qui consiste à élargir par un montage le diamètre de la trachée[60], seule ou associée à un patch de péricarde. La technique a été décrite par Peter Goldstraw et son équipe en 1989[61], puis modifiée par Hermes Grillo en 1994[62].
Le remplacement de trachée par une prothèse, le plus souvent biologique, et la greffe de trachée sont des techniques envisagées lorsque la longueur de trachée à remplacer dépasse 50 % chez l'adulte et 30 % chez l'enfant et n'est pas accessible à un traitement chirurgical standard[63]. Le substitut de remplacement de la trachée doit respecter certains critères[63] : biocompatibilité avec possibilité d'épithélialisation[note 1] par une muqueuse respiratoire, résistance à l'infection et absence d'immunosuppression, en particulier dans un contexte de cancer. Différents types de matériaux sont utilisés : prothèses synthétiques ou bioprothèses, greffe de trachée d'un donneur décédé, autogreffe, ou encore bio-ingénierie. La première allogreffe réalisée avec la trachée d'un donneur décédé a été réalisée en 1979[66]. Le taux de complications élevé de la technique et de ses dérivés est expliqué par l'importance de l'immunité locale et de la microvascularisation du greffon[67]. D'autres techniques ont été essayées[66] : allogreffe de segment d'aorte de donneur décédé, tutoré par une prothèse (2005)[68], greffe de trachée autologue (2010) où une néotrachée est cultivée in vitro par ingénierie cellulaire[69]. Sans greffe, la reconstruction d'un long segment de trachée par un lambeau tutoré par du cartilage prélevé sur les côtes du patient a également été décrite[70]. Il s'agit d'interventions rares, réalisées par des équipes très spécialisées sur des patients soigneusement sélectionnés.
Anesthésie[modifier | modifier le code]
L'intubation des patients porteurs d'une sténose trachéale est difficile en raison du faible calibre interne de la trachée[59],[71]. Lors de l'induction de l'anesthésie générale, l'intubation est généralement réalisée sous contrôle fibroscopique, par le nez, avec une sonde de petit calibre pouvant passer la sténose[59],[71]. La curarisation est autant que possible évitée, afin que le patient endormi respire sans aide jusqu'à l'intubation[59],[72]. Si l'intubation est impossible, une trachéotomie peut être réalisée d'emblée, sous le niveau de la sténose[71]. La trachéotomie permet, comme l'intubation, l'apport de gaz frais dans les poumons. Lorsque tant l'intubation que la trachéotomie sont impossibles, par exemple dans le cas d'une sténose très basse, la chirurgie peut être réalisée sous assistance circulatoire de type ECMO[73]. Dans cette technique de circulation extracorporelle, les échanges gazeux sont assurés par un oxygénateur[74].
Pendant l'intervention, une fois la trachée ouverte, la ventilation se fait généralement par une sonde d'intubation trachéale stérile positionnée dans le champ opératoire, ou par jet ventilation[73]. La jet ventilation se fait par un cathéter fin placé dans la trachée, et qui délivre de l'air pulsé à haute pression[75].
Bronchoscopie interventionnelle[modifier | modifier le code]

La bronchoscopie interventionnelle, ou bronchoscopie rigide, est une technique d'exploration de la trachée et des bronches souches permettant de réaliser certains gestes thérapeutiques sous anesthésie générale, notamment la désobstruction de la trachée et la pose de prothèse[46],[9]. Elle est particulièrement intéressante chez les patients inopérables en raison de leur terrain affaibli[76],[77], et peut être parfois proposée comme mesure d'attente d'une prise en charge chirurgicale[59]. La place de ces techniques tend à augmenter en raison de leur caractère peu invasif, mais ne peut totalement remplacer la chirurgie, en particulier pour les sténoses longues ou très serrées[46].
La désobstruction[9] consiste à retirer le matériel excédentaire qui oblitère la trachée. Elle peut être réalisée à la pince, dans le cas des tumeurs bourgeonnant dans la lumière, mais aussi au laser, par électrocoagulation ou par cryothérapie[33],[10]. Laser et électrocoagulation permettent à la fois l'hémostase d'une lésion hémorragique et la destruction du tissu tumoral[33]. Les risques de la désobstruction, quelle que soit la technique employée, sont dominés par la perforation de la trachée (pouvant elle-même se compliquer de médiastinite, une infection grave des tissus entourant la trachée, causée par la dissémination des germes colonisant les voies aériennes) et le saignement, mais sont rares, et le taux de mortalité est inférieur à 1 %[33]. Enfin, la sténose peut également récidiver après la désobstruction, surtout lorsqu'il s'agit d'une tumeur.
La dilatation, réalisée par gonflement d'un ballonnet dans la sténose ou par introduction de dilatateurs de plus en plus gros, est surtout pratiquée dans les cas de sténoses longues inopérables[10]. Elle est particulièrement réalisée chez l'enfant dans les sténoses congénitales récidivant après une première chirurgie[78].
La pose de prothèse interne, introduite dans la sténose pour maintenir la lumière trachéale ouverte[9], est surtout utilisée dans les sténoses tumorales ou les sténoses post-intubation chez les patients inopérables[77], en particulier si la sténose récidive après une première désobstruction[79]. Les prothèses sont généralement en silicone ou en métal, le plus souvent un alliage de nickel et de titane appelé nitinol[79]. Les premières prothèses ont été développées en 1965 par William W. Montgomery[80] ; elles étaient en forme de T et devaient être introduites par une trachéotomie. En 1990, les premières prothèses cylindriques en silicone, pouvant être introduites par un bronchoscope, sont apparues[81]. En 2016 les nombreux types de prothèses sont répartis en quatre catégories[79] : prothèses en silicone, stent métallique dilaté au ballon, stent métallique auto-expansif et stent métallique couvert. Elles peuvent être cylindriques ou bifurquées en Y, de manière à être positionnées sur la carène. L'utilisation de prothèse dans les sténoses bénignes est réalisée après un ou plusieurs échecs de dilatation[10], et est généralement réservée aux patients inopérables. Les complications principales des prothèses[10] sont la migration de celle-ci (jusqu'à 30 % des cas), son obstruction par des crachats adhérant à la paroi interne, et la formation d'une nouvelle sténose aux extrémités par bourgeonnement de tissu de granulation. Les sténoses du tiers supérieur de la trachée se prêtent peu à la pose de prothèse[10] en raison du taux élevé de migration et du déclenchement de réflexe de toux par irritation des cordes vocales.
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- L'épithélialisation est la régénération de l'épithélium après une perte de substance ou une ulcération. Elle se déroule en deux temps : un bourgeon comble la lésion, puis les cellules épithéliales qui bordent la plaie recouvrent progressivement la lésion en se divisant[64],[65].
Références[modifier | modifier le code]
- (en) Henry Gray, « Splanchnology - The Respiratory Apparatus », dans Anatomy of the Human Body, Philadelphie, Lea & Febiger, (réimpr. 2000) (ISBN 1-58734-102-6, lire en ligne).
- (en) Beate E.M. Brand-Saberi et Thorsten Schäfer, « Trachea », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 1-5 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.09.004, lire en ligne).
- Hitier 2013.
- (en) C. M. Myer, D. M. O'Connor et R. T. Cotton, « Proposed Grading System for Subglottic Stenosis Based on Endotracheal Tube Sizes », Annals of Otology, Rhinology & Laryngology, SAGE Publications, vol. 103, no 4, , p. 319-323 (ISSN 0003-4894, DOI 10.1177/000348949410300410, lire en ligne).
- (en) Scott K Epstein, « Anatomy and Physiology of Tracheostomy », Respiratory Care, American Association for Respiratory Care, vol. 50, no 4, , p. 476-482 (ISSN 1943-3654, lire en ligne).
- (en) M. Brouns, S. T. Jayaraju, C. Lacor, J. De Mey, M. Noppen, W. Vincken et S. Verbanck, « Tracheal stenosis: a flow dynamics study », Journal of Applied Physiology, American Physiological Society, vol. 102, no 3, , p. 1178-1184 (ISSN 8750-7587, DOI 10.1152/japplphysiol.01063.2006, lire en ligne).
- Stoelben 2014.
- « Sténose laryngotrachéale », sur Hôpital Lariboisière, (consulté le ).
- Righini 2014.
- Freitag 2014.
- (en) Thomas V. McCaffrey, « Classification of Laryngotracheal Stenosis », The Laryngoscope, Wiley-Blackwell, vol. 102, no 12, , p. 1335-1340 (ISSN 0023-852X, DOI 10.1288/00005537-199212000-00004, lire en ligne).
- J. Chemli, S. Hassayoun, M. Abroug, S. Abroug, S. Mlika et A. Harbi, « Une cause rare de stridor néonatal : la sténose trachéale congénitale », Journal de Pédiatrie et de Puériculture, Elsevier BV, vol. 22, no 1, , p. 33-36 (ISSN 0987-7983, DOI 10.1016/j.jpp.2008.10.002, lire en ligne).
- (en) Richard J. Hewitt, Colin R. Butler, Elizabeth F. Maughan et Martin J. Elliott, « Congenital tracheobronchial stenosis », Seminars in Pediatric Surgery, Elsevier BV, vol. 25, no 3, , p. 144-149 (ISSN 1055-8586, DOI 10.1053/j.sempedsurg.2016.02.007, lire en ligne).
- (en) Carl Lewis Backer et Constantine Mavroudis, « Congenital anomalies: vascular rings », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- Francis Veyckemans et Jean-Louis Scholtes, « Sténose trachéale congénitale », sur Syndrome & Maladies rares en Pédiatrie : Anesthésie, (consulté le ).
- (en) Hermes C. Grillo, « Congenital and acquired tracheal lesions in children », dans Hermes C. Grillo, Surgery of the Trachea and Bronchi, Hamilton, B. C. Decker, (ISBN 978-1550090581).
- (en) Badr Eldin Mostafa, Lobna El Fiky et Mohammed El Sharnoubi, « Non-intubation traumatic laryngotracheal stenosis: management policies and results », European Archives of Oto-Rhino-Laryngology and Head & Neck, vol. 263, , p. 632–636 (ISSN 0937-4477 et 1434-4726, DOI 10.1007/s00405-006-0036-8, lire en ligne, consulté le )
- (en) Cameron D. Wright, Hermes C. Grillo, John C. Wain, Daniel R. Wong, Dean M. Donahue, Henning A. Gaissert et Douglas J. Mathisen, « Anastomotic complications after tracheal resection: Prognostic factors and management », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 128, no 5, , p. 731-739 (ISSN 0022-5223, DOI 10.1016/j.jtcvs.2004.07.005, lire en ligne).
- (en) S.A.R. Nouraei, E. Ma, A. Patel, D.J. Howard et G.S. Sandhu, « Estimating the population incidence of adult post-intubation laryngotracheal stenosis », Clinical Otolaryngology, vol. 32, no 5, , p. 411–412 (ISSN 1749-4478, DOI 10.1111/j.1749-4486.2007.01484.x).
- A. Brichet, J.-Y. Tavernier, P. Ramon, C. H. Marquette, « Prise en charge des sténoses trachéales postintubation », sur Revue Médicale Suisse, (consulté le ).
- « Sevrage de la ventilation mécanique (à l’exclusion du nouveau-né et du réveil d’anesthésie) », sur Société Française d’Anesthésie et de Réanimation, (consulté le )
- (en) Stefan Welter, « Repair of Tracheobronchial Injuries », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 41-50 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.10.006, lire en ligne).
- (en) Andy C Kiser, Sean M O’Brien et Frank C Detterbeck, « Blunt tracheobronchial injuries: treatment and outcomes », The Annals of Thoracic Surgery, Elsevier BV, vol. 71, no 6, , p. 2059-2065 (ISSN 0003-4975, DOI 10.1016/s0003-4975(00)02453-x, lire en ligne).
- (en) Panagiotis N. Symbas, Alexander G. Justicz et Richard R. Ricketts, « Rupture of the airways from blunt trauma: Treatment of complex injuries », The Annals of Thoracic Surgery, Elsevier BV, vol. 54, no 1, , p. 177-183 (ISSN 0003-4975, DOI 10.1016/0003-4975(92)91177-b, lire en ligne).
- (en) Christina L Costantino et Mathisen, Douglas J., « Idiopathic laryngotracheal stenosis », Journal of Thoracic Disease, vol. 8, no S2, , S204–S209 (DOI 10.3978/j.issn.2072-1439.2016.01.71, lire en ligne).
- (en) Michael B. Gluth, Patrick A. Shinners et Jan L. Kasperbauer, « Subglottic Stenosis Associated With Wegener's Granulomatosis », The Laryngoscope, vol. 113, , p. 1304–1307 (ISSN 1531-4995, DOI 10.1097/00005537-200308000-00008, lire en ligne, consulté le )
- Shu-Jen Chang, Chong-Chen Lu, Yu-Mei Chung et Shinn-Shing Lee, « Laryngotracheal Involvement as the Initial Manifestation of Relapsing Polychondritis », Journal of the Chinese Medical Association, vol. 68, , p. 279–282 (DOI 10.1016/S1726-4901(09)70151-0, lire en ligne, consulté le )
- Grillo 2008.
- Macchiarini 2006.
- (en) C. Paul Yang, Richard P. Gallagher, Noel S. Weiss et Pierre R. Band, « Differences in Incidence Rates of Cancers of the Respiratory Tract by Anatomic Subsite and Histologic Type: An Etiologic Implication », Journal of the National Cancer Institute, vol. 81, , p. 1828–1831 (ISSN 0027-8874 et 1460-2105, PMID 2585530, DOI 10.1093/jnci/81.23.1828, lire en ligne, consulté le )
- (en) Hermes C. Grillo et Douglas J. Mathisen, « Primary tracheal tumors: Treatment and results », The Annals of Thoracic Surgery, vol. 49, , p. 69–77 (ISSN 0003-4975, DOI 10.1016/0003-4975(90)90358-d, lire en ligne, consulté le )
- (en) Nicolas Guibert, Julien Mazieres, Charles-Hugo Marquette, Damien Rouviere, Alain Didier et Christophe Hermant, « Integration of interventional bronchoscopy in the management of lung cancer », Eur Respir Rev, European Respiratory Society (ERS), vol. 24, no 137, , p. 378-391 (ISSN 0905-9180, DOI 10.1183/16000617.00010014, lire en ligne).
- (en) Hidemitsu Tsutsui, Mitsuhiro Kubota, Masae Yamada et Akihiko Suzuki, « Airway stenting for the treatment of laryngotracheal stenosis secondary to thyroid cancer », Respirology, vol. 13, , p. 632–638 (ISSN 1440-1843, DOI 10.1111/j.1440-1843.2008.01309.x, lire en ligne, consulté le )
- (en) J. M. Findlay, G. P. Sadler, H. Bridge et R. Mihai, « Post-thyroidectomy tracheomalacia: minimal risk despite significant tracheal compression », British Journal of Anaesthesia, vol. 106, , p. 903–906 (ISSN 0007-0912 et 1471-6771, PMID 21450708, DOI 10.1093/bja/aer062, lire en ligne, consulté le )
- (en) Amit Agarwal, Anand K. Mishra, Sushil K. Gupta et Farah Arshad, « High Incidence of Tracheomalacia in Longstanding Goiters: Experience from an Endemic Goiter Region », World Journal of Surgery, vol. 31, , p. 832–837 (ISSN 0364-2313 et 1432-2323, DOI 10.1007/s00268-006-0565-8, lire en ligne, consulté le )
- (en) Chitra Kandaswamy et Vijay Balasubramanian, « Review of adult tracheomalacia and its relationship with chronic obstructive pulmonary disease », Current Opinion in Pulmonary Medicine, Ovid Technologies (Wolters Kluwer Health), vol. 15, no 2, , p. 113-119 (ISSN 1070-5287, DOI 10.1097/mcp.0b013e328321832d, lire en ligne).
- « Bruits surajoutés », sur e-semio.org (consulté le ).
- Sonia Ayari-Khalfallah, « Stridor », sur Pas à pas en pédiatrie (consulté le ).
- Gnagi 2015.
- E. Lescanne, S. Pondaven, V. Bouetel, D. Bakhos, V. Lesage et S. Morinière, « Diagnostic des dyspnées laryngées de l’enfant », Encyclopédie Médico-Chirurgicale, Elsevier SAS, (lire en ligne).
- Henning A. Gaissert et James Burns, « The Compromised Airway: Tumors, Strictures, and Tracheomalacia », Surgical Clinics of North America, vol. 90, , p. 1065–1089 (DOI 10.1016/j.suc.2010.06.004, lire en ligne, consulté le )
- (en) A. T. Hillel, S. Karatayli-Ozgursoy, J. R. Benke, S. Best, P. Pacheco-Lopez, K. Teets, H. Starmer et L. M. Akst, « Voice Quality in Laryngotracheal Stenosis: Impact of Dilation and Level of Stenosis », Annals of Otology, Rhinology & Laryngology, SAGE Publications, vol. 124, no 5, , p. 413-418 (ISSN 0003-4894, DOI 10.1177/0003489414564249, lire en ligne).
- Émile Reyt, « Dyspnée laryngée de l’adulte et de l’enfant », sur Université Médicale Virtuelle Francophone, (consulté le ).
- (en) Qihang Chen, Jin Mo Goo, Joon Beom Seo, Myung Jin Chung, Yu-Jin Lee et Jung-Gi Im, « Evaluation of Tracheobronchial Diseases: Comparison of Different Imaging Techniques », Korean J Radiol, The Korean Society of Radiology (KAMJE), vol. 1, no 3, , p. 135 (ISSN 1229-6929, DOI 10.3348/kjr.2000.1.3.135, lire en ligne).
- (en) Matthew T. Brigger et Mark E. Boseley, « Management of tracheal stenosis », Current Opinion in Otolaryngology & Head and Neck Surgery, Ovid Technologies (Wolters Kluwer Health), vol. 20, no 6, , p. 491-496 (ISSN 1068-9508, DOI 10.1097/moo.0b013e328358566d, lire en ligne).
- (en) R. Paul Guillerman, « Newer CT applications and their alternatives: what is appropriate in children? », Pediatr Radiol, Springer Science + Business Media, vol. 41, no S2, , p. 534-548 (ISSN 0301-0449, DOI 10.1007/s00247-011-2163-7, lire en ligne).
- (en) Juan C. Baez, Pierluigi Ciet, Robert Mulkern, Ravi T. Seethamraju et Edward Y. Lee, « Pediatric Chest MR Imaging », Magnetic Resonance Imaging Clinics of North America, Elsevier BV, vol. 23, no 2, , p. 337-349 (ISSN 1064-9689, DOI 10.1016/j.mric.2015.01.011, lire en ligne).
- (en) M. Weinberger et M. Abu-Hasan, « Pseudo-asthma: When Cough, Wheezing, and Dyspnea Are Not Asthma », Pediatrics, American Academy of Pediatrics (AAP), vol. 120, no 4, , p. 855-864 (ISSN 0031-4005, DOI 10.1542/peds.2007-0078, lire en ligne).
- (en) Bastiaan HJ Wittekamp, Walther NKA van Mook, Dave HT Tjan, Jan Zwaveling et Dennis CJJ Bergmans, « Clinical review: Post-extubation laryngeal edema and extubation failure in critically ill adult patients », Critical Care, Springer Nature, vol. 13, no 6, , p. 233 (ISSN 1364-8535, DOI 10.1186/cc8142, lire en ligne).
- (en) Wouter A. Pluijms, Walther NKA van Mook, Bastiaan HJ Wittekamp et Dennis CJJ Bergmans, « Postextubation laryngeal edema and stridor resulting in respiratory failure in critically ill adult patients: updated review », Critical Care, Springer Science + Business Media, vol. 19, no 1, (ISSN 1364-8535, DOI 10.1186/s13054-015-1018-2, lire en ligne).
- (en) Hong Kwan Kim, Young Tae Kim, Sook Whan Sung, June Dong Park, Chang Hyun Kang, Joo Hyun Kim et Yong Jin Kim, « Management of congenital tracheal stenosis1 », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 25, no 6, , p. 1065-1071 (ISSN 1010-7940, DOI 10.1016/j.ejcts.2004.01.038, lire en ligne).
- (en) Dirk Behringer, Stefan Könemann et Erich Hecker, « Treatment Approaches to Primary Tracheal Cancer », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 73-76 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.10.002, lire en ligne).
- Gomez-Caro 2011.
- (en) Alberto de Hoyos et G. Alexander Patterson, « Principles of airway surgery: management of acute critical airway obstruction », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- Auchincloss 1994.
- (en) Gunda Leschber, « Management of Tracheal Surgery Complications », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 107-116 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.09.002, lire en ligne).
- (en) Erich Hecker et Jan Volmerig, « Extended Tracheal Resections », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 85-95 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.10.005, lire en ligne).
- (en) Ahmad Zeeshan, Frank Detterbeck et Erich Hecker, « Laryngotracheal Resection and Reconstruction », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 67-71 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.09.007, lire en ligne).
- (en) Hermes C. Grillo, Cameron D. Wright, Gus J. Vlahakes et Thomas E. MacGillivray, « Management of congenital tracheal stenosis by means of slide tracheoplasty or resection and reconstruction, with long-term follow-up of growth after slide tracheoplasty », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 123, no 1, , p. 145-152 (ISSN 0022-5223, DOI 10.1053/jtc.2002.v123.p0145, lire en ligne).
- (en) Victor Tsang, Andrew Murday, Charles Gillbe et Peter Goldstraw, « Slide tracheoplasty for congenital funnel-shaped tracheal stenosis », Annals of Thoracic Surgery, vol. 48, no 5, , p. 632-635 (ISSN 0003-4975, DOI 10.1016/0003-4975(89)90777-7).
- (en) Hermes C. Grillo, « Slide tracheoplasty for long-segment congenital tracheal stenosis », Annals of Thoracic Surgery, vol. 58, no 3, , p. 613-620 (ISSN 0003-4975, DOI 10.1016/0003-4975(94)90714-5).
- E. Martinod, A. Seguin, D. Radu, C.-H. Marquette et A. Carpentier, « Avancées en chirurgie trachéale : a-t-on enfin trouvé le substitut idéal à la trachée ? », Revue des Maladies Respiratoires, Elsevier BV, vol. 27, no 6, , p. 554-564 (ISSN 0761-8425, DOI 10.1016/j.rmr.2010.04.001, lire en ligne).
- Encyclopédie Larousse en ligne, « épithélialisation », Larousse, (consulté le )
- Christine Brooker, Le corps humain: Étude, structure et fonction, De Boeck Supérieur, (ISBN 9782804134709, lire en ligne), p. 450
- Michel Corniglion, « Historique des greffes de trachée », sur Fédération des Associations pour le Don d'Organes et de Tissus humains (consulté le ).
- (en) Philipp Jungebluth et Paolo Macchiarini, « Airway Transplantation », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 97-106 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.09.005, lire en ligne).
- (en) Alain Wurtz, Henri Porte, Massimo Conti, Catherine Dusson, Jacques Desbordes, Marie-Christine Copin et Charles-Hugo Marquette, « Surgical technique and results of tracheal and carinal replacement with aortic allografts for salivary gland type carcinoma », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 140, no 2, , p. 387-393.e2 (ISSN 0022-5223, DOI 10.1016/j.jtcvs.2010.01.043, lire en ligne).
- (en) Dominique Fabre, Elie Fadel, Sacha Mussot, Fédéric Kolb, Nicolas Leymarie, Olaf Mercier, Thierry Le Chevalier et Philippe G. Dartevelle, « Autologous tracheal replacement for cancer », Chinese Clinical Oncology, AME Publishing Group, vol. 4, no 4, (lire en ligne).
- (en) Dominique Fabre, Sunil Singhal, Vincent De Montpreville, Benoit Decante, Sacha Mussot, Olivier Chataigner, Olaf Mercier, Frederic Kolb, Philippe G. Dartevelle et Elie Fadel, « Composite cervical skin and cartilage flap provides a novel large airway substitute after long-segment tracheal resection », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 138, no 1, , p. 32-39 (ISSN 0022-5223, DOI 10.1016/j.jtcvs.2008.11.071, lire en ligne).
- « Intubation difficile », sur Société Française d’Anesthésie et de Réanimation, (consulté le )
- « Indications de la curarisation en anesthésie », sur Société Française d’Anesthésie et de Réanimation, (consulté le )
- (en) Klaus Wiedemann et Clemens Männle, « Anesthesia and Gas Exchange in Tracheal Surgery », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 13-25 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.10.001, lire en ligne).
- (en) Chang Wan Kim, Do Hyung Kim, Bong Soo Son, Jeong Su Cho, Yeong Dae Kim, Hoseok I et Hyo Yeong Ahn, « The Feasibility of Extracorporeal Membrane Oxygenation in the Variant Airway Problems », Annals of Thoracic and Cardiovascular Surgery, Editorial Committee of Annals of Thoracic and Cardiovascular Surgery, vol. 21, no 6, , p. 517-522 (ISSN 1341-1098, DOI 10.5761/atcs.oa.15-00073, lire en ligne).
- (en) Elen Evans, Peter Biro et Nigel Bedforth, « Jet ventilation », Contin Educ Anaesth Crit Care Pain, Oxford University Press (OUP), vol. 7, no 1, , p. 2-5 (ISSN 1743-1816, DOI 10.1093/bjaceaccp/mkl061, lire en ligne).
- (en) Sandro Batzella, Gabriele Lucantoni, Alfonso Fiorelli, Raffaele Dello Iacono, Paolo Battistoni, Umberto Caterino, Mario Santini et Giovanni Galluccio, « A new endoscopic hand drill for management of tracheal stenosis », Interact CardioVasc Thorac Surg, Oxford University Press (OUP), vol. 23, no 1, , p. 168-170 (ISSN 1569-9293, DOI 10.1093/icvts/ivw068, lire en ligne).
- (en) Nikolaos Charokopos, Christophoros N. Foroulis, Efi Rouska, Maria N. Sileli, Nikolaos Papadopoulos et Christos Papakonstantinou, « The management of post-intubation tracheal stenoses with self-expandable stents: early and long-term results in 11 cases », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), (ISSN 1010-7940, DOI 10.1016/j.ejcts.2010.12.042, lire en ligne).
- (en) Martin Elliott, Derek Roebuck, Clair Noctor, Clare McLaren, Ben Hartley, Quen Mok, Catherine Dunne, Nick Pigott, Chirag Patel, Alpesh Patel et Colin Wallis, « The management of congenital tracheal stenosis », International Journal of Pediatric Otorhinolaryngology, Elsevier BV, vol. 67, , S183-S192 (ISSN 0165-5876, DOI 10.1016/j.ijporl.2003.08.023, lire en ligne).
- Chin 2008.
- (en) W. W. Montgomery, « T-Tube Tracheal Stent », Archives of Otolaryngology - Head and Neck Surgery, American Medical Association (AMA), vol. 82, no 3, , p. 320-321 (ISSN 0886-4470, DOI 10.1001/archotol.1965.00760010322023, lire en ligne).
- (en) Jean-François Dumon, « A Dedicated Tracheobronchial Stent », Chest, Elsevier BV, vol. 97, no 2, , p. 328-332 (ISSN 0012-3692, DOI 10.1378/chest.97.2.328, lire en ligne).
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
Articles scientifiques[modifier | modifier le code]
Physiopathologie des sténoses trachéales :
- M. Hitier, M. Loäec, V. Patron, E. Edy et S. Moreau, « Trachée : anatomie, physiologie, endoscopie et imagerie », EMC - Oto-rhino-laryngologie, Elsevier BV, vol. 8, no 2, , p. 1-18 (ISSN 0246-0351, DOI 10.1016/s0246-0351(12)55897-6, lire en ligne).
- C.A. Righini, G. Ferretti, C. Pison et E. Reyt, « Sténoses trachéales de l'adulte », EMC - Oto-rhino-laryngologie, vol. 10, no 1, , p. 1-15 (lire en ligne).
- (en) Paolo Macchiarini, « Primary tracheal tumours », The Lancet Oncology, vol. 7, , p. 83–91 (ISSN 1470-2045 et 1474-5488, DOI 10.1016/s1470-2045(05)70541-6, lire en ligne, consulté le ).
- (en) Erich Stoelben, Aris Koryllos, Frank Beckers et Corinna Ludwig, « Benign Stenosis of the Trachea », Thoracic Surgery Clinics, vol. 24, no 1, , p. 59-65 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.09.001).
- (en) S. H. Gnagi, B. E. Howard, C. Anderson et D. G. Lott, « Idiopathic Subglottic and Tracheal Stenosis: A Survey of the Patient Experience », Annals of Otology, Rhinology & Laryngology, SAGE Publications, vol. 124, no 9, , p. 734-739 (ISSN 0003-4894, DOI 10.1177/0003489415582255, lire en ligne).
Traitement chirurgical :
- (en) A. Gomez-Caro, A. Morcillo, R. Wins, L. Molins, G. Galan et V. Tarrazona, « Surgical management of benign tracheal stenosis », Multimedia Manual of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 2011, no 1111, (ISSN 1813-9175, DOI 10.1510/mmcts.2010.004945, lire en ligne).
- (en) Hugh G. Auchincloss et Cameron D. Wright, « Complications after tracheal resection and reconstruction: prevention and treatment », Journal of Thoracic Disease, vol. 8 (Suppl 2), , S160–S167 (ISSN 2072-1439, DOI 10.3978/j.issn.2072-1439.2016.01.86, lire en ligne).
Traitement bronchoscopique :
- (en) Cynthia S. Chin, Virginia Litle, Jaime Yun, Todd Weiser et Scott J. Swanson, « Airway Stents », The Annals of Thoracic Surgery, Elsevier BV, vol. 85, no 2, , S792-S796 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2007.11.051, lire en ligne).
- (en) Lutz Freitag et Kaid Darwiche, « Endoscopic Treatment of Tracheal Stenosis », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 1, , p. 27-40 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2013.10.003, lire en ligne).
Ouvrages de référence[modifier | modifier le code]
- (en) Michael A. Maddaus et F. Griffith Pearson, « Post-intubation injury », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- (en) Hermes C. Grillo, « Idiopathic laryngotracheal stenosis », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- (en) Henning A. Gaissert et Douglas J. Mathisen, « Primary tumors of the trachea », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- (en) Dennis A. Wigle et Shaf Keshavjee, « Upper airway tumors: secondary tumors », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon (Toni) E. M. R. Lerut, James D. Luketich, Thomas W. Rice et F. Griffith Pearson, Pearson's Thoracic and Œsophageal Surgery, Philadelphia, Churchill Livingstone, , 3e éd. (ISBN 978-0-443-06861-4).
- (en) Hermes C. Grillo, Surgery of the Trachea and Bronchi, Hamilton, B. C. Decker, (ISBN 978-1550090581).
Liens externes[modifier | modifier le code]
Sténose trachéale congénitale :
- « Informations sur la sténose de trachée », sur Centre hospitalier universitaire vaudois (consulté le ).
- « Sténose trachéale congénitale », sur Orphanet (consulté le ).
Sténose trachéale bénigne :
- A. Brichet, J.-Y. Tavernier, P. Ramon, C. H. Marquette, « Prise en charge des sténoses trachéales postintubation », sur Revue Médicale Suisse, (consulté le ).
- « Sténose laryngotrachéale », sur Hôpital Lariboisière, (consulté le ).
- « Chirurgie des sténoses laryngotrachéales de l’adulte », sur Encyclopédie médicale Medix, (consulté le ).
Articles connexes[modifier | modifier le code]
Anatomie et physiologie :
- Anatomie normale de la trachée ;
- Loi de Poiseuille et écoulement laminaire.
Histoire de la chirurgie trachéale :


 French
French Deutsch
Deutsch



