Chimica nucleare

La chimica nucleare è un settore della chimica che tratta le reazioni che cambiano la natura del nucleo. Per reazione chimica si intende la modificazione dei legami che tengono uniti tra loro gli atomi di molecole diverse, che reagiscono tra loro. Il fenomeno chimico-fisico studiato dalla chimica nucleare è la radioattività e la grandezza fisica corrispondente nel Sistema Internazionale è l'attività (unità di misura il becquerel, Bq; 1 Bq = 1 s−1 = 1 Hz = 1 disintegrazione nucleare al secondo).
Nelle reazioni nucleari, invece, non cambiano solo le molecole e i legami che le formano, ma si modificano gli stessi atomi ed i loro nuclei. Mentre la fisica nucleare si occupa più particolarmente degli aspetti energetici e delle particelle implicate in una trasformazione nucleare, la chimica nucleare si concentra piuttosto sulla sintesi di nuovi elementi, sullo studio delle proprietà dei nuclidi radioattivi (caratterizzati dal numero atomico Z e numero di massa A), denominati isotopi o isomeri (isotopi uguali che differiscono solamente per il diverso stato eccitato) qualora appartenenti allo stesso elemento chimico (oppure isobari, isotoni, e isodiaferi in altri casi), e su tutte le possibili applicazioni teorico-pratiche del fenomeno della radioattività e a particolari interazioni energetiche del nucleo atomico (ad esempio NMR, spettroscopia Mössbauer e spettroscopia di annichilazione di positroni (PAS)).
La radiochimica, in particolare, è la principale branca applicata della chimica nucleare: essa si occupa, in senso lato, di reazioni chimiche che implicano l'uso di sostanze radioattive. La chimica radiofarmaceutica si occupa della sintesi e della caratterizzazione di composti radioattivi da utilizzare in radiodiagnostica e radioterapia metabolica (medicina nucleare). La chimica delle radiazioni studia le reazioni chimiche indotte da radiazioni ionizzanti. La chimica degli atomi esotici studia le proprietà e le applicazioni di quasi-atomi come il positronio, il muonio, gli antiatomi. La chimica degli atomi transfermici e ultrapesanti studia le proprietà chimiche di elementi (artificiali) di numero atomico da 101 a 118.
Un atomo è costituito da un nucleo interno composto da protoni e neutroni e da un certo numero di elettroni (pari a quello dei protoni, se l'atomo è neutro). Una reazione chimica nucleare determina una variazione nel numero di nucleoni, cioè di protoni e neutroni (che compongono il nucleo), tra le specie che ne prendono parte. Inoltre vengono emesse radiazioni ionizzanti come i raggi X e i raggi gamma.
Nelle reazioni nucleari non vige la legge di conservazione di massa di Lavoisier (tipica invece delle reazioni chimiche) mentre vale la legge di conservazione dell'energia e la legge di conservazione della carica elettrica.
Particolari reazioni nucleari sono i decadimenti radioattivi, la fissione nucleare, la fusione nucleare, e il bombardamento atomico. L'energia solare è un classico esempio della potente energia nucleare sviluppata da un tale fenomeno. Alcune reazioni nucleari hanno permesso di indagare il nucleo più intimamente (hanno consentito, per esempio, l'individuazione dei protoni e dei neutroni), oppure di realizzare artificialmente atomi non presenti in natura. Piccole quantità di sostanze radioattive vengono oggigiorno ampiamente utilizzate in elettronica per vari scopi.
I reattori nucleari a fissione sfruttano attualmente la fissione del nucleo per produrre energia elettrica e calore, ma ne è anche auspicato l'utilizzo per la produzione di idrogeno o idricità (hydricity). Attualmente si sta lavorando alla ingegnerizzazione a livello industriale di reattori per fusione nucleare che permetterebbero in futuro di abbinare ai vantaggi dell'energia nucleare un livello di sicurezza operativa altamente elevato (si abbatterà l'emissione di radiazioni).
Storia[modifica | modifica wikitesto]

Dopo la scoperta dei raggi X da parte di Wilhelm Röntgen, molti scienziati cominciarono a lavorare sulle radiazioni ionizzanti. Uno di questi fu Henri Becquerel, che studiò la relazione tra la fosforescenza e l'impressionamento delle lastre fotografiche. Quando Becquerel (lavorando in Francia) scoprì che, senza nessuna fonte di energia esterna presente, l'uranio era in grado di generare raggi che potevano impressionare una lastra fotografica, fu scoperta la radioattività. Marie Curie (a Parigi) e suo marito Pierre Curie isolarono due nuovi elementi radioattivi da minerali di uranio. Usarono metodi radiometrici per identificare la quantità di radiazione presente dopo ciascuna separazione chimica; essi separarono l'uranio minerale in ciascuno dei differenti elementi chimici allora noti, e misurarono la radioattività di ciascuna frazione ottenuta. Tentarono quindi di separare ulteriormente queste frazioni radioattive, per isolare una frazione più piccola con una elevata attività specifica (radioattività per massa unitaria). In questo modo, isolarono il polonio e il radio. Verso il 1901 fu notato che elevate dosi di radiazione erano in grado di causare danni agli esseri umani: Becquerel trasportò con sé un campione di radio nella tasca e a causa della elevata dose di radiazione localizzata a cui fu esposto subì una ustione da radiazioni[1] che aprì il campo allo studio degli effetti biologici delle radiazioni, che a loro volta permisero lo sviluppo di trattamenti medici.
Ernest Rutherford, lavorando in Canada e in Inghilterra, mostrò che il decadimento radioattivo può essere descritto da una semplice equazione differenziale lineare (una equazione cinetica del primo ordine), implicando che una data sostanza radioattiva possiede una caratteristica emivita (il tempo necessario affinché la massa si riduca della metà del valore originario). Egli coniò anche i termini raggi alfa, beta, e gamma, convertì l'azoto in ossigeno, e cosa più importante diresse quello che è noto come esperimento di Rutherford e che mostrò che il modello atomico di Thomson era errato. Nel "modello a panettone", proposto da Thomson nel 1904, l'atomo è composto da elettroni circondati da una "nuvola" di cariche positive che bilanciano la carica negativa degli elettroni. Secondo Rutherford, il suo esperimento implicava che la carica positiva fosse in un nucleo molto piccolo conducendo al modello atomico di Rutherford, e successivamente al modello di Bohr, dove il nucleo positivo è circondato da elettroni negativi.
Nel 1934 la figlia di Marie Curie, Irène Joliot-Curie, e suo marito furono i primi a creare la radioattività artificiale: bombardarono il boro con particelle alfa per creare l'isotopo 137N; questo isotopo decade emettendo positroni.[2] Inoltre, bombardarono l'alluminio e il magnesio con neutroni per creare nuovi radioisotopi.
Reazioni nucleari[modifica | modifica wikitesto]
Nelle reazioni nucleari, a differenza delle reazioni chimiche che coinvolgono i legami fra atomi o molecole, si ha un cambiamento riguardante la natura del nucleo atomico. In tali reazioni, piuttosto che la conservazione della massa totale, vale la conservazione del numero atomico (Z) e del numero di massa (A). Ad esempio, si consideri il bombardamento dell'azoto-14 con particelle α:
- 147N + 42α → 178O + 11H
si nota che a sinistra compare un A totale uguale a 18 (14+4), così come vale 18 (17+1) tra i prodotti di reazione. Allo stesso modo, Z totale a sinistra vale 9 (7+2) così come è pari a 9 (8+1) per i prodotti.
La spettrometria di massa ha permesso la misura quantitativa del difetto di massa, ovvero la quantità di massa che è stata convertita in energia passando dai reagenti ai prodotti finali di una reazione nucleare. L'energia corrispondente si ricava applicando l'equazione di Einstein E=mc2: ad esempio per il consumo di 1 u di materia (1,66 · 10−27 kg) si calcola una energia pari a 933 MeV.
Decadimento radioattivo[modifica | modifica wikitesto]
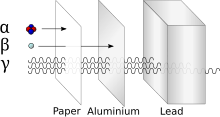
I nuclidi instabili sono soggetti a decadimento radioattivo. Esistono principalmente tre tipi di decadimento il decadimento α, β e quello γ.
Il decadimento α, caratteristico dei nuclei pesanti che presentano numero atomico superiore a 83 e numero di massa maggiore di 200, è causato dalla repulsione coulombiana tra i protoni. In questo genere di decadimento viene prodotta una particella α (in realtà rappresenta un nucleo 42He2+):
- 23892U → 23490Th + 42α
- 23290Th → 22888Ra + 42α
Il decadimento β implica la formazione di due diversi tipi di particelle indicate rispettivamente β- (elettroni ad alta energia) e β+ (positroni ad alta energia). Il decadimento β- si verifica soprattutto quando il rapporto tra neutroni e protoni è molto elevato; un neutrone si converte in un protone:
- 23491Pa → 23492U + 0-1β-
- 146C → 147N + 0-1β-
Il decadimento β+ è invece caratteristico dei nuclidi che presentano un rapporto tra neutroni e protoni molto basso; un protone è convertito a neutrone:
- 3015P → 3014Si + 0+1β+
- 116C → 115B + 0+1β+
Il decadimento β è accompagnato anche dall'emissione di altre particelle come i neutrini.
Il decadimento γ produce radiazione elettromagnetica sotto forma di raggi γ, dotati di lunghezza d'onda tipicamente minore di 10−12 m. Un esempio di processi che porta alla produzione di raggi γ riguarda la formazione di un nuclide eccitato di nichel-60:
- 6027Co → 6028Ni* + 0-1β- + γ
- 6028Ni* → 6028Ni + γ
Alcuni nuclidi, per aumentare il rapporto tra neutroni e protoni, possono dare la cattura di un elettrone orbitante con trasformazione di un protone in neutrone:
- 6531Ga + 0-1e- → 6530Zn
I raggi γ rappresentano la radiazione con maggiore potere penetrante e per questo risultano le più pericolose per l'effetto ionizzante che inducono.
I radionuclidi possono generare una catena di decadimento composta da una serie di decadimenti radioattivi, nell'arco di una data scala temporale, che si concludono con la formazione di un nuclide stabile. Ad esempio, la serie del radio parte da 23892U e si conclude con la formazione del nuclide di piombo-208.
La cinetica del decadimento è del primo ordine e segue quindi l'equazione dove n è il numero di nuclidi, λ è la costante di decadimento e t il tempo trascorso.
Fissione nucleare[modifica | modifica wikitesto]

La fissione nucleare fu scoperta da Otto Hahn e il suo assistente Fritz Strassmann nel 1938 a Berlino-Dahlem (Istituto Kaiser Wilhelm di Chimica).
I grossi nuclei possono dare fissione spontanea o fissione nucleare indotta dal bombardamento con neutroni. In questo processo vengono formati una serie di nuclei più piccoli, ad esempio bombardando l'uranio-235 (l'isotopo fissile dell'uranio) si possono ottenere:
- 23592U + 10n → 9037Rb + 14455Cs + 2 10n
- 23592U + 10n → 8735Br + 14657La + 3 10n
- 23592U + 10n → 7230Zn + 16062Sm + 4 10n
Come si nota dalle reazioni, a partire da un neutrone iniziale si produce un numero multiplo di neutroni: questi sono in grado di alimentare la fissione di un numero crescente di nuclei di uranio-235 e, se questi ultimi sono presenti in quantità corrispondente alla massa critica, si può avere il verificarsi di una reazione a catena.
La fissione controllata dell'uranio è utilizzata per scopi civili nella produzione di corrente elettrica grazie alle centrali nucleari.
Un altro importante isotopo fissile è il plutonio-239, utilizzabile nei reattori autofertilizzanti, ma di contro dotato di una elevata radioattività tale da renderlo altamente pericoloso.
Fusione nucleare[modifica | modifica wikitesto]

Con la fusione nucleare i nuclei molto leggeri si combinano fra loro formando un nuovo isotopo più pesante. Su tale processo si basa l'enorme energia prodotta dal Sole e da altre stelle in seguito allo conversione dell'idrogeno in elio:
- 11H + 11H → 21H + 0+1β+
- 21H + 11H → 32He
- 32H + 11H → 42He + 0+1β+
il cui risultato totale è quindi
- 4 11H → 42He + 2 0+1β+
Una reazione di fusione nucleare è stata riprodotta artificialmente con la detonazione della bomba H, utilizzando la fissione come innesco. La ricerca attuale è volta alla possibilità di rendere pratico l'utilizzo della fusione in future centrali nucleari, che presenterebbero tra i vantaggi la formazione di isotopi stabili come quelli dell'elio-4 e la possibilità di utilizzo di materie prime maggiormente disponibili in natura (si pensi al deuterio presente in tutta l'idrosfera). Di contro, le elevate temperature richieste per superare la repulsione elettrostatica tra i nuclei (l'energia di barriera) rappresenta il problema principale nel riprodurre su vasta scala il processo di fusione. Una reazione oggetto di studio per una futura applicazione è il seguente processo a due stadi che utilizza deuterio, trizio (sintetizzabile a partire dallo stesso deuterio) e litio:
- 21H + 31H → 42He + 10n
- 21H + 31H → 42He + 10n
La realizzazione della fusione fredda supererebbe i problemi legati alle elevate temperature richieste.
Nucleosintesi degli elementi[modifica | modifica wikitesto]
Le moderne teorie scientifiche affermano che poche ore dopo il Big Bang la temperatura diminuì di tanto da permettere la condensazione delle nubi di idrogeno ed elio con la formazione delle prime stelle. L'influsso della gravità avrebbe creato nel loro interno valori di temperatura e densità talmente elevate da consentire processi di fusione nucleare. In particolare, si è notato che quando nuclei leggeri si fondono formando elementi con numero atomico minore o uguale a 26, numero atomico corrispondente al ferro e che identifica il massimo livello di stabilità energetica di un nucleo, si libera energia: tale processo viene definito combustione nucleare e gli elementi formatisi costituiscono le "ceneri" di combustione (combustione nucleare da non confondere con la combustione chimica).
Il ciclo dell'elio consiste in un ciclo di combustione nucleare che sfrutta nuclei 42He (particelle α). Ad esempio, l'isotopo del carbonio 1216C si ottiene in seguito a reazioni del tipo
- 42He + 42He → 84Be + γ
- 84Be + α → 126C + γ
Elementi molto leggeri quali litio, berillio e boro non sono prodotti terminali stabili del ciclo dell'elio. Si pensa che piuttosto essi siano prodotti in seguito a processi di spallazione per urto con particelle di alta energia.
La nucleosintesi degli elementi più pesanti implica invece una varietà di processi in cui entrano in gioco catture di neutroni e decadimenti. Ad esempio, neutroni derivanti da reazioni nucleari di elementi più leggeri, come in
- 2310Ne + α → 2612Mg + 10n
possono generare una serie di reazioni che, ad esempio, possono scaturire nella formazione del nucleo figlio 9943Tc:
- 9842Mo + 10n → 9942Mo + γ
- 9942Mo → 9943Tc + 0-1β + ν (neutrino)
Una supernova rappresenta una fonte naturale di intenso flusso di neutroni.
Sfruttando potenti acceleratori di particelle e reazioni di bombardamento (vedi bombardamento atomico) indotte artificialmente, è possibile effettuare la nucleosintesi artificiale ottenendo nuovi isotopi non presenti in natura, isotopi aventi ciascuno un diverso livello di stabilità, e sintetizzare nuovi elementi la cui esistenza viene dapprima postulata da studi teorici.
Sintesi degli elementi transuranici[modifica | modifica wikitesto]
Vengono definiti elementi transuranici una serie di elementi chimici successivi all'uranio nella tavola periodica, ovvero che presentano numero atomico maggiore di 92. Rappresentano un'importante classe di elementi sintetici la cui chimica è un oggetto di studio che rientra nell'ambito della chimica nucleare. I primi due elementi transuranici, il nettunio (P.A. 93) e il plutonio (P.A. 94), furono sintetizzati nel 1940 aprendo il campo alle successive teorie e scoperte che hanno permesso di sintetizzare elementi in precedenza previsti solamente a livello teorico.
Edwin McMillan e Philip Hauge Abelson sintetizzarono il nettunio bombardando l'uranio con neutroni lenti:
- 23892U + 10n → 23992U + γ
- 23992U (t1/2=23,5 min) → 23993Np + β-
L'elemento successivo, il plutonio, fu sintetizzato da Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy e A. C. Wahl bombardando l'uranio con un deuterone:
- 23892U + 21H → 23893Np + 2 10n
- 23893Np (t1/2=2,12 giorni) → 23894Pu + β-
Fino al 1970 si pensava che gli elementi della tavola periodica sintetizzabili nella pratica potessero arrivare fino al peso atomico di circa 108, a causa della brevissima emivita teorizzata per gli elementi più pesanti. Tuttavia teorie successive hanno previsto la particolare stabilità di certi elementi con un ben determinato numero di protoni e di neutroni, il cosiddetto numero magico. Ad esempio, il nucleo con 114 protoni e 184 neutroni (238Fl) godrebbe di particolare stabilità nonostante le sue dimensioni. Questo genere di elementi vengono definiti elementi superpesanti.
Isotopi[modifica | modifica wikitesto]
Per una descrizione panoramica degli isotopi si veda la tabella degli isotopi.
Effetti isotopici[modifica | modifica wikitesto]
Gli effetti isotopici consistono in una serie di effetti osservati quando in un composto chimico viene incorporato un isotopo in sostituzione di un atomo dello stesso elemento. Gli isotopi di uno stesso elemento chimico possiedono proprietà chimiche pressoché identiche, ma l'effetto isotopico è in grado di influenzare l'equilibrio chimico o la velocità di reazione in seguito alla modificazione delle proprietà vibrazionali e rotazionali della molecola.
Considerando la generica reazione di scambio isotopico
- AX + BX* AX* + BX
l'equilibrio risulterà maggiormente discostato in funzione dell'entità dell'effetto isotopico, effetto che può essere trascurato quando il numero atomico è minore a 10.[3] Ad esempio, sostituendo nell'acqua un isotopo di prozio con uno di deuterio tramite la reazione
- H2H(g) + H2O(l) H2(g) + 2HOH(l)
si ha un marcato spostamento verso destra rispetto al caso in cui X=X*. Un minore effetto isotopico sull'equilibrio si osserva scambiando carbonio-12 e carbonio-14.
L'effetto isotopico che riguarda la velocità di reazione è noto come effetto isotopico cinetico. Questo effetto viene sfruttato nello studio dei meccanismi di reazione analizzando la variazione della velocità di reazione. La differente energia vibrazionale del legame che coinvolge i due isotopi, per esempio un legame C-H e uno C-2H, dovuta alle masse diverse, si traduce in una differente energia di attivazione associata alla rottura del legame, quest'ultimo requisito necessario affinché si formi un nuovo composto. Nel caso dell'esempio citato, l'energia di attivazione per la scissione del legame C-2H è maggiore di quella per la scissione del legame C-H, per cui quest'ultima risulta cineticamente favorita; la scissione del legame tra carbonio e deuterio è un processo più lento.
Questi appena elencati sono effetti isotopici chimici. Esistono anche effetti isotopici fisici, come la differente velocità di effusione o la diversa pressione di vapore.
Separazione chimica degli isotopi[modifica | modifica wikitesto]
Gli isotopi di elementi chimici differenti, presenti in miscela, possono essere separati attraverso diversi metodi chimici. Ad esempio, si può procedere a una reazione chimica che tende a formare un composto maggiormente volatile, in modo da potere successivamente separare in modo agevole quest'ultimo. Altri metodi utilizzano l'elettrolisi, l'estrazione con solvente, lo scambio ionico e la precipitazione.
Quando invece occorre separare due isotopi di uno stesso elemento, come quelli prodotti dal bombardamento con neutroni ed emissione γ (n,γ), non si possono sfruttare metodi chimici basati sulle differenti proprietà chimiche. Si ricorre allora all'effetto Szilard–Chalmers:[4] se la reazione nucleare è accompagnata dalla scissione omolitica del legame chimico, provocata dalla radiazione γ emessa, i radicali dell'isotopo prodotto possono essere separati dall'isotopo target. Si consideri ad esempio la formazione dell'isotopo di iodio 12853I a partire dal bombardamento di 12753I presente sotto forma di ioduro di etile: si producono radicali di iodio-128 che si combinano formando la molecola di iodio 12853I2, che può essere separata dallo ioduro di etile attraverso la riduzione con solfito di sodio in soluzione acquosa.
Ciclo del combustibile nucleare[modifica | modifica wikitesto]

La chimica nucleare è attivamente impegnata nello studio e applicazione di tutte le operazioni implicate nella produzione di combustibile nucleare, dalla estrazione mineraria al trattamento del minerale e arricchimento allo scopo di ottenere il combustibile finale.
L'arricchimento è la fase del ciclo del combustibile nucleare volta ad aumentare il contenuto in isotopo fissile, ovvero l'isotopo che può essere utilmente sfruttato per la fissione nucleare. Nel caso dell'uranio si tratta di aumentare il contenuto di uranio-235 e procedere a successiva separazione dall'isotopo di uranio-238, che costituisce la materia prima di partenza (si veda uranio arricchito per approfondire).
Altro oggetto di interesse è anche la gestione del combustibile esausto e il suo riprocessamento. Il PUREX (plutonium and uranium recovery by extraction) è il metodo di scelta attuale che consente di recuperare, dopo averne ottenuto i rispettivi nitrati trattando con soluzione di acido nitrico, l'uranio e il plutonio dal combustibile esausto sfruttando una estrazione liquido-liquido con una miscela tributilfosfato-cherosene e la successiva separazione chimica dei due elementi.
Branche della chimica nucleare[modifica | modifica wikitesto]
Radiochimica[modifica | modifica wikitesto]
La radiochimica è la branca della chimica nucleare che sfrutta la radioattività e impiega le sostanze radioattive in reazioni chimiche. Un vasto campo di questa disciplina riguarda le metodiche radioanalitiche, che utilizzano solitamente l'attivazione neutronica, la diluizione isotopica e le titolazioni radiochimiche per determinazioni quantitative di analiti. La datazione radiometrica consente invece di datare un campione sfruttando la cinetica del decadimento radioattivo. La radiochimica si applica anche allo studio dell'equilibrio chimico e della cinetica chimica. La radioterapia e la radiodiagnostica fanno uso di sostanze radioattive.
Chimica delle radiazioni[modifica | modifica wikitesto]
La chimica delle radiazioni è la branca della chimica nucleare che studia gli effetti chimici delle radiazioni ionizzanti sulla materia. Le radiazioni ionizzanti possono interagire formando specie altamente reattive quali l'elettrone solvatato, ioni e radicali liberi. Ad esempio irraggiando in questo modo l'acqua si formano, attraverso una successione di reazioni, specie quali H2O+, ·OH, H· e O·. La comprensione di questo genere di fenomeni chimici indotti è utile nella ricerca di nuovi percorsi di sintesi e nell'ambito dello studio dei danni biologici dovuti a esposizione alle radiazioni.
Note[modifica | modifica wikitesto]
- ^ W.C.G. Peh, The discovery of radioactivity and radium, Singapore Med J 1996; Vol 37:627-630 [1]
- ^ (EN) Biografia su nobelprize.org
- ^ Loveland, Morrissey, Seaborg, p.106.
- ^ Leo Szilard, T.A. Chalmers, Chemical Separation of the Radioactive Element from its Bombarded Isotope in the Fermi Effect, in Nature, vol. 134, 1934, pp. 462-462, DOI:10.1038/134462b0.
Bibliografia[modifica | modifica wikitesto]
- V. Loveland, D.J. Morrissey; G.T. Seaborg, Modern nuclear chemistry, John Wiley & Sons, 2006, ISBN 978-0-471-11532-8.
Voci correlate[modifica | modifica wikitesto]
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Division of Nuclear and Radiochemistry of EuCheMS, su euchems.org. URL consultato il 6 dicembre 2006 (archiviato dall'url originale il 19 novembre 2006).
- (EN) International Nuclear Chemistry Society (INCS), su incs.ege.edu.tr. URL consultato il 25 novembre 2006 (archiviato dall'url originale il 29 giugno 2007).
- (EN) Journal of Radioanalytical and Nuclear Chemistry, su springerlink.metapress.com.
- (EN) IUPAC Gold Book, "nuclear chemistry", su goldbook.iupac.org.
| Controllo di autorità | Thesaurus BNCF 18799 · LCCN (EN) sh85092951 · GND (DE) 4138530-5 · J9U (EN, HE) 987007536109205171 · NDL (EN, JA) 00576324 |
|---|


 French
French Deutsch
Deutsch
