Pirene
| Pirene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| pirene | |
| Nomi alternativi | |
| benzo[d,e,f]fenantrene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C16H10 |
| Massa molecolare (u) | 202,255 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| Numero EINECS | 204-927-3 |
| PubChem | 31423 |
| SMILES | C1=CC2=C3C(=C1)C=CC4=CC=CC(=C43)C=C2 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,271 |
| Solubilità in acqua | 0,146 mg/L (a 25 °C) |
| Temperatura di fusione | 156 °C (429,15 K)[1] |
| Temperatura di ebollizione | 393,5 °C (666,65 K)[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 473÷493[1] |
| Simboli di rischio chimico | |
 | |
| attenzione | |
| Frasi H | 410 |
| Consigli P | 273 - 501 [2][3] |
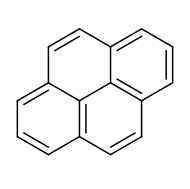
Il pirene è un idrocarburo tetraciclico benzenoide avente formula C16H10 e costituito da 4 anelli benzenici condensati che condividono con gli altri anelli due o tre lati del proprio anello, e non uno solo, come accade nella serie degli aceni (come nell'antracene) o in quella dei fenaceni[4] (come nel fenantrene). La molecola è planare, altamente simmetrica (gruppo puntuale D2h),[5] con tutti gli atomi di carbonio ibridati sp2.
Struttura molecolare e aromaticità[modifica | modifica wikitesto]
Sebbene sia annoverato tra gli idrocarburi policiclici aromatici (IPA), la sua molecola contiene un totale di 16 elettroni π (4n elettroni, con n = 4), rientrando così, formalmente, tra gli idrocarburi antiaromatici secondo la regola di Hückel, la quale però è strettamente valida solo per composi monociclici.[6]
Tuttavia, il pirene può esser visto come un [14]annulene (che è aromatico con n = 3, ma non benzenoide, e non molto stabile) che racchiude all'interno un doppio legame >C=C< connesso all'anello esterno nelle posizioni 3a, 5a, 8a, 10a. A tal proposito, si trova che il suo derivato 15,16-trans-dimetildiidropirene è aromatico,[7] come mostra lo spostamento chimico negativo dei metili nella risonanza magnetica protonica.[8]
Oppure può essere considerato come un bifenile (anch'esso aromatico, benzenoide e molto stabile) cui si aggiungono due ponti vinilene (HC=CH) nelle stesse posizioni. Quest'ultima ipotesi è avvalorata, da un punto di vista teorico, dalla regola di Clar[9][10] dei sestetti aromatici benzenoidi[11] e, dal punto di vista sperimentale, dal fatto che significativi prodotti dell'idrogenazione catalitica del pirene sono quelli che derivano dalla rimozione dei due doppi legami C(4)=C(5) e C(9)=C(10), cioè quelli dei ponti vinilene, lasciando così la struttura del bifenile (altri prodotti lasciano la struttura del naftalene).[12]
Nonostante il pirene sia un sistema di 4n elettroni π, il suo carattere è stato riconosciuto come aromatico nel suo complesso attraverso calcoli quantomeccanici teorici[13] e la valutazione della sua energia di stabilizzazione per risonanza nell'ambito della teoria del legame di valenza.[14]
Proprietà[modifica | modifica wikitesto]
A temperatura ambiente il pirene è un solido cristallino incolore pressoché insolubile in acqua, ma facilmente solubile in alcool, etere, benzene, toluene, solfuro di carbonio, ma molto poco in tetracloruro di carbonio. Il pirene mostra intense bande di assorbimento nella regione del vicino ultravioletto e, sia come solido, che nelle sue soluzioni, mostra leggera fluorescenza blu.[15]
In natura è contenuto nell'olio di catrame di carbon fossile; è presente, insieme ad altri composti policiclici aromatici, nel mezzo interstellare; si forma durante la combustione incompleta dei composti organici, compreso il legno, come negli incendi boschivi.[16]
Viene utilizzato nella produzione di coloranti e loro precursori (ad esempio la piranina).
È un composto tossico per i reni e per il fegato.

Note[modifica | modifica wikitesto]
- ^ a b c Copia archiviata, su biade.itrust.de. URL consultato il 13 agosto 2011 (archiviato dall'url originale il 13 agosto 2011).
- ^ Sigma Aldrich; rev. del 19.09.2012
- ^ Smaltire presso un impianto di trattamento dei rifiuti autorizzato
- ^ (EN) Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 8ª ed., 2020, pp. 84-85, ISBN 9781119371786.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 16 luglio 2022.
- ^ (EN) John D. Roberts, Andrew Streitwieser e Clare M. Regan, Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals 1, in Journal of the American Chemical Society, vol. 74, n. 18, 1952-09, pp. 4579–4582, DOI:10.1021/ja01138a038. URL consultato il 16 luglio 2022.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, p. 83, ISBN 978-0-471-72091-1.
- ^ Ralph J. Fessenden e Joan S. Fessenden, ORGANIC CHEMISTRY, 2ª ed., PWS Publishers, 1982, p. 367, ISBN 0-87150-752-8.
- ^ Eric Clar, The Aromatic Sextet, Springer Netherlands, 1983, pp. 49–58, DOI:10.1007/978-94-009-7197-4_4, ISBN 978-94-009-7199-8. URL consultato il 15 luglio 2022.
- ^ Miquel Solà, Forty years of Clar's aromatic π-sextet rule, in Frontiers in Chemistry, vol. 1, 2013, DOI:10.3389/fchem.2013.00022. URL consultato il 15 luglio 2022.
- ^ (EN) Erich Kleinpeter e Andreas Koch, Identification of Benzenoid and Quinonoid Structures by Through-Space NMR Shieldings (TSNMRS), in The Journal of Physical Chemistry A, vol. 114, n. 18, 13 maggio 2010, pp. 5928–5931, DOI:10.1021/jp101429n. URL consultato il 15 luglio 2022.
- ^ Masahiro Minabe e Katsuko Nakada, Hydrogenation of Pyrene and Catalytic Interconversion of Hydropyrenes, in Bulletin of the Chemical Society of Japan, vol. 58, n. 7, 1º luglio 1985, pp. 1962–1966, DOI:10.1246/bcsj.58.1962. URL consultato il 15 luglio 2022.
- ^ J.I. Wu, M.A. Dobrowolski e M.K. Cyrański, On the aromatic stabilization energy of the 4N π electron pyrene, in Molecular Physics, vol. 107, n. 8-12, 20 aprile 2009, pp. 1177–1186, DOI:10.1080/00268970902784918. URL consultato il 16 luglio 2022.
- ^ (EN) Remco W. A. Havenith, Joop H. van Lenthe e Fokke Dijkstra, Aromaticity of Pyrene and Its Cyclopentafused CongenersResonance and NICS Criteria. An Ab Initio Valence Bond Analysis in Terms of Kekulé Resonance Structures, in The Journal of Physical Chemistry A, vol. 105, n. 15, 1º aprile 2001, pp. 3838–3845, DOI:10.1021/jp003344k. URL consultato il 16 luglio 2022.
- ^ (EN) PubChem, Pyrene, su pubchem.ncbi.nlm.nih.gov. URL consultato il 16 luglio 2022.
- ^ (EN) Pyrene, su www.chemeurope.com. URL consultato il 16 luglio 2022.
Voci correlate[modifica | modifica wikitesto]
- Antracene
- Fenantrene
- Bifenile
- Naftalene
- Benzopirene
- Idrocarburi policiclici aromatici
- Regola di Clar
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su pirene
Wikimedia Commons contiene immagini o altri file su pirene
| Controllo di autorità | LCCN (EN) sh2002005321 · GND (DE) 4176461-4 · J9U (EN, HE) 987007542263005171 |
|---|


 French
French Deutsch
Deutsch