Seleniuro
| Seleniuro | |
|---|---|
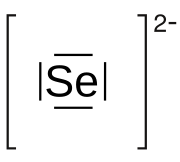 | |
 | |
| Nome IUPAC | |
| Selenio(2-)[1][2] | |
| Abbreviazioni | |
| SE-2 | |
| Nomi alternativi | |
| selandiuro; ione seleniuro; seleniuro(2-) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Se2− |
| Massa molecolare (u) | 78.971[3] |
| Numero CAS | Immagine_3D |
| PubChem | 107674 |
| SMILES | [Se-2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  | |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
Un seleniuro è un composto chimico in cui il selenio serve come anione con numero di ossidazione II (Se2−), come succede per lo zolfo in un solfuro. La chimica dei seleniuri corre parallela a quella dei solfuri.
Come per un solfuro, in una soluzione acquosa, lo ione del seleniuro, Se2−, è prevalente soltanto in condizioni basiche. In condizioni neutre, lo ione del seleniuro di idrogeno, HSe−, è il più comune. In condizioni acide si forma il seleniuro di idrogeno, H2Se.
I minerali di seleniuro sono rari e comprendono la ferroselite e l'umangite.[4]
Poliseleniuri[modifica | modifica wikitesto]
Gli anioni poliseleniuri sono catene con la composizione Se2−n. Il termine viene riferito pure ai sali di questi anioni. Sono comunemente sintetizzati dalla fusione di certi elementi in un tubo di quarzo. Il selenio e un metallo alcalino reagiscono inizialmente dando piccole quantità di solidi solubili bianchi come i monoseleniuri. L'eccesso di selenio porta alla formazione di diseleniuri solubili e poliseleniuri molto solubili con l'aumento uniforme di selenio. Alternativamente, possono essere preparati sciogliendo selenio e un metallo alcalino in ammoniaca liquida.[5] La sintesi può anche essere condotta in solventi con alto punto ebollizione, polari, aprotici come DMF, HMPA e NMP.[6]
I poliseleniuri acquosi reagiscono con grandi controioni organici, una reazione detta metatesi del sale, per formare sali cristallini che sono solubili in solventi organici.
La loro struttura è stata esaminata tramite cristallografia a raggi X. Una proprietà caratteristica della struttura è che due legami di Se-Se terminali sono più corti di quelli che coinvolgono atomi di selenio interni. La spettroscopia NMR 77Se stato solido ad alta risoluzione per [NMe4]2Se5 ed [NMe4]2Se6 indicano conferme simili degli anioni [Se5]2− e Se2− nel solido e in soluzione. Lo spettro di [NMe4]2Se5 mostra 5 siti di selenio distinti e lo spettro di [NMe4]2Se6 mostra la simmetria con soli 3 siti di selenio cristallograficamente differenti. Lo studio della struttura a raggi-X cristallo-singolo di questi sali conferma i dati della spettroscopia NMR.[7]
Reattività[modifica | modifica wikitesto]
I poliseleniuri sono soggetti a decomposizione per esposizione all'aria, nel qual caso vengono ossidati al selenio elementare.
I poliseleniuri formano complessi metallici. La funzione Sex (x = 4, 5, 6) indica ligandi chelanti nei complessi, per esempio (C5H5)2TiSe5, analogo al pentasolfuro di titanocene.[5] Gli anioni poliseleniuri reagiscono con composti alogeni organici:
Punti quantici di seleniuri metallici[modifica | modifica wikitesto]

I punti quantici di seleniuri metallici e le nanoparticelle possono essere preparati con una varietà di metodi sintetici disponibili, molti dei quali richiedono alte temperature e composti precursori pericolosi.[8]
Le particelle possono essere adattate per una varietà di applicazioni variando i ligandi coordinati allo strato esterno caricato positivamente. Molte reazioni di scambio di ligandi sono disponibili per l'uso, scambiando ligandi di tipo X, L e Z, il cui meccanismo è tuttora oggetto di studio.[9]
Applicazioni[modifica | modifica wikitesto]
I punti quantici basati su seleniuri metallici sono studiati estensivamente per le loro peculiari proprietà spettrali.[10]
Le leghe core-shell di solfuro e seleniuro di cadmio sono di interesse per la diagnostica per immagini e la fototerapia.[11]
Note[modifica | modifica wikitesto]
- ^ (EN) Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-08-54-04438-2.
- ^ AC1L1C0X - Compound Summary, in PubChem Compound, National Center for Biotechnology Information, 25 marzo 2005, Identification and Related Records. URL consultato il 13 ottobre 2011.
- ^ (EN) Atomic weights of the elements 2017, su sbcs.qmul.ac.uk.
- ^ (EN) Selenium and Selenium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005, DOI:10.1002/14356007.a23_525..
- ^ a b (EN) Kolis, J., Coordination Chemistry of Polychalcogen Anions and Transition Metal Carbonyls, in Coordination Chemistry Reviews, vol. 105, 1990, pp. 195-219, DOI:10.1016/0010-8545(90)80023-M.
- ^ (EN) Thompson, D. e Boudjouk, P.A., Convenient Synthesis of Alkali Metal Selenides and Diselenides in Tetrahydrofuran and the Reactivity Differences Exhibited By These Salts Toward Organic Bromides, in Journal of Organic Chemistry, vol. 53, 1988, pp. 2109-2112, DOI:10.1021/jo00244a051.
- ^ (EN) Barrie, P.J. e Clark, R.J.H., Selenium Solid-State NMR Spectroscopy and Structures of Tetramethylammonium Pentaselenide and Hexaselenide Complexes, in Inorg. Chem, vol. 34, 1995, pp. 4299–4304, DOI:10.1021/ic00121a006.
- ^ (EN) Ou Chen, Xian Chen, Yongan Yang, Jared Lynch, Huimeng Wu, Jiaqi Zhuang e Y. Charles Cao, Synthesis of Metal-Selenide Nanocrystals Using Selenium Dioxide as the Selenium Precursor, in Angewandte Chemie International Edition, vol. 47, n. 45, 2008, pp. 8638–8641, DOI:10.1002/anie.200804266, ISSN 1433-7851.
- ^ (EN) Nicholas C. Anderson e Jonathan S. Owen, Soluble, Chloride-Terminated CdSe Nanocrystals: Ligand Exchange Monitored by 1H and 31P NMR Spectroscopy, in Chemistry of Materials, vol. 25, n. 1, 8 gennaio 2013, pp. 69–76, DOI:10.1021/cm303219a, ISSN 0897-4756.
- ^ (EN) Daniel R. Larson, Warren R. Zipfel, Rebecca M. Williams, Stephen W. Clark, Marcel P. Bruchez, Frank W. Wise e Watt W. Webb, Water-Soluble Quantum Dots for Multiphoton Fluorescence Imaging in Vivo, in Science, vol. 300, n. 5624, 30 maggio 2003, pp. 1434–1436, DOI:10.1126/science.1083780, ISSN 0036-8075, PMID 12775841.
- ^ (EN) Colin M. Hessel, Varun P. Pattani, Michael Rasch, Matthew G. Panthani, Bonil Koo, James W. Tunnell e Brian A. Korgel, Copper Selenide Nanocrystals for Photothermal Therapy, in Nano Letters, vol. 11, n. 6, 8 giugno 2011, pp. 2560–2566, DOI:10.1021/nl201400z, ISSN 1530-6984, PMID 21553924.
Voci correlate[modifica | modifica wikitesto]
- Nanoparticelle
- Seleniuro di gallio(II), GaSe
- Seleniuro di indio(III), In2Se3
- Seleniuro di sodio, Na2Se
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Seleniuro
Wikimedia Commons contiene immagini o altri file su Seleniuro
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Selenide Nanoparticles Used In Solar Energy Conversion, su sciencedaily.com.
- (EN) IUPAC Gold Book, "selenides", su goldbook.iupac.org.
| Controllo di autorità | GND (DE) 4180879-4 |
|---|


 French
French Deutsch
Deutsch


