グリコーゲン
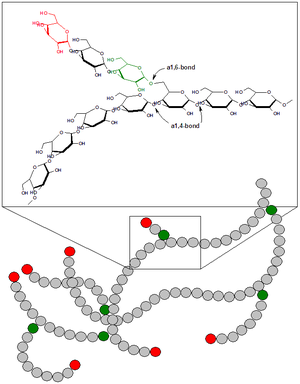
グリコーゲン (glycogen) あるいは糖原質(とうげんしつ)とは、多数のα-D-グルコース(ブドウ糖)分子がグリコシド結合によって重合し、枝分かれの非常に多い構造になった高分子である。動物における貯蔵多糖として知られ、動物デンプンとも呼ばれる。植物デンプンに含まれるアミロペクチンよりもはるかに分枝が多く、8~12残基に一回の分岐となる(糖合成はDNAに支配されないため)。直鎖部分の長さは12~17残基、分岐の先がさらに分岐し、網目構造をとる。英語の発音から「グライコジェン」と呼ばれることもある[1]。
グリコーゲンは肝臓と骨格筋で主に合成され、余剰のグルコースを一時的に貯蔵しておく意義がある。糖分の貯蔵手段としてはほかに、脂肪とアミノ酸という形によるものがある。 脂肪酸という形でしかエネルギーを取り出せない脂肪や、合成分解に窒素代謝の必要なアミノ酸と違い、グリコーゲンは直接ブドウ糖に分解できるという利点がある。 ただし、脂肪ほど多くのエネルギーを貯蔵する目的には向かず、食後などの一時的な血糖過剰に対応している。
肝細胞は、食後直後に肝臓の重量の8 %(大人で100-120 g)までのグリコーゲンを蓄えることができる[2]。本稿の「分解」の節で述べられているように肝臓に蓄えられたグリコーゲンのみが他の臓器でも利用することができる。骨格筋中ではグリコーゲンは骨格筋重量の1-2 %程度の低い濃度でしか貯蔵できない。筋肉は、体重比で成人男性の42%、同女性の36%を占める[3]。このため体格等にもよるが大人で300g前後のグリコーゲンを蓄えることができる。
グリコーゲンの合成・分解は甲状腺、膵臓、副腎がそれぞれ血糖に応じてチロキシン、グルカゴン及びインスリン、アドレナリンなどを分泌することで調整される。 なお、肝臓で合成されたグリコーゲンと骨格筋で合成されたそれとでは分子量が数倍異なり、前者のほうが大きい。
性質[編集]
- 熱水、冷水、ホルムアミド、ジメチル硫酸に可溶。アルコールに不溶。
- 分子量1×106から1×107程度(グルコース残基で6,000から60,000程度)
- ヨウ素デンプン反応における呈色は褐色~赤色。
- ヒトの肝臓には約100gのグリコーゲンが含まれ、約600kcalのエネルギーに相当する。
生合成[編集]
グルコースより、グルコキナーゼ (EC 2.7.1.2)・ヘキソキナーゼ (EC 2.7.1.1)、ホスホグルコムターゼ (EC 5.4.2.2)、UTP-グルコース-1-リン酸ウリジリルトランスフェラーゼ (EC 2.7.7.9)、グリコーゲンシンターゼ (EC 2.4.1.11) の作用により合成される。分枝は1,4-α-グルカン分枝酵素 (EC 2.4.1.18) により形成される。
EC 2.7.1.2 : ATP + D-hexose = ADP + D-hexose-6-phosphate
EC 2.7.1.1 : ATP + D-glucose = ADP + D-glucose-6-phosphate
EC 5.4.2.2 : a-D-glucose-6-phosphate = a-D-glucose-1-phosphate
EC 2.7.7.9 : UTP + a-D-glucose-1-phosphate = diphosphate + UDP-glucose
EC 2.4.1.11 : UDP-glucose + (1,4-a-D-glucosyl)n = UDP + (1,4-a-D-glucosyl)n+1
EC 2.4.1.18 : Transfers a segment of a 1,4-a-D-glucan chain to a primary hydroxy group in a similar glucan chain
分解[編集]
グリコーゲンホスホリラーゼは、グリコーゲンをグルコース単位に分解する。グリコーゲンはグルコースが一分子少なくなり、遊離するグルコース分子は グルコース-1-リン酸となる[4]。代謝されるには、ホスホグルコムターゼによってグルコース-6-リン酸に変換される必要がある。
肝臓はグルコース-6-ホスファターゼを持ち、解糖系や糖新生でできたグルコース-6-リン酸のリン酸基を外すことができる。こうしてできたグルコースは血液中に放出され、他の細胞に運ばれる。グルコース-6-ホスファターゼは、グルコースの恒常性維持のための役割をもつ肝臓と腎臓で見られ、網状組織内部原形質の内膜に存在する。肝臓と腎臓以外の筋肉ではこの酵素を含んでおらず、グルコース-6-リン酸のリン酸基を外してグルコースに変換できないために細胞膜を通過することができず、筋肉中のグリコーゲンは他臓器でグルコースとして利用することができず、筋肉自らのエネルギー源として使用される。
乳酸の輸送にはいくつかの種類のトランスポーターが存在する。例えば、グリコーゲンがグルコースを経て速筋線維で分解され乳酸を生成し、その乳酸が細胞膜を通過して遅筋線維や心筋のミトコンドリアで使われる場合がある[5]。乳酸は肝臓で糖新生によりグルコースが生成されて全身でグルコースとして利用される[6]。経口的に摂取された糖の2-3割は骨格筋で利用されると言われているが、骨格筋の糖消費が十分でない場合には食後の血糖が上昇することとなる。
なお、安静時や強度の低い運動時には脂肪の方が糖よりも多く使われている。血糖やグリコーゲンは利用しやすいが貯蔵量は多くはないので安静時などではあまり多くは使われず、強度の高い運動時などに糖が優先的に使われるようになる[5]。運動強度が低い場合には脂肪とグリコーゲンの燃焼比率は1:1であるが、運動強度が高まるに従って脂肪よりもグリコーゲンの燃焼比率が高まる[7]。
その他[編集]
グリコーゲンを効率的に貯蔵することをスポーツ医学ではグリコーゲン・ローディングまたは、カーボ・ローディングと呼んでいる。グリコーゲンの貯蔵を増やすことで、グリコーゲン枯渇による運動能力の限界を上げるために用いられる。前処理としてグリコーゲン枯渇を起こし、グリコーゲン合成能力を上げた後、炭水化物食品を摂取する古典的方法や、炭水化物とグリコーゲン分解を阻害するクエン酸とを同時に摂取する高速ローディング法などがある。
脚注[編集]
- ^ glycogen dictionary.com
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6
- ^ Marieb, EN; Hoehn, Katja (2010). Human Anatomy & Physiology (8th ed.). San Francisco: Benjamin Cummings. p. 312. ISBN 978-0-8053-9569-3.
- ^ Livanova NB, Chebotareva NA, Eronina TB, Kurganov BI (May 2002), “Pyridoxal 5′_Phosphate as a Catalytic and Conformational Cofactor of Muscle Glycogen Phosphorylase b”, Biochemistry (Moscow) 67 (10): 1089–1998, doi:10.1023/A:1020978825802, PMID 12460107
- ^ a b 八田秀雄「新たな乳酸の見方」『学術の動向』、Vol. 11 (2006) No. 10. doi:10.5363/tits.11.10_47
- ^ 坪内博仁、中川八郎「腎臓の糖新生とその特異性」『臨床化学』Vol. 7 (1978) No. 2. doi:10.14921/jscc1971b.7.2_101
- ^ 堀田昇「グリコーゲンローディング」『体力科学』Vol. 45 (1996) No. 4. doi:10.7600/jspfsm1949.45.461
関連項目[編集]
- グリコーゲン合成
- グリコーゲンの分解
- カーボ・ローディング
- 糖原病
- グリコ (菓子):商品の成分として含まれているグリコーゲンに由来する。


 French
French Deutsch
Deutsch