上皮性ナトリウムチャネル
| Amiloride-sensitive sodium channel | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
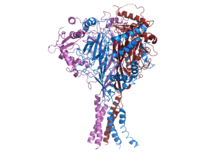 ヒトのENaCの構造[1] | |||||||||||
| 識別子 | |||||||||||
| 略号 | ASC | ||||||||||
| Pfam | PF00858 | ||||||||||
| InterPro | IPR001873 | ||||||||||
| PROSITE | PDOC00926 | ||||||||||
| SCOP | 6BQN | ||||||||||
| SUPERFAMILY | 6BQN | ||||||||||
| TCDB | 1.A.6 | ||||||||||
| OPM superfamily | 181 | ||||||||||
| OPM protein | 4fz1 | ||||||||||
| |||||||||||
上皮性ナトリウムチャネル(じょうひせいナトリウムチャネル、英: epithelial sodium channel、略称: ENaC)またはアミロライド感受性ナトリウムチャネル(amiloride-sensitive sodium channel)は膜に結合したイオンチャネルで、ナトリウムイオン(Na+)を選択的に透過させる。ENaCは3つの相同なサブユニット、α(またはδ)、β、γから構成されるヘテロ三量体である[2]。これらのサブユニットは4つの遺伝子、SCNN1A、SCNN1B、SCNN1G、SCNN1Dにコードされている。ENaCは、主に腎臓のネフロンの集合管でのナトリウムイオンの再吸収に関与している。
多くの密着した上皮細胞の頂端膜には、利尿作用のある遮断薬アミロライドに対する高い親和性で特徴づけられるナトリウムチャネルが存在している[2][3][4][5]。これらのチャネルは、体の塩分と水分の恒常性の維持に必須となる、能動的なナトリウムの再吸収の最初の段階を媒介する[3]。脊椎動物では、このチャネルは腎臓、結腸、肺、汗腺でナトリウムの再吸収を制御しており、また味覚にも関与している。
ENaCは、ATPを検知した際に活性化される痛覚受容体P2X受容体と構造的、そしておそらく進化的にも関係している。
位置と機能[編集]
ENaCは極性のある上皮細胞の頂端膜の位置しており、特に腎臓(主に集合管)、肺、皮膚、生殖器、結腸に位置している[2][6][7][8]。ENaCは、遠位ネフロン、循環器と生殖器、外分泌腺の上皮細胞において、頂端膜を越えたNa+の再吸収を促進する。Na+の濃度は細胞外液の浸透圧の主要な決定因子であるため、Na+濃度の変化は体液の移動に影響を与え、したがって体液の体積と血圧に影響を与える。結腸と腎臓におけるENaCの活性は、鉱質コルチコイドのアルドステロンによって調節される。ENaCはトリアムテレンまたはアミロライドによって遮断され、これらは医療的には利尿薬として機能する。腎臓では心房性ナトリウム利尿ペプチドによって阻害され、ナトリウム利尿と利尿が引き起こされる。
ENaCは脳において血圧の調節に重要な役割を果たす[9]。バソプレシン(VP)ニューロンは、神経内分泌の調節と心血管系の恒常性の維持のための自律神経応答に主要な役割を果たす。高い食塩摂取量はENaCの発現と活性の増大を引き起こし、VPニューロンの定常状態での脱分極を引き起こす[9]。これは、食事での食塩摂取がENaCの活性を介してVPニューロンの活性に影響を与える機構の1つである。脳のENaCは食事中のナトリウムに対する血圧応答にも関与している。
高解像度の免疫蛍光染色を利用した研究では、ENaCは気道と女性器の多繊毛細胞(multi-ciliated cell)の表面を覆う繊毛の全長にわたって位置していることが明らかにされている[7]。これら運動性繊毛を有する上皮細胞では、ENaCは繊毛周囲液(periciliary fluid)の浸透圧の調節因子として機能し、その機能は体液を繊毛の運動性に必要な深さに維持しておくために必須である。繊毛の運動は、気道では粘膜繊毛クリアランスに必須であり、女性器では卵母細胞の移動に必須である[7]。
ENaCとは対照的に、塩化物イオンの輸送を調節するCFTRは繊毛上には見られない。これらの知見は、ENaCがCFTRとの直接的な相互作用によってダウンレギュレーションされるという、以前の仮説とは矛盾するものである。嚢胞性線維症の患者では、CFTRはENaCをダウンレギュレーションすることができないため、肺での過剰吸収と再発性の肺感染症が引き起こされる。ENaCはリガンド依存性イオンチャネルである可能性が示唆されている[10]。
皮膚の表皮層では、ENaCは角化細胞、皮脂腺、平滑筋細胞で発現している[6]。これらの細胞ではENaCは主に細胞質に位置している[6]。エクリン腺では、ENaCは主に汗管の内腔に面した頂端膜に位置している[6]。汗管でのENaCの主要な機能は、汗として分泌されたNa+の再吸収である。全身性偽性低アルドステロン症I型(systemic pseudohypoaldosteronism type I)を引き起こすENaCの変異を有する患者では、特に暑い気候で大量のNa+が失われる。
また、ENaCは味覚受容器にも見つかり、塩味の知覚に重要な役割を果たす。齧歯類では塩味は事実上完全にENaCによって媒介されている一方、ヒトではその重要性は低いようであり、約20%がENaCによるものとされる。
イオン選択性[編集]
ENaCはNa+とLi+を透過させるが、K+、Cs+、Rb+はほとんど透過性を持たないことが研究によって示されている[11][12]。
構造[編集]

ENaCはα、β、γの3つの異なるサブユニットから構成される[2][13]。3つのサブユニット全てが膜での組み立てと機能的なチャネル機能に必須である[14]。各サブユニットのC末端にはPPXYモチーフが存在し、βまたはγサブユニットのいずれかのモチーフに変異や欠失が生じると、常染色体優性遺伝型の高血圧が生じるリドル症候群が引き起こされる。ENaCのクライオ電顕構造は、同じファミリーに属する酸感受性イオンチャネルASIC1のようなヘテロ三量体のチャネル構造であることを示している[15][16]。各サブユニットは2本の膜貫通ヘリックスと細胞外ループから構成される。3つのポリペプチドのN末端とC末端はすべて細胞質に位置している。
ASIC1の結晶構造と部位特異的変異導入による研究は、ENaCのイオンチャネルは3つのサブユニット間の中心対称軸に沿って存在することを示唆している[12][17]。
構造的には、このファミリーに属するタンパク質は510から920アミノ酸残基で構成される。細胞内のN末端領域、膜貫通ドメイン、大きな細胞外ループ、2番目の膜貫通ドメイン、C末端の細胞内テールという構成をしている[18]。
δサブユニット[編集]
3つのサブユニットに加えて、4番目のδサブユニットが存在する。δサブユニットはαサブユニットとかなり配列が類似しており、β、γサブユニットとともに機能的なイオンチャネルを形成する。このようなδβγ-ENaCは、膵臓、精巣、肺、卵巣に存在する。その機能は不明である。
ファミリー[編集]
ENaCファミリーのメンバーは4つのサブファミリー(α、β、γ、δ)に分類される[4]。タンパク質は、大きな細胞外ループで隔てられた2つの膜貫通セグメントという、同じトポロジーを示す。これまで研究されてきたENaCの大部分で細胞外ドメインは高度に保存されており、C末端側の両親媒性膜貫通領域に近接して多数のシステイン残基を含んでいる。これらはオリゴマーからなるチャネルタンパク質の親水性ポアの形成に寄与すると想定されている。保存性の高い細胞外ドメインは、チャネルの活性を制御する受容体として機能していると考えられている。
脊椎動物の上皮細胞のENaCタンパク質は、系統樹において互いに密接にクラスタリングする。脳では、電位非感受性のENaCのホモログも見つかっている。線虫Caenorhabditis elegansでは、脊椎動物のタンパク質と遠い関係にある多くのタンパク質がシーケンシングされている。脊椎動物のENaCタンパク質はC. elegansのdegenerin(deg-1、del-1、mec-4、mec-10、unc-8)と類似している[18]。これらのタンパク質はナトリウムチャネルを形成していると考えられており、その変異は神経変性を引き起こす。
スーパーファミリー[編集]
ENaCファミリーは、ENaC/P2Xスーパーファミリーに属する[19]。ENaCとP2X受容体は同様の三次元構造を持ち、相同である[20]。
遺伝子[編集]
ENaCの3つサブユニットをコードする3つの遺伝子の配列は大きく異なっているものの、エクソン-イントロン構造は高度に保存されている[21]。
3つのサブユニットとδサブユニットをコードする遺伝子はそれぞれSCNN1A、SCNN1B、SCNN1G、SCNN1Dである。
ASIC1、ASIC2、ASIC3、ASIC4という、4つの関連したアミロライド感受性ナトリウムチャネル遺伝子が存在する。
臨床的意義[編集]

ENaCは、嚢胞性線維症の病理に重要なCFTRと相互作用する。CFTRは塩化物イオンの輸送を担う膜貫通チャネルで、このタンパク質の欠陥は嚢胞性線維症を引き起こす。機能的なCFTRが存在しないときにはENaCはアップレギュレーションされる。
気道では、CFTRは塩化物イオンを分泌し、ナトリウムイオンと水を受動的に透過する。しかし、機能的なCFTRが存在しないときにはENaCはアップレギュレーションされ、ナトリウムイオンの再吸収によって塩と水分の分泌をさらに低下させる。その結果、脱水した厚い粘液が蓄積し、ガス交換が阻害され、細菌のクリアランスが行われにくくなる[22]。一方で、CFTRのアップレギュレーションはENaCの高活性を補正しない[23]。おそらく肺の上皮組織での機能的なイオン恒常性の維持には、カリウムチャネル、アクアポリン、Na/K-ATPアーゼなどの他の相互作用因子が必要であると考えられる[24]。
汗腺では、CFTRは汗管中の塩化物イオンの再吸収を担う。塩化物イオンの流れによって生じた電気化学勾配の結果、ナトリウムイオンは受動的にENaCを透過する。その結果、塩と水分の喪失は低下する。嚢胞性線維症のため塩化物イオンの流れが存在しないときには、ナトリウムイオンはENaCを通って流入せず、塩と水分の喪失はより大きなものとなる(汗管内でのナトリウムイオンの流れはCFTRを介した塩化物イオンの流れによって生じる電気化学勾配によって制限されているため、ENaCがアップレギュレーションされても生じる)。
β、γサブユニットの機能獲得型変異は、リドル症候群と関係している[25]。
アミロライドとトリアムテレンは、上皮性ナトリウムチャネル遮断薬として機能するカリウム保持性利尿薬である。
出典[編集]
- ^ Noreng, Sigrid; Bharadwaj, Arpita; Posert, Richard; Yoshioka, Craig; Baconguis, Isabelle (2018-09-25). “Structure of the human epithelial sodium channel by cryo-electron microscopy”. eLife 7: e39340. doi:10.7554/eLife.39340. ISSN 2050-084X.
- ^ a b c d “Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases.”. Gene 579 (2): 95–132. (Jan 2016). doi:10.1016/j.gene.2015.12.061. PMC 4756657. PMID 26772908.
- ^ a b “Molecular properties of epithelial, amiloride-blockable Na+ channels”. FASEB Journal 8 (8): 522–8. (May 1994). doi:10.1096/fasebj.8.8.8181670. PMID 8181670.
- ^ a b “Phylogenetic characterization of the epithelial Na+ channel (ENaC) family”. Molecular Membrane Biology 13 (3): 149–57. (1996). doi:10.3109/09687689609160591. PMID 8905643.
- ^ “Molecular cloning and functional expression of a novel amiloride-sensitive Na+ channel”. The Journal of Biological Chemistry 270 (46): 27411–4. (Nov 1995). doi:10.1074/jbc.270.46.27411. PMID 7499195.
- ^ a b c d “Expression of epithelial sodium channel (ENaC) and CFTR in the human epidermis and epidermal appendages”. Histochemistry and Cell Biology 147 (6): 733–748. (January 2017). doi:10.1007/s00418-016-1535-3. PMID 28130590.
- ^ a b c “Epithelial sodium channels (ENaC) are uniformly distributed on motile cilia in the oviduct and the respiratory airways”. Histochemistry and Cell Biology 137 (3): 339–53. (March 2012). doi:10.1007/s00418-011-0904-1. PMID 22207244.
- ^ “Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa”. Journal of Molecular Histology 49 (2): 195–208. (February 2018). doi:10.1007/s10735-018-9759-2. PMID 29453757.
- ^ a b “+channels (ENaC) in vasopressin magnocellular neurosecretory neurons in the rat supraoptic nucleus”. The Journal of Physiology 595 (17): 5857–5874. (September 2017). doi:10.1113/JP274856. PMC 5577521. PMID 28714095.
- ^ “Epithelial sodium channel: a ligand-gated channel?”. Nephron Physiology 96 (2): 37–41. (2004). doi:10.1159/000076406. PMID 14988660.
- ^ “Ptychotropism as a cutaneous feature of the CHILD syndrome”. Journal of the American Academy of Dermatology 23 (4 Pt 1): 763–6. (Oct 1990). doi:10.1016/0190-9622(90)70285-p. PMID 2229513.
- ^ a b “ASIC and ENaC type sodium channels: Conformational states and the structures of the ion selectivity filters”. FEBS Journal 284 (4): 525–545. (2017). doi:10.1111/febs.13840. PMID 27580245.
- ^ “Functional domains of the epithelial sodium channel”. Journal of the American Society of Nephrology 16 (11): 3175–81. (Nov 2005). doi:10.1681/ASN.2005050456. PMID 16192417.
- ^ “Identification of the roles of conserved charged residues in the extracellular domain of an epithelial sodium channel (ENaC) subunit by alanine mutagenesis”. American Journal of Physiology. Renal Physiology 300 (4): F887-97. (Apr 2011). doi:10.1152/ajprenal.00648.2010. PMID 21209000.
- ^ Noreng, Sigrid; Bharadwaj, Arpita; Posert, Richard; Yoshioka, Craig; Baconguis, Isabelle (2018-09-25). “Structure of the human epithelial sodium channel by cryo-electron microscopy”. eLife 7: e39340. doi:10.7554/eLife.39340. ISSN 2050-084X.
- ^ “Structure of acid-sensing ion channel 1 at 1.9 Å resolution and low pH”. Nature 449 (7160): 316–322. (2007). doi:10.1038/nature06163. PMID 17882215.
- ^ “Conserved charged residues at the surface and interface of epithelial sodium channel subunits--roles in cell surface expression and the sodium self-inhibition response”. The FEBS Journal 281 (8): 2097–111. (Apr 2014). doi:10.1111/febs.12765. PMID 24571549.
- ^ a b “Membrane topology of the amiloride-sensitive epithelial sodium channel”. The Journal of Biological Chemistry 269 (39): 24379–83. (Sep 1994). PMID 7929098.
- ^ “ATP-gated P2X Receptor Cation Channel (P2X Receptor) Family”. Functional and Phylogenetic Classification of Membrane Transport Proteins. Saier Lab. Group, UCSD and SDSC. 2019年11月19日閲覧。
- ^ “Phylogenetic characterization of transport protein superfamilies: superiority of SuperfamilyTree programs over those based on multiple alignments”. J. Mol. Microbiol. Biotechnol. 21 (3–4): 83–96. (2011). doi:10.1159/000334611. PMC 3290041. PMID 22286036.
- ^ “Gene structure of the human amiloride-sensitive epithelial sodium channel beta subunit”. Biochemical and Biophysical Research Communications 252 (1): 208–13. (Nov 1998). doi:10.1006/bbrc.1998.9625. PMID 9813171.
- ^ “Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice”. Nature Medicine 10 (5): 487–93. (May 2004). doi:10.1038/nm1028. PMID 15077107.
- ^ “Transgenic hCFTR expression fails to correct β-ENaC mouse lung disease”. American Journal of Physiology. Lung Cellular and Molecular Physiology 302 (2): L238-47. (January 2012). doi:10.1152/ajplung.00083.2011. PMC 3349361. PMID 22003093.
- ^ “Ion transporting proteins of human bronchial epithelium”. Journal of Cellular Biochemistry 113 (2): 426–32. (Feb 2012). doi:10.1002/jcb.23393. PMID 21975871.
- ^ Ion Channel Diseases
外部リンク[編集]
- Epithelial sodium channel - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)


 French
French Deutsch
Deutsch