Choroba Parkinsona – Wikipedia, wolna encyklopedia
| Paralysis agitans | |
 Charakterystyczne cechy postawy ciała osoby chorej na chorobę Parkinsona (A Manual of Diseases of the Nervous System z 1886 r. autorstwa Williama Richarda Gowersa) | |
| Klasyfikacje | |
| DiseasesDB | |
|---|---|
| OMIM | |
| MedlinePlus | |
| MeSH | |
Choroba Parkinsona (łac. morbus Parkinsoni; ang. Parkinson’s disease, PD), dawniej: drżączka poraźna (łac. paralysis agitans) – samoistna, powoli postępująca, zwyrodnieniowa choroba ośrodkowego układu nerwowego, należąca do chorób układu pozapiramidowego. Nazwa pochodzi od nazwiska londyńskiego lekarza Jamesa Parkinsona, który w 1817 roku rozpoznał i opisał objawy tego schorzenia (jego podłoże anatomiczne i biochemiczne poznano jednak dopiero w latach 60. XX wieku).
Historia[edytuj | edytuj kod]
Choroba znana była od stuleci, ale za pierwszy formalny jej opis uważa się An Essay on the Shaking Palsy brytyjskiego lekarza Jamesa Parkinsona (1755–1824) z 1817 roku. Początkowo używano terminu drżączki poraźnej (paralysis agitans), ale Jean-Martin Charcot wprowadził powszechny do dziś eponim choroby Parkinsona. Odkrycie zmian w istocie czarnej w przebiegu tej choroby przypisuje się Konstantinowi Tretiakoffowi (1892–1958), który opisał je w swoim doktoracie w 1917 roku[1]. Rolę dopaminy w patogenezie schorzenia wyjaśnili Ehringer i Hornykiewicz w 1960 roku[2]. Pierwsze próby z lewodopą podjęto rok później[3]. Zmiany biochemiczne leżące u podstaw choroby odkrył szwedzki biochemik Arvid Carlsson, któremu za to odkrycie przyznano Nagrodę Nobla w 2000 roku[4].
Epidemiologia[edytuj | edytuj kod]
Choroba Parkinsona dotyczy 1% populacji ludzi od 40. do 60. roku życia, ale zdarza się również u ludzi młodszych.
Etiologia[edytuj | edytuj kod]

W chorobie Parkinsona do objawów chorobowych dochodzi z powodu zmian zwyrodnieniowych komórek nerwowych w istocie czarnej (łac. substantia nigra) i innych obszarach barwnikonośnych mózgowia. Neurony istoty czarnej wytwarzają neurotransmiter dopaminę, stąd nazywa się je neuronami dopaminergicznymi; zawierają ponadto melaninę, dlatego określa się je również jako barwnikonośne. Konsekwencją zaburzenia funkcji tych neuronów jest niedobór dopaminy (ok. 70–80%) w istocie czarnej i prążkowiu, i przewaga aktywności neuronów glutaminergicznych, hamujących jądra wzgórza. W zmienionych chorobowo obszarach mózgowia stwierdza się obecność ciał Lewy’ego, jednak nie są to zmiany patognomoniczne dla choroby Parkinsona.
Objawy neuropatologiczne korelują z obrazem klinicznym choroby.
W proces neurodegeneracyjny wciągnięte są układ dopaminergiczny (istota czarna, podwzgórze, układ mezokortykalno-limbiczny, siatkówka), układ noradrenergiczny (miejsce sinawe), układ cholinergiczny (jądro podstawne Meynerta) i układ glutaminergiczny.
Czynniki wywołujące te zmiany zwyrodnieniowe do chwili obecnej nie zostały dostatecznie określone, jednak przynajmniej część z nich to czynniki genetyczne.
Czynniki genetyczne[edytuj | edytuj kod]
| Typ | OMIM | Locus | Szczegóły |
| PARK1 | OMIM#168601 | 4q21 | Mutacje w genie SNCA kodującym alfa-synukleinę. Dziedziczenie AD. Tzw. PARK4 (OMIM#605543) przypuszczalnie spowodowana jest triplikacjami SNCA. |
| PARK2 | OMIM%602544 | 6q25.2-q27 | Mutacje w genie kodującym białko parkinę. Jedna z najczęstszych przyczyn rodzinnej postaci choroby Parkinsona o wczesnym początku. |
| PARK3 | OMIM%602404 | 2p13 | Dziedziczenie AD, opisano zaledwie kilka rodzin. |
| PARK5 | OMIM+191342 | 4p14 | Mutacje w genie UCHL1 kodującym hydrolazę L1 ubikwityny. |
| PARK6 | OMIM%605909 | 1p36 | Mutacje w genie PINK1 (608309) kodującym hipotetyczną kinazę 1 indukowaną PTEN |
| PARK7 | OMIM%606324 | 1p36 | Mutacje w genie DJ-1 (602533) |
| PARK8 | OMIM%607060 | 12q12 | Mutacje w genie LRRK2 kodującym dardarynę. |
| PARK9 | OMIM%606693 | 1p36 | Mutacje w genie ATP13A2 (zespół Kufora-Rakeba). PARK9 i PARK6 mogą być schorzeniami allelicznymi. |
| PARK10 | OMIM%606852 | 1p | – |
| PARK11 | OMIM%607688 | 2q36-37 | Rozbieżne informacje co do tego locus, może nie mieć znaczenia w patogenezie choroby. |
| PARK12 | OMIM%300557 | Xq21-q25 | – |
| PARK13 | OMIM#610297 | 2p12 | Mutacje w genie HTRA2 kodującym peptydazę serynową-2 HtrA |
Objawy i przebieg[edytuj | edytuj kod]
Objawy choroby Parkinsona pojawiają się i narastają powoli i stopniowo w ciągu kilkunastu lat. Początkowo chorzy zauważają pewne spowolnienie ruchowe i niezgrabność w ruchach, pojawiają się zaburzenia pisania (mikrografizm – bardzo drobne pismo). Spowolnieniu ulegają procesy psychiczne. Niekiedy chorzy sądzą, iż są to objawy zmian reumatycznych lub starszego wieku. Jednak po pewnym czasie osoby chore na chorobę Parkinsona zauważają u siebie zaburzenia równowagi lub trudności z wykonywaniem takich prostych czynności jak wstawanie z krzesła czy z łóżka. Na tym etapie choroby pacjent z reguły zjawia się u lekarza.
Do objawów prodromalnych (poprzedzających chorobę) zalicza się:
- sztywność osobowości
- depresję
- zaparcia
- łojotokowe zapalenie skóry
- parestezje kończyn
- dyskretne zaburzenia węchowe.
Podstawowymi objawami są:
- bradykinezja – spowolnienie i zubożenie ruchów, szczególnie trudności z wykonywaniem ruchów precyzyjnych; chód szurający, drobnymi kroczkami, brak fizjologicznych współruchów (balansowania kończyn górnych) i akineza (trudności w rozpoczęciu ruchów)
- sztywność mięśniowa (plastyczne zwiększenie napięcia mięśniowego, twarz maskowata)
- drżenie spoczynkowe.
Inne objawy to:
- niestabilność postawy
- propulsja (tendencja do padania do przodu)
- retropulsja (tendencja do padania ku tyłowi)
- lateropulsja (tendencja do padania w bok)
- objawy wegetatywne:
- ślinotok
- łojotok
- napadowe pocenie się
- hipotensja ortostatyczna, mogąca prowadzić do omdleń[5].
- przodopochylenie tułowia (spowodowane znacznie wzmożonym napięciem mięśniowym)
- niewyraźna, cicha mowa, dyzartria
- trudności w połykaniu (rzadko)
- rzadkie mruganie
- spowolniony przebieg procesów psychicznych, osłabiona pamięć i zdolność przypominania.
Przebieg[edytuj | edytuj kod]
Przebieg choroby jest zwykle powolny, wieloletni i postępujący, mimo skrupulatnego leczenia po pewnym czasie doprowadza do inwalidztwa. Bardzo ważnym elementem postępowania leczniczego jest rehabilitacja, która pozwala choremu na dłużej zachować sprawność. Aktualnie prowadzone są badania mutacji genu GBA w celu przyśpieszenia diagnozy i wczesniejszego leczenia pacjentów z mutacją GBA.[6]
Rozpoznanie[edytuj | edytuj kod]
Uproszczone kryteria rozpoznania choroby Parkinsona według Advisory Council of the National Institute of Neurological Disorders and Stroke amerykańskich Narodowych Instytutów Zdrowia:
- Rozpoznanie możliwe
- Postępujący przebieg oraz
- Przynajmniej dwa następujących objawów:
- akinezja
- sztywność mięśni
- drżenie spoczynkowe
- Brak cech nietypowych dla PD
- Rozpoznanie prawdopodobne
- Spełnione kryteria dla możliwej PD oraz
- Przynajmniej dwa z następujących objawów:
- wyraźna poprawa po lewodopie
- występowanie fluktuacji lub dyskinez w związku z leczeniem lewodopą
- asymetria objawów
- Rozpoznanie pewne
- Spełnione kryteria dla prawdopodobnej PD oraz
- Wykazanie w badaniu sekcyjnym:
- zaniku neuronów istoty czarnej
- obecności ciał Lewy’ego w istocie czarnej
- braku ciał wtrętowych w komórkach oligodendrogleju
Rozpoznanie różnicowe[edytuj | edytuj kod]
W diagnostyce różnicowej choroby Parkinsona należy uwzględnić:
- inne zespoły parkinsonowskie
- parkinsonizm polekowy
- parkinsonizm toksyczny
- parkinsonizm pozapalny
- parkinsonizm naczyniopochodny
- parkinsonizm pourazowy
- zespoły parkinsonizm plus
- zanik wieloukładowy (MSA)
- postępujące porażenie nadjądrowe (PSP)
- zwyrodnienie korowo-podstawne (CBD)
- otępienie z ciałami Lewy’ego (LBD)
- wodogłowie normotensyjne (zespół Hakima)
- drżenie samoistne
- depresję
- zespół połowiczych zaburzeń czucia
- zespół bolesnego barku
- lumbago
- reumatoidalne zapalenie stawów.
Leczenie[edytuj | edytuj kod]

Jest kilka grup leków stosowanych w terapii tej choroby.
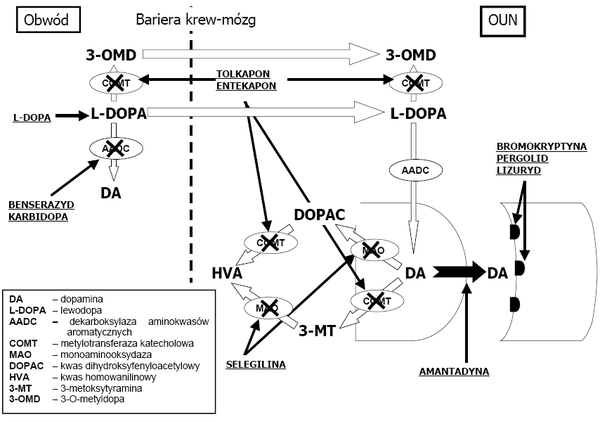
- Lewodopa jest zasadniczym lekiem stosowanym w farmakoterapii PD. Jest to aminokwas, który może przechodzić z krwi do mózgu i w mózgu ulec przekształceniu w dopaminę. Lewodopa jest szybko rozkładana w tkankach obwodowych, zanim zdąży dotrzeć do mózgu, z drugiej strony nie jest możliwe podawanie większych dawek leku, ponieważ powoduje to nasilone objawy uboczne. Rozwiązaniem jest podawanie łączne z lewodopą inhibitora obwodowego enzymu dopa-dekarboksylazy, na przykład karbidopy lub benserazydu. Głównymi powikłaniami stosowania preparatów lewodopy są tzw. zespoły on-off charakteryzujące się występowaniem znacznej hipokinezy w momencie obniżania się stężenia leku we krwi, przeplatanej hiperkinezami (ruchy mimowolne) na szczycie dawki. Innym powikłaniem jest występowanie zaburzeń psychicznych w przypadku stosowania dużych dawek leku.
- Amantadyna to lek zwiększający uwalnianie endogennej dopaminy (pochodzącej z wewnątrz organizmu).
- Agonisty receptorów dopaminowych, np. bromokryptyna, ropinirol.
- Inhibitory MAO hamujące rozkład dopaminy, np. selegilina.
- Inhibitory COMT (katecholo-o-metylotransferazy): entakapon, tolkapon, nitekapon.
- Leki antycholinergiczne: biperyden, cykrymina, procyklidyna, triheksyfenidyl.
- Beta-blokery, np. propranolol.
Innymi możliwościami leczenia są:
- leczenie operacyjne – stereotaktyczne uszkadzanie gałki bladej (pallidotomia), jądra niskowzgórzowego (subtalamotomia) albo jąder wzgórza (talamotomia), jedno- lub obustronne
- przeszczepienie tkankowe istoty czarnej
- głęboka stymulacja mózgu: wszczepienie elektrostymulatora w zidentyfikowane ognisko w mózgu.
Poza powyżej wymienionymi zalecana jest rehabilitacja ruchowa, na którą składają się:
- gimnastyka lecznicza
- pływanie lecznicze
- terapia mowy
- fizykoterapia
- masaż
- muzykoterapia
- spacery[potrzebny przypis]
Stwierdzono, że w chorobie Parkinsona medytacja mindfulness polepsza funkcje motoryczne i kognitywne oraz jakość życia[7].
Badania z ostatnich 30 lat wykazują spójnie, że palenie tytoniu zmniejsza ryzyko wystąpienia choroby Parkinsona[8], ale prawdopodobnie jest to spowodowane głównie skróceniem życia w wyniku palenia (palący żyją średnio około 14 lat krócej niż niepalący)[9].
Rokowanie[edytuj | edytuj kod]
Choroba nie powoduje bezpośrednio śmierci, lecz pogarsza jakość życia i wiąże się z potencjalnie śmiertelnymi powikłaniami. Zgon następuje w wyniku powikłań, przede wszystkim zapaleń płuc (najczęstsza bezpośrednia przyczyna zgonu).
Grupy wsparcia[edytuj | edytuj kod]
Istnieją stowarzyszenia zajmujące się pomocą dla osób chorych na chorobę Parkinsona i ich opiekunów.
11 kwietnia jest Światowym Dniem Choroby Parkinsona.
Klasyfikacja ICD10[edytuj | edytuj kod]
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: G20 | Choroba Parkinsona |
| ICD-10: F02.3 | Otępienie w chorobie Parkinsona |
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ C. Tretiakoff: Contribution a l’etude de l’anatomie pathologique du locus niger de Soemmering avec quelques deductions relatives a la pathogenie des troubles du tonus musculaire et de la maladie de Parkinson. Paryż 1919.
- ↑ O. Hornykiewicz: The discovery of dopamine deficiency in the parkinsonian brain. „J Neural Transm” 70, 9–15 (2006).
- ↑ W. Birkmayer, O. Hornykiewicz. The L-3,4-dioxyphenylalanine (DOPA)-effect in Parkinson-akinesia. „Wien Klin Wochenschr”. 73, s. 787–788, Nov 1961. PMID: 13869404.
- ↑ A. Björklund, S.B. Dunnett. Dopamine neuron systems in the brain: an update. „Trends Neurosci”. 30 (5), s. 194–202, May 2007. DOI: 10.1016/j.tins.2007.03.006. PMID: 17408759.
- ↑ Piotr Thor, Podstawy patofizjologii człowieka, Kraków: Fundacja Zdrowia Publicznego – Uniwersyteckie Wydawnictwo Medyczne „Vesalius”, 2007, s. 439, ISBN 978-83-85688-78-5, OCLC 750115269 [dostęp 2020-04-14].
- ↑ MDS 2023. Prosty model kliniczny pomoże w diagnostyce choroby Parkinsona [online], www.termedia.pl [dostęp 2023-09-08] (pol.).
- ↑ Hye Gyeong Son, Eun Ok Cho, The Effects of Mindfulness Meditation-based Complex Exercise Program on Motor and Non-Motor Symptoms, and Quality of Life in Patients with Parkinson’s Disease, „Asian Nursing Research”, 2018, DOI: 10.1016/j.anr.2018.06.001.
- ↑ Harvey Checkoway i inni, Parkinson’s disease risks associated with cigarette smoking, alcohol consumption, and caffeine intake, „American Journal of Epidemiology”, 155 (8), 2002, s. 732–738, DOI: 10.1093/aje/155.8.732, PMID: 11943691.
- ↑ Morbidity and Mortality Weekly Report. April 12, 2002 / 51(14); 300–3.
Bibliografia[edytuj | edytuj kod]
- Neurologia. Podręcznik dla studentów medycyny. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 282–286. ISBN 83-200-3244-X.
- Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom II. Andrzej Szczeklik (red.). Wydawnictwo Medycyna Praktyczna, 2005. ISBN 83-7430-031-0.
- Jankovic J. Parkinson’s disease: clinical features and diagnosis. „J Neurol Neurosurg Psychiatry”. 79. 4, s. 368–376, 2008. DOI: 10.1136/jnnp.2007.131045. PMID: 18344392.


 French
French Deutsch
Deutsch