Ácido fluorantimônico – Wikipédia, a enciclopédia livre
| Ácido fluorantimônico Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Ácido fluorantimônico |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | HSbF6 |
| Massa molar | 236,808 g/mol |
| Aparência | xarope incolor |
| Ponto de ebulição | decompõe-se |
| Solubilidade em água | decompõe-se |
| Acidez (pKa) | −24 |
| Riscos associados | |
| Principais riscos associados | Altamente corrosivo |
| NFPA 704 | |
| Ponto de fulgor | não-inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | HBF4 |
| Outros catiões/cátions | NaPF6, NaSbF6 |
| Ácidos relacionados | HF SbF5 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido fluorantimônico, de fórmula molecular HSbF6, é o mais forte superácido conhecido. É obtido pela reação de pentafluoreto de antimônio (fórmula molecular: SbF5) e fluoreto de hidrogênio (fórmula molecular: HF) em proporções diversas; com uma proporção molar de 1 para 1, tem-se máxima acidez, podendo formar soluções de pH inferior a -24,[1] sendo 2×1019 vezes mais ácido que o ácido sulfúrico.[2]
Devido à seu elevado potencial corrosivo, este ácido dissolve vidros plásticos e a maior parte dos materiais existentes. Deste modo ele somente pode ser armazenado em recipientes especiais feitos com politetrafluoretileno.[3] O nível de acidez apresentado por esta substância é tão elevado que caso respingue nas mãos de quem o manipula, é capaz de corroê-la totalmente, incluindo os ossos.[4]
É uma combinação de fluoreto de hidrogênio e SbF5. Neste sistema, o HF, anidro, se ioniza, unindo-se o fluoreto ao SbF5, formando-se SbF6-, o qual é simultaneamente um nucleófilo muito débil e uma base muito débil. O próton fica literalmente "nu", o que dá ao sistema uma acidez extrema.
A reação entre o fluoreto de hidrogênio e o pentafluoreto de antimônio é exotérmica. O HF libera seu cátion (H+), e seu ânion (F-) que é sequestrado por uma ou mais moléculas de SbF5, formando um SbF6- octaédrico. A reação é a seguinte: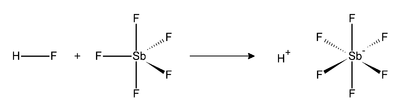
Referências
- ↑ Olah, G. A.; Prakash, G. K. S.; Barzaghi, M.; Lammertsma, K.; von R Schleyer, P.; Pople, J. A. (5 de março de 1986). «Protonated hydronium dication, H/sub 4/O/sup 2 +/. Hydrogen-deuterium exchange of D/sub 2/H/sup 17/O/sup +/ in HF:SbF/sub 5/ and DH/sub 2//sup 17/O/sup +/ in DF:SbF/sub 5/ and theoretical calculations». J. Am. Chem. Soc.; (United States) (em inglês). doi:10.1021/ja00265a031. Consultado em 10 de maio de 2021
- ↑ Ph. D., Biomedical Sciences; B. A., Physics and Mathematics. «What Is the World's Strongest Superacid?». ThoughtCo (em inglês). Consultado em 13 de fevereiro de 2021
- ↑ «The World's Strongest Acids: Like Fire and Ice | RealClearScience». www.realclearscience.com. Consultado em 13 de fevereiro de 2021
- ↑ «Can You Identify the 4 Most Dangerous and Harmful Acids in Existence?». ThoughtCo (em inglês). Consultado em 13 de fevereiro de 2021


 French
French Deutsch
Deutsch