Antioxidante – Wikipédia, a enciclopédia livre

Um antioxidante é uma molécula capaz de inibir a oxidação de outras moléculas. A oxidação é uma reacção química que transfere electrões ou hidrogénio de uma substância para um agente oxidante. As reacções de oxidação podem produzir radicais livres. Por sua vez, estes radicais podem dar início a reacções em cadeia que, quando ocorrem em células, podem danificá-las ou causar a sua morte. Os antioxidantes interrompem estas reacções em cadeia eliminando os radicais livres intermediários e inibindo outras reacções de oxidação. Isto é conseguido através da sua própria oxidação, pelo que os antioxidantes são frequentemente agentes de redução, como os tióis, o ácido ascórbico ou polifenóis.[1]

Embora as reacções de oxidação sejam fundamentais para a vida, podem também ser prejudiciais. As plantas e os animais sustentam sistemas complexos de vários tipos de antioxidantes, como glutationa, vitamina C e vitamina E, e ainda enzimas como a catalase, dismutase e várias peroxidases. Baixos níveis de antioxidantes, ou inibição das enzimas antioxidantes, causam stress oxidativo e podem danificar ou matar as células.
Como o stress oxidativo mostra ser um componente fundamental de muitas doenças humanas, o uso de antioxidantes na farmacologia é estudado de forma intensiva, sobretudo em tratamentos para os enfartes ou doenças neurodegenerativas. Contudo, ainda se desconhece se o stress oxidativo é uma causa ou consequência da própria doença.
Os antioxidantes são amplamente usados no fabrico de suplementos dietéticos e têm sido amplamente estudados no âmbito da investigação de doenças como o cancro, doenças coronárias e até mesmo no mal de montanha. Embora alguns estudos iniciais tenham sugerido que os suplementos de antioxidantes podiam ter benefícios na saúde, ensaios clínicos realizados mais tarde não detectaram qualquer benefício, tendo sugerido, pelo contrário, que suplementos em excesso podem ser nocivos.[2][3]
Para além do seu uso no campo da medicina, estes compostos têm imensas aplicações industriais, como conservantes alimentares, cosmética, e na prevenção da degradação da borracha. São importantes aditivos na gasolina, prevenindo a formação de gomas que interferem com a actividade dos motores de combustão interna.[4]
História[editar | editar código-fonte]
Como parte importante na sua adaptação a partir da vida marinha, as plantas terrestres começaram a produzir antioxidantes não-marinhos como ácido ascórbico (vitamina C), polifenóis e tocoferóis. A evolução de plantas angiospérmicas entre 50 a 200 milhões de anos atrás, ocorrida sobretudo durante o jurássico, teve como consequência o desenvolvimento de inúmeros pigmentos antioxidantes como defesa contra as espécies reactivas do oxigénio que são subprodutos da fotossíntese.[5][6] O termo antioxidante foi inicialmente usado referindo-se especificamente a um químico que impedisse o consumo de oxigénio. No fim do século XIX e início do século XX, efectuaram-se investigações exaustivas sobre o uso de antioxidantes para importantes processos industriais, como na prevenção da corrosão do metal, a vulcanização da borracha, e a polimerização de combustíveis na incrustação em motores de combustão interna.[7]
As pesquisas iniciais sobre o papel dos antioxidantes na biologia focaram-se no seu uso na prevenção da oxidação de gorduras insaturadas, que são a causa da rancificação.[8] A actividade do antioxidante podia ser medida simplesmente através da colocação da gordura num invólucro fechado e medindo a taxa de consumo de oxigénio. No entanto, foi a identificação das vitaminas A, C, e E enquanto antioxidantes que revolucionou o tema e levou à percepção da real importância dos antioxidantes na bioquímica dos organismos vivos.[9][10]
Os mecanismos de acção prováveis dos antioxidantes foram inicialmente investigados quando se observou que uma substância com actividade antioxidativa seria muito provavelmente uma que se oxidava a si própria.[11] A investigação sobre a forma como a vitamina E previne o processo da peroxidação dos lípidos levou à identificação dos antioxidantes como agentes de redução que previnem reacções de oxidação, frequentemente pela neutralização das espécies reactivas do oxigénio antes que possam danificar as células.[12]
O desafio da oxidação na biologia[editar | editar código-fonte]

Um paradoxo no metabolismo demonstra que, apesar da grande maioria da vida na Terra necessitar de oxigénio para a sua própria existência, o oxigénio é uma molécula altamente reactiva que danifica organismos vivos através da produção de espécies reactivas do oxigénio.[13] Como consequência, os organismos apresentam uma rede complexa de metabólitos e enzimas antioxidantes que trabalham juntos de modo a prevenir os danos resultantes da oxidação em componentes celulares como o ADN, proteínas e lípidos.[1][14] Geralmente, os sistemas antioxidantes ou impedem a formação destas espécies, ou eliminam-nas antes que possam danificar componentes vitais das células.[1][13] Porém, uma vez que as espécies reactivas do oxigénio desempenham funções úteis nas células, como a sinalização da redução de oxidação, a função dos sistemas antioxidantes não é remover completamente os antioxidantes, mas sim mantê-los nos níveis de referência.[15]
As espécies reactivas do oxigénio produzidas nas células incluem o peróxido de hidrogénio (H2O2), o ácido hipocloroso, e radicais livres como o radical hidroxilo (·OH) e o anião superóxido (O2−).[16] O radical hidroxilo é particularmente instável e reage rápida e aleatoriamente com a maior parte das moléculas biológicas. Esta espécie é produzida a partir do peróxido de hidrogénio em reacções redox de catálise metálica, como a reacção de Fenton.[17] Estes antioxidantes podem danificar as células ao iniciar reacções químicas em cadeia como a peroxidação de lípidos, ou através da oxidação de ADN ou proteínas.[1] Os danos no ADN podem causar mutações e possivelmente cancro se não forem revertidos por mecanismos de reparação de ADN,[18][19] enquanto que os danos nas proteínas causam inibição enzimática, desnaturação e degradação proteíca.[20]
O recurso ao oxigénio como parte do processo de geração de energia metabólica produz espécies reactivas do oxigénio.[21] Neste processo, o anião superóxido é produzido como um subproduto em várias etapas da cadeia de transporte de electrões.[22] De particular importância é a a redução da Coenzima Q10 no complexo III, uma vez que se forma como intermediário um radical livre altamente reactivo (Q·−). Este intermediário instável pode levar a "fugas" de electrões, quando estes últimos passam directamente para o oxigénio e formam o anião superóxido, em vez de se moverem através da sequência normal de reacções controladas na cadeia de transporte dos electrões.[23] O peróxido é também formado pela oxidação de flavoproteínas, como o complexo I.[24] Contudo, embora estas enzimas possam produzir oxidantes, a importância relativa da cadeia de transporte de electrões em relação a outros processos de produção de peróxido ainda não é clara.[25][26] Nas plantas, algas e cianobactérias, as espécies reactivas do oxigénio são também produzidas durante a fotossíntese,[27] sobretudo em condições de grande intensidade luminosa.[28] Este efeito é contrabalançado em parte pela participação de carotenoides na fotoinibição, que envolve a reacção destes antioxidantes com formas sobre-reduzidas dos centros reaccionais fotossintéticos de modo a prevenir a produção de espécies reactivas do oxigénio.[29][30]
Metabólitos[editar | editar código-fonte]
Sumário[editar | editar código-fonte]
Os antioxidantes são classificados em duas divisões amplas, dependendo se são ou não solúveis em água (hidrofílicos ou hidrofóbicos) e se são ou não solúveis em lípidos (lipofílicos ou lipofóbicos). De uma maneira geral, os antioxidantes solúveis em água reagem com oxidantes no citosol celular e no plasma sanguíneo, enquanto antioxidantes solúveis em lípidos protegem as membranas celulares da peroxidação dos lípidos.[1] Estes compostos podem ser sintetizados no próprio corpo ou obtidos através da dieta alimentar.[14] Os vários tipos de antioxidantes estão presentes numa grande variedade de concentrações em fluidos e tecidos do corpo humano, estando alguns presentes sobretudo em células, como a glutationa ou a ubiquinona, enquanto outros estão distribuídos uniformemente, como o ácido úrico (ver tabela em baixo). Alguns antioxidantes encontram-se apenas em determinados organismos, podendo ser agentes patogénicos e factor de virulência.[31]
A importância relativa e as interacções entre os diferentes antioxidantes formam uma problemática complexa, uma vez que os vários sistemas metabólitos e enzimáticos têm efeitos sinérgicos e interdependentes entre cada um deles.[32][33] A acção de um antioxidante pode assim depender do correcto funcionamento dos outros componentes do sistema antioxidante.[14] A quantidade de protecção proporcionada por qualquer antioxidante dependerá também da sua concentração, da sua reactividade perante determinada espécie reactiva ao oxigénio e do estatuto dos demais antioxidantes com que interage.[14]
Alguns compostos contribuem para a defesa antioxidante através da formação de quelatos de metais de transição, impedindo-os de catalisar a produção de radicais livres na célula. Especialmente importante é a capacidade para agarrar o ferro, presente em certas proteínas como a transferrina e ferritina.[26] O selénio e o zinco são frequentemente citados como "nutrientes antioxidantes", embora não possuam qualquer acção antioxidante por si próprios, sendo apenas necessários para a actividade de algumas enzimas antioxidantes, como demonstrado em baixo.
| Metabólito antioxidante | Solubilidade | Concentração no soro humano (μM)[34] | Concentração no tecido hepático (μmol/kg) |
|---|---|---|---|
| Ácido ascórbico (vitamina C) | Água | 50 – 60[35] | 260 (humanos)[36] |
| Glutationa | Água | 4[37] | 6 400 (humanos)[36] |
| Ácido lipóico | Água | 0,1 – 0,7[38] | 4 – 5 (rat)[39] |
| Ácido úrico | Água | 200 – 400[40] | 1 600 (humanos)[36] |
| Carotenos | Lípidos | β-caroteno: 0,5 – 1[41] | 5 (humanos, carotenóides totais)[43] |
| α-Tocoferol (vitamina E) | Lípidos | 10 – 40[42] | 50 (humanos)[36] |
| Ubiquinol (coenzima Q) | Lípidos | 5[44] | 200 (humanos)[45] |
Ácido úrico[editar | editar código-fonte]
O ácido úrico (AU) é uma oxipurina produzida a partir da xantina pela enzima xantina oxidase, sendo um produto intermediário do metabolismo da purina.[46] Na quase totalidade dos animais terrestres, a urato oxidase serve seguidamente de catalisador na oxidação de ácido úrico em alantoína.[47] Note-se porém que, nos humanos e na maioria dos primatas, embora o gene da urato oxidase esteja presente não é funcional, pelo que este estágio de processamento do AU não ocorre.[47][48] As razões evolucionárias que explicam esta perda da conversão úrica em alantoína são ainda tópico de especulação,[49][50] mas os efeitos antioxidantes do AU têm levado à proposição por parte dos investigadores que esta mutação tenha sido benéfica para os primeiros primatas e hominídeos.[50][51] Estudos sobre a aclimatação a altitudes elevadas sustentam a hipótese de que o AU age como antioxidante através da mitigação do stress oxidativo causado pela hipóxia hipoxémica.[52] Em estudos animais que investigam doenças derivadas do stress oxidativo, a introdução de AU tanto previne a doença, como a ameniza, tendo levado investigadores a propor que o facto seja devido às propriedades antioxidantes do ácido.[53] A proposta tem sido confirmada por estudos relativos ao mecanismo antioxidante do AU.[54] Gwen Scott explica o significado desta descoberta, propondo que "os níveis de ácido úrico no soro estão inversamente associados à incidência de esclerose múltipla (EM) nos humanos, uma vez que os pacientes de EM mostram baixos níveis de AU e indivíduos com gota raramente desenvolvem a doença. Além disso, a administração de AU é terapêutica em Encefalomelite Alérgica Experimental (EAE),[55] um modelo animal de EM."[53][56][57] Enquanto que o mecanismo de actuação antioxidante do AU está bem estudado, a alegação de que os seus níveis têm uma relação directa com a EM é ainda controversa e requer mais investigação antes de poderem ser retiradas conclusões sólidas.[58][59] Quando comparado com os demais/todos os outros antioxidantes, o AU é o que tem a maior concentração no soro,[40] e proporciona cerca de metade da capacidade antioxidante serológica total'.[60] A actividade antioxidante do ácido úrico é igualmente complexa, dado que não reage contra todos os oxidantes, como por exemplo os superóxidos, mas reage contra o peroxinitrito,[61] peróxidos, e ácido hipocloroso.[46] Entre os muito factores de risco de uma terapia com AU encontra-se a preocupante associação entre níveis elevados de AU (hiperuricemia) e a patologia reumatológica conhecida como gota.[62] Por si só, o risco de gota relacionado com altos níveis de AU (415–530 μmol/L) é apenas de 0,5% por ano, valor que aumenta para 4,5% se considerarmos níveis supersaturados de AU (535+ μmol/L).[63] A maioria destes estudos mencionados determinou as acções antioxidantes do AU dentro de níveis fisiológicos normais,[52][61] tendo alguns encontrado actividade antioxidante a níveis tão altos como 285 μmol/L.[64] Os efeitos do ácido úrico em condições como AVCs e enfartes ainda não foram completamente compreendidos, tendo alguns estudos estabelecido uma ligação entre altos níveis de AU e aumento da mortalidade,[65][66] enquanto outros, mais cautelosos, não mostram qualquer associação.[61] Esta situação pode dever-se à activação do ácido úrico como mecanismo de defesa perante o stress oxidativo, mas agindo em vez disso como um pró-oxidante em casos onde transtornos metabólicos fazem disparar a sua produção para níveis bastante superiores ao normal.[61][65][66]
Ácido ascórbico[editar | editar código-fonte]
O ácido ascórbico, também designado por ascorbato ou vitamina C, é um catalisador redox (redução-oxidação) monossacarídeo presente tanto em animais como plantas. Uma vez que durante a evolução dos primatas uma mutação fez com que se perdesse uma das enzimas necessárias para a produção de ácido ascórbico, os humanos necessitam de obtê-lo através da dieta alimentar, sendo portanto uma vitamina.[67] A maior parte dos restantes animais são capazes de produzir este composto pelo próprio corpo e não necessitam de o ter presente na dieta.[68] O ácido ascórbico é necessário na conversão do pro-colagénio em colagénio através da oxidação de resíduos de prolina em hidroxiprolina. Noutras células, é mantido na sua forma reduzida através da reacção com a glutationa, que pode ser catalisada pela proteína disulfide-isomerase e glutarredoxinas.[69][70] O ácido ascórbico é um catalisador redox que pode reduzir, e portanto neutralizar, as espécies reactivas do oxigénio, como o peróxido de hidrogénio.[71] Para além dos seus efeitos antioxidantes directos, o ácido ascórbico é também um substrato para a enzima redox ascorbato peroxidase, função particularmente importante na resistência das plantas ao stress.[72] Em todas as plantas podem ser observados elevados níveis de ácido ascórbico, chegando a atingir concentrações de 20 milimols nos cloroplastos.[73]
Glutationa[editar | editar código-fonte]
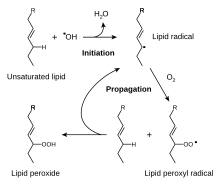
A glutationa é um peptídeo que contém cisteína presente na maior parte das formas de vida aerobiótica.[74] Não é necessária a sua ingestão, sendo em vez disso sintetizado nas células a partir dos seus constituintes aminoácidos.[75] As propriedades antioxidantes da glutationa devem-se à presença do grupo dos tióis na sua porção de cisteína, sendo agentes de redução que podem ser reversamente oxidados e reduzidos. Nas células, a glutationa é conservada na sua forma reduzida pela enzima glutationa redutase, e por sua vez reduz outros metabólitos e sistemas enzimáticos como o ascorbato no ciclo glutationa-ascorbato, glutationa peroxidases e glutarredoxinas, reagindo também directamente com os oxidantes.[69] Devido à sua alta concentração e ao seu papel central na manutenção do estado redox das cálulas, a glutationa é um dos mais importantes antioxidantes celulares.[74] Nalguns organismos, a glutationa é substituída por outros tióis, como o micotiol nas actinobacterias, o bacilitiol nalgumas bactérias Gram-positivas,[76][77] ou por tripanotiona nas kinetoplastea.[78][79]
Melatonina[editar | editar código-fonte]
A melatonina é um antioxidante poderoso,[80] atravessando facilmente as membranas celulares e a barreira hematoencefálica.[81] Ao contrário de outros antioxidantes, a melatonina não atravessa o ciclo de redução-oxidação, que é a capacidade de uma molécula em se submeter a repetidas reduções e oxidações. O ciclo redox pode permitir a outros antioxidantes, como a vitamina C, agirem como pró-oxidantes, o que leva à formação de radicais livres. Em consequência disso, tem sido referida como o antioxidante terminal ou suicida.[82]
Tocoferóis e tocotrienóis (vitamina E)[editar | editar código-fonte]
A vitamina E é uma designação colectiva que engloba oito tocoferóis e tocotrienóis, que são vitaminas solúveis em lípidos com propriedades antioxidantes.[83][84] Entre elas, a mais estudada tem sido a α-tocoferol, por ser a mais biodisponível já que é esta forma que o corpo preferencialmente absorve e metaboliza.[85]
Tem sido afirmado que a forma α-tocopherol é o mais importante antioxidante solúvel em lípidos e que protege as membranas da oxidação através da reacção com radicais lípidos produzidos na cadeia reactiva da peroxidação de lípidos.[83][86] Isto elimina os radicais livres intermédios e impede a reacção de propagação de prosseguir. Esta reacção produz radicais de α-tocoferoxil oxidados que podem ser reciclados de volta para a forma reduzida activa por outros antioxidantes, como o ácido ascórbico, o retinol ou o ubiquinol.[87] Isto está de acordo com descobertas que mostram que o α-tocoferol protege, ao contrário dos antioxidantes solúveis em água, com eficácia células deficientes em glutationa peroxidase 4 (GPx4) da morte.[88]
Contudo, o papel e importância das várias formas da vitamina E são ainda pouco claros,[89][90] tendo sido sugerido que a mais importante função da α-tocoferol seria a de molécula de sinalização, com esta molécula a não ter qualquer papel significativo no metabolismo antioxidante.[91][92] As funções das restantes formas da vitamina E são ainda menos compreendidas, embora a γ-tocoferol seja um nucleófilo capaz de reagir com agentes mutagénicos electrófilos[85] e os tocotrienóis possam ser importantes na protecção dos neurónios.[93]
Actividade pró-oxidante[editar | editar código-fonte]
Os antioxidantes que são agentes de redução podem também actuar como pró-oxidantes. Por exemplo, a vitamina C mostra actividade antioxidante quando reduz substâncias oxidantes como o peróxido de hidrogénio,[94] no entanto reduzindo também iões de metal que geram radicais livres através da Reacção de Fenton.[95][96]
- 2 Fe3+ + Ascorbato → 2 Fe2+ + Desidroascorbato
- 2 Fe2+ + 2H2O2 → 2 Fe3+ + 2 OH· + 2 OH−
A importância relativa das actividades antioxidantes e pró-oxidantes dos antioxidantes é um tema ainda em investigação, mas a vitamina C, que exerce os seus efeitos vitamínicos através da oxidação dos polipeptídeos, aparenta ter uma acção sobretudo antioxidante no corpo humano.[95][97] Porém, não existe tanta informação disponível relativamente a outros antioxidantes presentes na dieta alimentar, como a vitamina E,[98] ou os polifenóis.[99][100]
Potencial nocivo dos suplementos de antioxidantes[editar | editar código-fonte]
Existem provas de que os suplementos de antioxidantes estimulam as doenças e aumentam a mortalidade nos humanos.[100][101] Foi anteriormente sugerida a hipótese de que os radicais livres poderiam induzir uma resposta endógena, o que levaria a adaptações mais eficazes na protecção contra os radicais exogénicos (e possivelmente outros componentes tóxicos).[102] Conclusões recentes baseadas em experiências dão forte apoio a esta hipótese, mostrando que a indução da produção de radicais livres endógenos aumenta a esperança de vida da Caenorhabditis elegans.[103] Acima de tudo, esta indução do aumento da esperança de vida é impedida pelos antioxidantes, fornecendo provas concretas de que os radicais tóxicos podem aumentar hormeticamente a esperança de vida e possuir benefícios para a saúde.[100][101]
Sistemas enzimáticos[editar | editar código-fonte]

Sumário[editar | editar código-fonte]
Para além das moléculas com propriedades antioxidantes mencionadas na secção anterior, as células encontram-se protegidas do stress oxidativo por uma rede interactiva de enzimas antioxidantes.[1][13] Através destas redes enzimáticas, espécies reactivas de oxigénio libertadas em processos essenciais do metabolismo como a fosforilação oxidativa são inicialmente convertidas em peróxido de hidrogénio e mais tarde reduzidas até à forma de água. Este percurso de desintoxicação é consequência de múltiplas enzimas, sendo o processo catalisado pelas enzimas superóxido dismutase. O peróxido de hidrogénio é depois removido através de várias catalases. Tal como no caso dos metabólitos antioxidantes, determinar as contribuições individuais destas enzimas para o conjunto das defesas antioxidantes é, por enquanto, inexequível laboratorialmente. Todavia, a aplicação da técnica de ratinhos knockout, com a geração e produção de ratinhos trangénicos em que se encontra suprimida apenas uma enzima antioxidante à vez, pode revelar-se uma via de investigação frutífera.[104]
Superóxido dismutase, catalase e peroxirredoxinas[editar | editar código-fonte]
Os superóxidos dismutase (SOD) são uma classe de enzimas estruturalmente relacionadas que catalisam a hidrólise do anião superóxido em oxigénio e peróxido de hidrogénio.[105][106] As enzimas SOD encontram-se presentes em quase todas as células aerobióticas e em fluidos extracelulares.[107] Estas enzimas possuem ainda, como cofactores, iões metálicos que, dependendo da isozima em questão, podem ser catiões de cobre, zinco, manganês ou ferro. Nos humanos, os SOD ferro/zinco encontram-se no citosol, enquanto que o SOD de manganês está presente nas mitocôndrias.[106] Existe ainda uma terceira forma de SOD no líquido extracelular em que as enzimas contêm cobre e zinco nos seus centros activos.[108] A isozima mitocôndrial parece ser, destas três, a mais importante biologicamente, uma vez que os ratos aos quais lhes foi retirada morrem imediatamente após o nascimento.[109] Por outro lado, os ratos sem o SOD cobre/zinco mantêm-se vivos, mas sofrem de inúmeras patologias e têm esperança de vida diminuta, enquanto ratos sem o SOD extracelular apresentam poucas deficiências.[104][110] Nas plantas, as isozimas SOD estão presentes no citosol e nas mitocôndrias, sendo também encontrado um SOD de ferro nos cloroplastos que não se encontra nos vertebrados ou nas leveduras.[111]
As catalases são enzimas que catalisam a conversão de peróxido de hidrogénio em água e oxigénio, recorrendo a um cofactor de ferro ou manganês.[112][113] Esta proteína encontra-se nos peroxissomas da maior parte das células eucarióticas.[114] A catalase é uma enzima fora do comum uma vez que, embora o peróxido de hidrogénio seja o seu único substrato, obedece a um mecanismo de vaivém. Nesta situação, o seu cofactor é oxidado por uma molécula de peróxido de hidrogénio e é depois regenerado através da transferência do oxigénio confinado para uma segunda molécula ou substrato.[115] Apesar da sua aparente importância na remoção do peróxido de hidrogénio, quer os humanos com deficiência genética de catalase (acatalassemia), quer os ratos aos quais foi completamente suprimida a enzima, poucos efeitos patológicos sofrem.[116][117]

As peroxiredoxinas são peroxidases que catalisam a redução de peróxido de hidrogénio, hidroperóxidos orgânicos e também peroxinitrito.[119] Estão divididas em três classes: peroxirredoxinas 2-cisteína típicas; peroxirredoxinas 2-cisteína atípicas; e peroxirredoxinas 1-cisteína.[120] Estas têm todas o mesmo mecanismo catalítico básico, no qual existe um resíduo de cisteína com actividade de oxirredução - o resíduo de cistina peroxidático no centro activo da enzima - que é oxidado pelo substrato peróxido, resultando num ácido sulfénico.[121] A oxidação excessiva deste resíduo de cisteína em peroxirredoxinas desactiva estas enzimas, no entanto isto pode ser revertido através da acção de sulfirredoxinas.[122] As peroxirredoxinas aparentam ser importantes no metabolismo antioxidante, uma vez que ratos de laboratório aos quais foi suprimida a peroxirredoxina 1 ou 2 revelam uma curta esperança de vida e sofrem de anemia hemolítica. Ademais, também as plantas usam peroxirredoxinas para remover o peróxido de hidrogénio produzido nos cloroplastos.[123][124][125]
Sistemas de tiorredoxina e glutationa[editar | editar código-fonte]
O sistema da tiorredoxina contém a proteína tiorredoxina 12-k Da e a sua parceira tiorredoxina redutase.[126] As proteínas relacionadas com a tiorredoxina estão presentes em todos os organismos sequenciados. As plantas, como a Arabidopsis thaliana, revelam uma imensa diversidade de isoformas.[127] O centro activo da tiorredoxina consiste em duas cisteínas vizinhas, parte de um padrão sequencial CXXC, que pode alternar entre uma forma activa de ditiol (reduzida) e uma forma de dissulfeto oxidada. No seu estado activo, a tiorredoxina opera como um eficaz agente de redução, eliminando as espécies reactivas do oxigénio e mantendo outras proteínas no seu estado reduzido.[128] Depois de ter sido oxidada, a tiorredoxina activa é regenerada pela acção da tiorredoxina redutase, usando NADP como doador de electrões.[129]
O sistema da glutationa contém glutationa, glutationa redutase, glutationa peroxidases e glutationa S-transferase.[74] Este sistema está presente nos animais, plantas e microorganismos.[74][130] A glutationa peroxidase é uma enzima que contém quatro cofactores de selénio que catalisam a separação do peróxido de hidrogénio e hiperóxidos orgânicos. Existem pelo menos quatro isozimas glutationa peroxidases diferentes nos animais.[131] A glutationa peroxidase 1 é a mais abundante e um eliminador bastante eficaz de peróxido de hidrogénio. Por sua vez, a glutationa peroxidase 3 é mais activa contra os hiperóxidos lípidos. Surpreendentemente, a glutationa peroxidase 1 é dispensável, já que ratos aos quais esta enzima foi suprimida mostram uma esperança de vida normal,[132] mas são hipersensíveis ao stress oxidativo induzido.[133] Ainda, as glutationa S-transferases demonstram ser activas sobretudo com próxidos lípidos.[134] Estas enzimas encontram-se sobretudo no fígado, desempenham também um papel no metabolismo de desintoxicação.[135]
O stress oxidativo na saúde[editar | editar código-fonte]
Pensa-se que o stress oxidativo contribui para um grande número de doenças, incluindo muitas doenças neurodegenerativas como: a doença de Alzheimer,[136][137] a doença de Parkinson e as doenças do neurónio motor;[138][139] assim como patologias causadas pela diabetes[140][141] e ainda a artrite reumatoide.[142] Em muitos destes casos, ainda não é claro se os oxidantes espoletam a doença ou se são produzidos como efeito secundário desta a partir da degeneração generalizada do tecido.[16] Um dos casos em que esta ligação está particularmente bem estudada é o do papel do stress oxidativo nas doenças cardiovasculares. Nestas doenças a oxidação das lipoproteínas de baixa densidade (LDL) desencadeia o processo da aterogénese que dá origem à deposição de placas de ateroma nos vasos sanguíneos, acabando por provocar as alterações hemodinâmicas que as caracterizam.[143][144]
Lesões oxidativas na molécula de ADN podem causar neoplasias. No entanto, várias enzimas antioxidantes como a superóxido dismutase, a catalase, a glutationa peroxidase, a glutationa redutase e a glutationa S-transferase, entre outras, protegem o ADN do stress oxidativo. Tem sido proposto que polimorfismos nestas enzimas podem estar associados a uma maior frequência de lesões no ADN e, consequentemente, ao aumento da predisposição do indivíduo para o desenvolvimento de fenómenos neoplásicos.[145]
Uma dieta de restrição calórica pode aumentar a esperança média de vida em muitos animais. Alguns estudos apontam para este efeito poder estar relacionado com uma redução do stress oxidativo. Com uma restrição da ingestão calórica, diminui a taxa metabólica e, consequentemente, diminui a quantidade de espécies reactivas de oxigénio produzidas pela fosforilação oxidativa e demais processos metabólicos.[146]
Existindo já estudos que corroboram o papel do stress oxidativo no envelhecimento em organismos como a Drosophila melanogaster e a Caenorhabditis elegans,[147][148] ainda não se estabeleceu indubitavelmente a mesma correlação em mamíferos.[149][150][151] De facto, uma revisão de 8 anos de estudos pela Universidade do Texas publicada em 2009 concluiu que, no conjunto de todas as manipulações de sistemas antioxidantes realizadas em ratos de laboratório naquela universidade, não existem conclusões com relevância estatística que associem o stress oxidativo ao envelhecimento.[152] As dietas que privilegiam frutas e hortaliças, alimentos ricos em antioxidantes, são benéficas para a saúde e reduzem alguns dos efeitos do envelhecimento. No entanto, os suplementos vitamínicos antioxidantes não mostram qualquer efeito mensurável no processo de envelhecimento, pelo que as acções das frutas e hortaliças neste fenómeno podem não estar sequer relacionadas com os seus componentes antioxidantes.[153][154] Uma das razões para tal pode ser o facto de o consumo de moléculas antioxidantes como os polifenóis e vitamina E originar alterações mais significativas noutras vias do metabolismo, sendo o seu papel nessas vias o verdadeiro motivo da sua importância na nutrição humana.[91][155]
Efeitos na saúde[editar | editar código-fonte]
Tratamento de doenças[editar | editar código-fonte]
O cérebro é especialmente vulnerável a lesões causadas pela oxidação, devido ao seu elevado metabolismo basal e ao facto de a sua constituição química ser, em grande parte, lipídica - 49-66% da substância branca e 36-40% da substância cinzenta, em tecido desidratado.[156][157] Assim, os antioxidantes são frequentemente usados como medicação em várias lesões cerebrais. Para o tratamento da lesão por reperfusão ou do traumatismo cranioencefálico pode recorrer-se a compostos miméticos da superóxido dismutase,[158] como o tiopentato de sódio e o propofol.[159] No tratamento dos AVC está a ser estudada a administração de ebseleno[160] e do fármaco experimental NXY-059.[161] Estes compostos parecem prevenir a ocorrência de stress oxidativo nos neurónios, prevenindo também a apoptose e a necrose e consequentes danos neurológicos. Os antioxidantes estão ainda a ser investigados como possível tratamento para doenças neurodegenerativas como a doença de Alzheimer, a doença de Parkinson ou a esclerose lateral amiotrófica[162][163] e como forma de prevenção da perda de audição por exposição ao ruído.[164] Estes antioxidantes podem ainda revelar-se benéficos noutros contextos clínicos, como a prevenção de danos hepáticoss derivados do consumo excessivo de álcool (Doença hepática alcoólica).[165]
Prevenção de doenças[editar | editar código-fonte]

Os consumidores de fruta e hortaliças apresentam menor risco de vir a sofrer de doenças cardíacas e algumas doenças neurológicas,[166] existindo conclusões de que alguns tipos de hortaliças, e frutas em geral, oferecem alguma protecção contra alguns tipos de cancro.[167] Uma vez que estes géneros alimentícios são uma grande fontes de antioxidantes, foi proposto que os antioxidantes poderiam prevenir alguns tipos de doenças. Esta hipótese tem sido testada clinicamente, mas não parece ser verdadeira, já que os suplementos de antioxidantes não demonstram qualquer efeito inequívoco na redução do risco de doenças crónicas cardíacas ou cancerígenas.[166][168] Esta conclusão sugere que os benefícios possam advir de outras substâncias presentes nas frutas e nas hortaliças, possivelmente os flavonóides, ou ter origem numa mistura complexa de substâncias.[169][170]
Pensa-se que a oxidação de lipoproteínas de baixa densidade no sangue contribua para doenças cardíacas e observações iniciais permitiram notar que indivíduos que tomavam suplementos de vitamina E apresentavam menor risco de vir a desenvolver doenças cardíacas.[171] No seguimento destas observações, foram conduzidos pelo menos sete ensaios clínicos de grande dimensão, de modo a comprovar os efeitos dos suplementos antioxidantes com vitamina E, em doses dos 50 aos 600 mg por dia. No entanto, nenhum destes ensaios demonstrou existir um efeito estatisticamente significativo da vitamina E no número total de mortes ou nas mortes causadas por doenças cardiovasculares.[172] Estudos sequentes também mostraram conclusões desfavoráveis a esta hipótese.[173][174] Não está esclarecido se as doses usadas nestes ensaios, ou na maior parte dos suplementos dietéticos, são capazes de produzir uma redução significativa do stress oxidativo.[175] Apesar do papel evidente do stress oxidativo nas doenças cardiovasculares, ensaios controlados com a administração de vitaminas antioxidantes não mostraram qualquer redução: tanto no risco de vir a contrair a doença, como na progressão da doença já em curso.[176][177]
Enquanto que na maioria dos ensaios se tenha recorrido a suplementos com doses elevadas de antioxidantes, o estudo "Supplémentation en Vitamines et Mineraux Antioxydants" (SU.VI.MAX) testou o efeito de suplementos com doses equivalentes às presentes numa dieta regular e saudável.[178] Aos mais de 12,5 mil indivíduos de ambos os sexos que participaram, foram administradas: ou doses baixas de antioxidantes (120 mg de ácido ascórbico, 30 mg de vitamina E, 6 mg de ß-caroteno, 100 µg de selénio e 20 mg de zinco) ou comprimidos placebo durante uma média de sete anos e meio. O estudo concluiu que baixas doses de suplementos antioxidantes diminuíram a incidência de cancro total e a mortalidade multicausa nos homens, mas não nas mulheres. A eficácia dos suplementos apenas nos homens pode estar relacionada com as suas baixas taxas de certos antioxidantes, sobretudo ß-caroteno.[178]
Inúmeras empresas nutracêuticas e de alimentação saudável comercializam várias fórmulas de antioxidantes como suplementos dietéticos de uso bastante comum em países desenvolvidos.[179] Estes suplementos podem incluir antioxidantes específicos, como o polifenol ou o resveratrol (feito a partir de sementes de uva ou raízes de polygonum),[180] ou combinações de antioxidantes, como os produtos "ACES" que contêm ß-caroteno (provitamina A), vitamina C, E e Selénio, ou ainda plantas que contenham antioxidantes, como o chá verde. Embora alguns níveis de vitaminas antioxidantes e minerais na dieta sejam necessários para manter a saúde, há dúvidas consideráveis se estes suplementos de antioxidantes são benéficos ou prejudiciais e, caso sejam benéficos, quais é que são precisos e em que doses.[166][168][181] De facto, alguns autores argumentam que as hipóteses de os antioxidantes poderem prevenir doenças crónicas está hoje posta de lado e que a hipótese foi mal formulada desde o início.[182] Pelo contrário, polifenóis dietéticos podem exercer papéis não antioxidantes em concentrações diminutas que afectam a sinalização celular, a sensibilidade dos receptores, a actividade inflamatória das enzimas ou a regulação genética.[183][184]
Ainda relativamente à esperança de vida, chegou até a ser sugerido que níveis moderados de stress oxidativo poderiam aumentar a longevidade do verme Caenorhabditis elegans, através da indução de uma resposta protectiva a níveis elevados de espécies reactivas do oxigénio.[185] A sugestão de que o aumento da esperança de vida advém de maior stress oxidativo entra em conflito com os resultados obtidos na Saccharomyces cerevisiae,[186] sendo a situação nos mamíferos ainda menos clara.[149][150][151] Ainda assim, os suplementos de antioxidantes não aparentam contribuir de alguma forma para o aumento da esperança de vida nos humanos.[187]
Exercício físico[editar | editar código-fonte]
Durante o exercício físico, o consumo de oxigénio pode aumentar até dez vezes.[188] Isto leva a um aumento muito significativo da produção de oxidantes e resulta em lesões que contribuem para a fadiga muscular durante e depois do exercício. A resposta inflamatória que ocorre depois de exercício árduo está também associada ao stress oxidativo, especialmente nas 24 horas seguintes. A resposta do sistema imunitário aos danos ocorridos tem o seu máximo dois a sete dias depois do exercício, que corresponde ao período durante o qual ocorre a maior parte da adaptação que proporciona tonificação muscular. Durante este processo, são produzidos nos neutrófilos radicais livres para remoção do tecido danificado. Como consequência, níveis excessivos de antioxidantes podem inibir os mecanismos de recuperação e adaptação.[189] Os suplementos de antioxidantes podem também prevenir qualquer um dos benefícios normalmente proporcionados pelo exercício, como a sensibilidade insulínica.[190]
As evidências relativas aos benefícios dos suplementos antioxidantes no exercício vigoroso são ainda contraditórias. Existem fortes indícios que uma das adaptações resultantes do exercício é o fortalecimento das defesas antioxidantes do corpo, sobretudo do sistema da glutationa, de forma a regular o maior stress oxidativo.[191] Este efeito pode oferecer, até certo ponto, uma protecção contra doenças associadas ao stress oxidativo, o que forneceria uma explicação parcial para a menor incidência de doenças graves e melhor condição clínica entre aqueles que praticam exercício regularmente.[192]
Contudo, não são observados quaisquer benefícios na condição física de atletas que tomam suplementos de vitamina E.[193] De facto, apesar do seu papel fundamental na prevenção de peroxidação da membrana lípida, seis semanas de suplementação com vitamina E não apresentaram qualquer efeito ao nível da recuperação do tecido muscular muscular de maratonistas.[194] Embora não pareça existir uma maior necessidade de vitamina C entre os atletas, existem algumas evidências de que os suplementos desta vitamina aumentam a resistência ao exercício intenso e de que os suplementos de vitamina C antes de exercício violento podem reduzir a quantidade de lesão do tecido muscular.[195][196] Porém, outros estudos não verificaram tal ocorrência, e algumas investigações sugerem que suplementos em quantidades tão altas como 1 000 mg chegam mesmo a inibir a recuperação.[197]
Uma revisão publicada na revista Sports Medicine em 2011 analisou 150 estudos sobre suplementos antioxidantes durante a prática de exercício. A revisão concluiu que mesmo os estudos que observaram uma redução no stress oxidativo não conseguiram demonstrar benefícios para a performance ou para a prevenção de danos musculares. Além disso, alguns estudos indicaram que os suplementos antioxidantes podiam mesmo actuar contra os benefícios cardiovasculares do exercício.[198]
Efeitos adversos[editar | editar código-fonte]
Os ácidos de redução relativamente fortes podem ter efeitos antinutrientes, ao ligar-se aos sais minerais como o ferro e o zinco no aparelho digestivo, impedindo-os de serem absorvidos.[199] Casos notáveis são o ácido oxálico, os taninos e o ácido fítico, bastante presentes em dietas ricas em plantas.[200] As deficiências de cálcio e ferro não são raras nas dietas alimentares de países em desenvolvimento, onde se consome pouca carne e onde são ingeridas grandes quantidades de ácido fítico através do feijão e pão ázimo integral.[201]
| Alimentos | Ácido de redução presente |
|---|---|
| Grão de cacau e chocolate, espinafre, nabo e ruibarbo.[202] | Ácido oxálico |
| Cereais integrais, milho, legumes.[203] | Ácido fítico |
| Chá, fava, repolho.[202][204] | Taninos |
Antioxidantes não-polares como o eugenol têm limites de toxicidade que podem ser ultrapassados com o uso indevido de óleos essenciais não diluídos.[205] A toxicidade associada a doses elevadas de antioxidantes solúveis em água, como o ácido ascórbico, é menos grave já que estes compostos podem ser facilmente expelidos através da urina.[206] Mais perigosas, doses muito elevadas de alguns antioxidantes podem representar efeitos nocivos a longo prazo. O estudo "beta-Carotene and Retinol Efficacy Trial" (CARET), levado a cabo em pacientes com cancro pulmonar revelou que os fumadores que tomavam suplementos com ß-caroteno e vitamina A apresentavam maior incidência da doença.[207] Estudos seguintes confirmaram estes efeitos adversos.[208]
Estes efeitos nocivos podem também ser observados em não-fumadores, como demonstrado numa metanálise recente, onde dados de cerca de 230.000 pacientes revelam que os suplementos de ß-aroteno, vitamina A ou vitamina E está associada com o aumento da mortalidade, não havendo, no entanto, qualquer efeito significativo na vitamina C.[101] A observação conjunta de todos os estudos controlados aleatórios não mostrou qualquer risco para a saúde; no entanto, foi detectado um aumento da mortalidade quando os ensaios de risco de alta qualidade e imparciais foram examinados separadamente. Contudo, uma vez que a maioria destes ensaios era efectuado quer em idosos, quer em pacientes que já sofriam da doença, os resultados podem não se aplicar à população em geral.[209] Esta metanálise foi mais tarde repetida e aumentada pelos mesmos autores, incluindo as novas análises publicadas pela Colaboração Cochrane, e confirmados os resultados anteriores.[210] Estas duas publicações são consistentes com algumas metanálises anteriores que também sugeriam que a suplementação de vitamina E aumentavam a mortalidade,[211] e que os suplementos de antioxidantes aumentavam o risco de cancro do colón.[212] No entanto, os resultados desta metanálise são inconsistentes com outros estudos como o ensaio SU.VI.MAX, que sugeriu que os antioxidantes não têm qualquer efeito na mortalidade.[178][213][214][215] Em síntese, o elevado número de ensaios clínicos levados a cabo nos suplementos de antioxidantes sugere que, ou estes produtos não têm qualquer efeito na saúde, ou que causam um pequeno aumento na mortalidade na população idosa ou mais vulnerável.[101][166][168]
Ao mesmo tempo que os suplementos antioxidantes são amplamente usados nas tentativas de impedir o desenvolvimento do cancro, tem também sido proposto que os antioxidantes podem, paradoxalmente, interferir com os tratamentos da doença.[216] Pensou-se que isto ocorresse devido aos altos níveis de stress oxidativo que é gerado no meio ambiente das células cancerígenas, tornando-as mais susceptíveis ao ainda maior stress oxidativo induzido pelos tratamentos. Como resultado, ao reduzir o stress oxidativo nas cálulas cancerígenas, os suplementos de antioxidantes diminuem também a eficácia da radioterapia e da quimioterapia.[217][218] Por outro lado, outras revisões sugeriram que os antioxidantes poderiam reduzir os efeitos adversos ou aumentar a taxa de sobrevivência.[219][220]
Valores nos alimentos[editar | editar código-fonte]

A medição dos antioxidantes não é um processo simples, já que se trata de um grupo de compostos heterogéneo com diferentes reacções a diferentes espécies reactivas do oxigénio. Na ciência alimentar, o índice ORAC tornou-se no actual padrão para avaliar a força antioxidante dos alimentos simples, sumos e aditivos alimentares.[221][222] Outros ensaios de quantificação incluem o reagente Folin–Ciocalteu e a solução trolox.[223]
Os antioxidantes estão presentes numa grande variedade de alimentos, como as hortaliças, fruta, cereais, ovos, carne, legumes e frutos secos. Alguns antioxidantes como o licopeno e o ácido ascórbico podem-se decompor como resultado de armazenamento a longo prazo ou excesso de cozedura.[224][225] Outros compostos antioxidantes são mais estáveis, como por exemplo os antioxidantes polifenólicos presentes no chá ou nos cereais integrais.[226][227] Os efeitos da cozedura e do processamento alimentar são bastante complexos, já que podem também aumentar a biodisponibilidade dos antioxidantes, como no caso de alguns carotenóides nas hortaliças.[228] Regra geral, alimentos processados contêm menos antioxidantes do que os frescos e crus, uma vez que os processos de preparação causam exposição ao oxigénio.[229]
| Compostos antioxidantes | Alimentos com altos níveis destes antioxidantes[204][230][231] |
|---|---|
| Vitamina C (ácido ascórbico) | Fruta fresca e hortaliças |
| Vitamina E (tocoferóis, tocotrienóis) | Óleos vegetais |
| Antioxidantes polifenólicos (resveratrol, flavonoides) | Chá, café, soja, fruta, azeite, chocolate, canela, oregãos e vinho tinto |
| Carotenoides (licopeno, carotenos, luteína) | Fruta, hortaliças e ovos.[232] |
Os restantes oxidantes não são vitaminas, sendo produzidos no próprio corpo. Por exemplo, o ubiquinol (coenzima Q) é mal absorvido pelo sistema digestivo e é produzido nos humanos por via do mevalonato.[45] Outro exemplo é a glutationa, produzida a partir de aminoácidos. Como qualquer glutationa é separada logo após a ingestão de modo a libertar cistina, glicina e ácido glutámico antes de ser absorvida, mesmo grandes doses orais pouco efeito têm na concentração total de glutationa no organismo.[233][234] Embora grandes quantidade de aminoácidos ricos em enxofre, como a acetilcisteína, possam aumentar a glutationa,[235] não há ainda nenhuma evidência de que a ingestão de grandes quantidades destes precursores de glutationa seja benéfica em adultos saudáveis.[236] Administrar mais destes precursores pode ser útil como parte do tratamento de algumas doenças, como a síndrome do desconforto respiratório, a subnutrição proteica, ou a prevenção de danos no fígado causada pela sobredosagem de paracetamol.[235][237]
Outros compostos presentes na dieta podem alterar os níveis de antioxidantes agindo como pró-oxidantes. Neste caso, o consumo do composto causa stress oxidativo, ao qual o corpo responde induzindo maiores níveis de defesas antioxidantes, como as enzimas antioxidantes.[182] Alguns destes compostos, como o isotiocianato e a curcumina, podem ser agentes de quimiopreventivos que bloqueiem a transformação de células anómalas em células cancerígenas, ou mesmo que matem as já existentes.[182][238]
Aplicações tecnológicas[editar | editar código-fonte]
Conservantes alimentares[editar | editar código-fonte]
Os antioxidantes são usados como aditivos alimentares na prevenção contra a deterioração. As principais causas de deterioração dos alimentos são a exposição ao oxigénio e à luz solar, pelo que a sua conservação é feita mantendo-os na penumbra e selando-os em recipientes herméticos. No entanto, como o oxigénio é essencial para a respiração das plantas, conservá-las numa atmosfera anaeróbica dá origem a sabores desagradáveis e cores pouco apelativas.[239] Assim, a embalagem de produtos frescos é feita numa atmosfera protectora que apenas contém cerca de 8% de oxigénio. Os antioxidantes são uma classe especialmente importante de conservantes uma vez que, ao contrário da decomposição pela acção de bactérias ou fungos, as reacções de oxidação ocorrem igualmente de forma relativamente rápida nos alimentos congelados ou refrigerados.[240] Estes conservantes incluem antioxidantes naturais como o ácido ascórbico (AA, E300) e os tocoferóis (E306), bem como antioxidantes sintéticos como o galato de propilo (PG, E310), a tert-Butilohidroquinona (TBHQ), a BHA (E320) e o BHT (E321).[241][242]
As moléculas mais frequentemente atacadas pela oxidação são as gorduras insaturadas, tornando-se râncidas.[243] Uma vez que os lípidos oxidados perdem a cor e normalmente apresentam odores desagradáveis como aromas metálicos ou a enxofre, é importante evitar a oxidação em alimentos ricos em gorduras. Assim, estes alimentos raramente são conservados pela secagem, mas sim recorrendo ao fumeiro, salmoura ou fermentação. Mesmo os alimentos pobres em gordura como a fruta são esterilizados com antioxidantes antes de serem secos. A oxidação é muitas vezes catalisada pelos metais, sendo por isso que gorduras como a manteiga nunca devem ser envolvidas em papel de alumínio ou guardadas em recipientes metálicos. Alguns alimentos gordos, como o azeite, estão parcialmente protegidos da oxidação pelos antioxidantes naturais que contêm, mas são na mesma sensíveis à fotooxidação.[244]
Aplicações industriais[editar | editar código-fonte]
Os antioxidantes são frequentemente adicionados a produtos industriais. É comum a sua aplicação como estabilizador em combustíveis e lubrificantes na prevenção da oxidação, e nas gasolinas na prevenção da polimerização que leva à formação de resíduos nos motores.[245] Em 2007, o mercado global para os antioxidantes industriais movimentou um volume total de cerca de 880 mil toneladas, gerando receitas de 2,4 mil milhões de Euros (3,7 mil milhões de dólares).[246]
São amplamente usados na prevenção de degradação oxidativa de polímeros como as borrachas, plásticos e adesivos, evitando a perda de robustez e flexibilidade.[247] Polímeros com ligações covalentes, como a borracha natural e o polibutadieno, são especialmente susceptíveis à oxidação e ozonolise, podendo ser protegidos com antiozonantes. Os produtos feitos com polímeros sólidos sofrem rachadelas nas superfícies expostas à medida que o material se degrada e as cadeias moleculares se quebram. A forma como se quebram varia consoante o ataque seja feito pelo oxigénio ou pelo ozono. O primeiro causa rachadelas aleatórias, enquanto que o ozono produz sulcos mais profundos alinhados com o ângulo da força de tensão do produto. A oxidação e a degradação ultravioleta estão quase sempre ligadas, sobretudo porque a radiação ultravioleta produz radicais livres ao quebrar as ligações moleculares. Estes radicais reagem com o oxigénio e dão origem a radicais peróxidos que causam ainda mais danos, frequentemente dentro de uma reação em cadeia. Outros polímeros susceptíveis à oxidação incluem o polipropileno e o polietileno. O primeiro é mais sensível devido à presença de átomos de carbono secundários em cada unidade da cadeia. O ataque dá-se neste ponto porque o radical livre que se forma é mais estável do que um formado num átomo primário. A oxidação do polietileno ocorre normalmente nos elos mais fracos da cadeia molecular, como as ligações no polietileno de baixa densidade.
| Aditivo combustível | Componentes[248] | Aplicações[248] |
|---|---|---|
| AO-22 | N,N'-di-2-butyl-1,4-phenylenediamine | Óleos de turbina, óleos de transformador, fluidos hidráulicos, ceras e graxas |
| AO-24 | N,N'-di-2-butyl-1,4-phenylenediamine | Óleos de baixas temperaturas |
| AO-29 | 2,6-di-tert-butyl-4-methylphenol | Óleos de turbina, óleos de transformador, fluidos hidráulicos, ceras, graxas e gasolinas |
| AO-30 | 2,4-dimethyl-6-tert-butylphenol | JET e gasolinas, incluindo gasolinas para aviação |
| AO-31 | 2,4-dimethyl-6-tert-butylphenol | JET e gasolinas, incluindo gasolinas para aviação |
| AO-32 | 2,4-dimethyl-6-tert-butylphenol and 2,6-di-tert-butyl-4-methylphenol | JET e gasolinas, incluindo gasolinas para aviação |
| AO-37 | 2,6-di-tert-butylphenol | JET e gasolinas, amplamente aprovado para combustíveis de aviação |
Referências
- ↑ a b c d e f Sies, Helmut (1997). «Oxidative stress: Oxidants and antioxidants». Experimental physiology. 82 (2): 291–5. PMID 9129943. Consultado em 18 de janeiro de 2012. Arquivado do original em 12 de fevereiro de 2012
- ↑ Baillie, J.K.; Thompson, A.A.R.; Irving, J.B.; Bates, M.G.D.; Sutherland, A.I.; MacNee, W.; Maxwell, S.R.J.; Webb, D.J. (2009). «Oral antioxidant supplementation does not prevent acute mountain sickness: double blind, randomized placebo-controlled trial». QJM. 102 (5): 341–8. PMID 19273551. doi:10.1093/qjmed/hcp026
- ↑ Bjelakovic G; Nikolova, D; Gluud, LL; Simonetti, RG; Gluud, C (2007). «Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis». JAMA. 297 (8): 842–57. PMID 17327526. doi:10.1001/jama.297.8.842
- ↑ (em inglês) Werner Dabelstein, Arno Reglitzky, Andrea Schütze and Klaus Reders "Automotive Fuels" in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim.doi:10.1002/14356007.a16_719.pub2
- ↑ Benzie, I (2003). «Evolution of dietary antioxidants». Comparative Biochemistry and Physiology. 136 (1): 113–26. PMID 14527634. doi:10.1016/S1095-6433(02)00368-9
- ↑ Venturi, Sebastiano; Donati, Francesco M.; Venturi, Alessandro; Venturi, Mattia (2000). «Environmental Iodine Deficiency: A Challenge to the Evolution of Terrestrial Life?». Thyroid. 10 (8): 727–9. PMID 11014322. doi:10.1089/10507250050137851
- ↑ Mattill, H A (1947). «Antioxidants». Annual Review of Biochemistry. 16: 177–92. PMID 20259061. doi:10.1146/annurev.bi.16.070147.001141
- ↑ German, JB (1999). «Food processing and lipid oxidation». Advances in experimental medicine and biology. Advances in Experimental Medicine and Biology. 459: 23–50. ISBN 978-0-306-46051-7. PMID 10335367. doi:10.1007/978-1-4615-4853-9_3
- ↑ Jacob, RA (1996). «Three eras of vitamin C discovery». Sub-cellular biochemistry. 25: 1–16. PMID 8821966
- ↑ Knight, JA (1998). «Free radicals: Their history and current status in aging and disease». Annals of clinical and laboratory science. 28 (6): 331–46. PMID 9846200
- ↑ Moreau; Dufraisse (1922). «Comptes Rendus des Séances et Mémoires de la Société de Biologie». Sociéte de Biologie. 86: 321. OCLC 20845936
- ↑ Wolf, George (2005). «The discovery of the antioxidant function of vitamin E: The contribution of Henry A. Mattill». The Journal of nutrition. 135 (3): 363–6. PMID 15735064
- ↑ a b c Davies, KJ (1995). «Oxidative stress: The paradox of aerobic life». Biochemical Society Symposia. 61: 1–31. PMID 8660387
- ↑ a b c d Vertuani, Silvia; Angusti, Angela; Manfredini, Stefano (2004). «The Antioxidants and Pro-Antioxidants Network: An Overview». Current Pharmaceutical Design. 10 (14): 1677–94. PMID 15134565. doi:10.2174/1381612043384655
- ↑ Rhee, S. G. (2006). «CELL SIGNALING: H2O2, a Necessary Evil for Cell Signaling». Science. 312 (5782): 1882–3. PMID 16809515. doi:10.1126/science.1130481
- ↑ a b Valko, M; Leibfritz, D; Moncol, J; Cronin, M; Mazur, M; Telser, J (2007). «Free radicals and antioxidants in normal physiological functions and human disease». The International Journal of Biochemistry & Cell Biology. 39 (1): 44–84. PMID 16978905. doi:10.1016/j.biocel.2006.07.001
- ↑ Stohs, S; Bagchi, D (1995). «Oxidative mechanisms in the toxicity of metal ions». Free Radical Biology and Medicine. 18 (2): 321–36. PMID 7744317. doi:10.1016/0891-5849(94)00159-H
- ↑ Nakabeppu, Yusaku; Sakumi, Kunihiko; Sakamoto, Katsumi; Tsuchimoto, Daisuke; Tsuzuki, Teruhisa; Nakatsu, Yoshimichi (2006). «Mutagenesis and carcinogenesis caused by the oxidation of nucleic acids». Biological Chemistry. 387 (4): 373–9. PMID 16606334. doi:10.1515/BC.2006.050
- ↑ Valko, Marian; Izakovic, Mario; Mazur, Milan; Rhodes, Christopher J.; Telser, Joshua (2004). «Role of oxygen radicals in DNA damage and cancer incidence». Molecular and Cellular Biochemistry. 266 (1–2): 37–56. PMID 15646026. doi:10.1023/B:MCBI.0000049134.69131.89
- ↑ Stadtman, E. (1992). «Protein oxidation and aging». Science. 257 (5074): 1220–4. PMID 1355616. doi:10.1126/science.1355616
- ↑ Raha, S; Robinson, BH (2000). «Mitochondria, oxygen free radicals, disease and ageing». Trends in Biochemical Sciences. 25 (10): 502–8. PMID 11050436. doi:10.1016/S0968-0004(00)01674-1
- ↑ Lenaz, Giorgio (2001). «The Mitochondrial Production of Reactive Oxygen Species: Mechanisms and Implications in Human Pathology». IUBMB Life. 52 (3–5): 159–64. PMID 11798028. doi:10.1080/15216540152845957
- ↑ Finkel, Toren; Holbrook, Nikki J. (2000). «Oxidants, oxidative stress and the biology of ageing». Nature. 408 (6809): 239–47. PMID 11089981. doi:10.1038/35041687
- ↑ Hirst, Judy; King, Martin S.; Pryde, Kenneth R. (2008). «The production of reactive oxygen species by complex I». Biochemical Society Transactions. 36 (5): 976–80. doi:10.1042/BST0360976
- ↑ Seaver, L. C.; Imlay, JA (2004). «Are Respiratory Enzymes the Primary Sources of Intracellular Hydrogen Peroxide?». Journal of Biological Chemistry. 279 (47): 48742–50. PMID 15361522. doi:10.1074/jbc.M408754200
- ↑ a b Imlay, James A. (2003). «Pathways Ofoxidativedamage». Annual Review of Microbiology. 57: 395–418. PMID 14527285. doi:10.1146/annurev.micro.57.030502.090938
- ↑ Demmig-Adams, B.; Adams Ww, 3rd (2002). «Antioxidants in Photosynthesis and Human Nutrition». Science. 298 (5601): 2149–53. PMID 12481128. doi:10.1126/science.1078002
- ↑ Krieger-Liszkay, A. (2004). «Singlet oxygen production in photosynthesis». Journal of Experimental Botany. 56 (411): 337–46. PMID 15310815. doi:10.1093/jxb/erh237
- ↑ Szabó, Ildikó; Bergantino, Elisabetta; Giacometti, Giorgio Mario (2005). «Light and oxygenic photosynthesis: Energy dissipation as a protection mechanism against photo-oxidation». EMBO reports. 6 (7): 629–34. PMC 1369118
 . PMID 15995679. doi:10.1038/sj.embor.7400460
. PMID 15995679. doi:10.1038/sj.embor.7400460 - ↑ Kerfeld, C (2004). «Water-soluble carotenoid proteins of cyanobacteria». Archives of Biochemistry and Biophysics. 430 (1): 2–9. PMID 15325905. doi:10.1016/j.abb.2004.03.018
- ↑ Miller, RA; Britigan, BE (1997). «Role of oxidants in microbial pathophysiology». Clinical microbiology reviews. 10 (1): 1–18. PMC 172912
 . PMID 8993856
. PMID 8993856 - ↑ Chaudiere, J; Ferrari-Iliou, R (1999). «Intracellular Antioxidants: From Chemical to Biochemical Mechanisms». Food and Chemical Toxicology. 37 (9–10): 949–62. PMID 10541450. doi:10.1016/S0278-6915(99)00090-3
- ↑ Sies, Helmut (1993). «Strategies of antioxidant defense». European Journal of Biochemistry. 215 (2): 213–9. PMID 7688300. doi:10.1111/j.1432-1033.1993.tb18025.x
- ↑ Ames B, Cathcart R, Schwiers E, Hochstein P (1981). «Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis». Proc Natl Acad Sci USA. 78 (11): 6858–62. PMC 349151
 . PMID 6947260. doi:10.1073/pnas.78.11.6858
. PMID 6947260. doi:10.1073/pnas.78.11.6858 - ↑ Khaw, Kay-Tee; Woodhouse, Peter (1995). «Interrelation of vitamin C, infection, haemostatic factors, and cardiovascular disease». BMJ. 310 (6994): 1559–63. PMC 2549940
 . PMID 7787643
. PMID 7787643 - ↑ a b c d Evelson, P; Travacio, M; Repetto, M; Escobar, J; Llesuy, S; Lissi, EA (2001). «Evaluation of Total Reactive Antioxidant Potential (TRAP) of Tissue Homogenates and Their Cytosols». Archives of Biochemistry and Biophysics. 388 (2): 261–6. PMID 11368163. doi:10.1006/abbi.2001.2292
- ↑ Morrison, John A.; Jacobsen, Donald W.; Sprecher, Dennis L.; Robinson, Killian; Khoury, Philip; Daniels, Stephen R. (1999). «Serum glutathione in adolescent males predicts parental coronary heart disease». Circulation. 100 (22): 2244–7. PMID 10577998. doi:10.1161/01.CIR.100.22.2244
- ↑ Teichert, J; Preiss, R (1992). «HPLC-methods for determination of lipoic acid and its reduced form in human plasma». International journal of clinical pharmacology, therapy, and toxicology. 30 (11): 511–2. PMID 1490813
- ↑ Akiba, S; Matsugo, S; Packer, L; Konishi, T (1998). «Assay of Protein-Bound Lipoic Acid in Tissues by a New Enzymatic Method». Analytical Biochemistry. 258 (2): 299–304. PMID 9570844. doi:10.1006/abio.1998.2615
- ↑ a b Glantzounis, G. K.; Tsimoyiannis, E. C.; Kappas, A. M.; Galaris, D. A. (2005). «Uric Acid and Oxidative Stress». Current Pharmaceutical Design. 11 (32): 4145–51. PMID 16375736. doi:10.2174/138161205774913255
- ↑ El-Sohemy, Ahmed; Baylin, Ana; Kabagambe, Edmond; Ascherio, Alberto; Spiegelman, Donna; Campos, Hannia (2002). «Individual carotenoid concentrations in adipose tissue and plasma as biomarkers of dietary intake». The American journal of clinical nutrition. 76 (1): 172–9. PMID 12081831
- ↑ a b Sowell, Anne L.; Huff, Daniel L.; Yeager, Patricia R.; Caudill, Samuel P.; Gunter, Elaine W. (1994). «Retinol, alpha-tocopherol, lutein/zeaxanthin, beta-cryptoxanthin, lycopene, alpha-carotene, trans-beta-carotene, and four retinyl esters in serum determined simultaneously by reversed-phase HPLC with multiwavelength detection». Clinical chemistry. 40 (3): 411–6. PMID 8131277
- ↑ Stahl, W; Schwarz, W; Sundquist, AR; Sies, H (1992). «cis-trans isomers of lycopene and ?-carotene in human serum and tissues». Archives of Biochemistry and Biophysics. 294 (1): 173–7. PMID 1550343. doi:10.1016/0003-9861(92)90153-N
- ↑ Zita, ČEstmír; Overvad, Kim; Mortensen, Svend Aage; Sindberg, Christian Dan; Moesgaard, Sven; Hunter, Douglas A. (2003). «Serum coenzyme Q10concentrations in healthy men supplemented with 30 mg or 100 mg coenzyme Q10 for two months in a randomised controlled study». BioFactors. 18 (1–4): 185–93. PMID 14695934. doi:10.1002/biof.5520180221
- ↑ a b Turunen, Mikael; Olsson, Jerker; Dallner, Gustav (2004). «Metabolism and function of coenzyme Q». Biochimica et Biophysica Acta. 1660 (1–2): 171–99. PMID 14757233. doi:10.1016/j.bbamem.2003.11.012
- ↑ a b Enomoto, Atsushi; Endou, Hitoshi (2005). «Roles of organic anion transporters (OATs) and a urate transporter (URAT1) in the pathophysiology of human disease». Clinical and Experimental Nephrology. 9 (3): 195–205. PMID 16189627. doi:10.1007/s10157-005-0368-5
- ↑ a b Wu, X.; Lee, CC; Muzny, DM; Caskey, CT (1989). «Urate Oxidase: Primary Structure and Evolutionary Implications». Proceedings of the National Academy of Sciences. 86 (23): 9412–6. PMC 298506
 . PMID 2594778. doi:10.1073/pnas.86.23.9412
. PMID 2594778. doi:10.1073/pnas.86.23.9412 - ↑ Wu, Xiangwei; Muzny, Donna M.; Chi Lee, Cheng; Thomas Caskey, C. (1992). «Two independent mutational events in the loss of urate oxidase during hominoid evolution». Journal of Molecular Evolution. 34 (1): 78–84. PMID 1556746. doi:10.1007/BF00163854
- ↑ Alvarez-Lario, B.; Macarron-Vicente, J. (2010). «Uric acid and evolution». Rheumatology. 49 (11): 2010–5. PMID 20627967. doi:10.1093/rheumatology/keq204
- ↑ a b Watanabe, S.; Kang, DH; Feng, L; Nakagawa, T; Kanellis, J; Lan, H; Mazzali, M; Johnson, RJ (2002). «Uric Acid, Hominoid Evolution, and the Pathogenesis of Salt-Sensitivity». Hypertension. 40 (3): 355–60. PMID 12215479. doi:10.1161/01.HYP.0000028589.66335.AA
- ↑ Johnson, Richard J.; Andrews, Peter; Benner, Steven A.; Oliver, William (2010). «Theodore E. Woodward award. The evolution of obesity: Insights from the mid-Miocene». Transactions of the American Clinical and Climatological Association. 121: 295–305; discussion 305–8. PMC 2917125
 . PMID 20697570
. PMID 20697570 - ↑ a b Baillie, J. K.; Bates, M. G. D.; Thompson, A. A. R.; Waring, W. S.; Partridge, R. W.; Schnopp, M. F.; Simpson, A.; Gulliver-Sloan, F.; Maxwell, S. R. J. (2007). «Endogenous Urate Production Augments Plasma Antioxidant Capacity in Healthy Lowland Subjects Exposed to High Altitude». Chest. 131 (5): 1473–8. PMID 17494796. doi:10.1378/chest.06-2235
- ↑ a b Hooper, DC; Scott, GS; Zborek, A; Mikheeva, T; Kean, RB; Koprowski, H; Spitsin, SV (2000). «Uric acid, a peroxynitrite scavenger, inhibits CNS inflammation, blood-CNS barrier permeability changes, and tissue damage in a mouse model of multiple sclerosis». The FASEB journal. 14 (5): 691–8. PMID 10744626
- ↑ Santos, C; Anjos, EI; Augusto, O (1999). «Uric Acid Oxidation by Peroxynitrite: Multiple Reactions, Free Radical Formation, and Amplification of Lipid Oxidation». Archives of Biochemistry and Biophysics. 372 (2): 285–94. PMID 10600166. doi:10.1006/abbi.1999.1491
- ↑ Experimental Allergic Encephalomyelitis
- ↑ Scott, G. S. (2002). «Therapeutic intervention in experimental allergic encephalomyelitis by administration of uric acid precursors». Proceedings of the National Academy of Sciences. 99 (25): 16303–8. doi:10.1073/pnas.212645999
- ↑ Fuhua Peng, F; Bin Zhang, B; Xiufeng Zhong, X; Jin Li, J; Guihong Xu, G; Xueqiang Hu, X; Wei Qiu, W; Zhong Pei, Z (2007). «Serum uric acid levels of patients with multiple sclerosis and other neurological diseases». Multiple Sclerosis. 14 (2): 188–96. PMID 17942520. doi:10.1177/1352458507082143
- ↑ Massa, Jennifer; O’Reilly, E.; Munger, K. L.; Delorenze, G. N.; Ascherio, A. (2009). «Serum uric acid and risk of multiple sclerosis». Journal of Neurology. 256 (10): 1643–8. PMC 2834535
 . PMID 19468784. doi:10.1007/s00415-009-5170-y
. PMID 19468784. doi:10.1007/s00415-009-5170-y - ↑ Amorini, Angela M.; Petzold, Axel; Tavazzi, Barbara; Eikelenboom, Judith; Keir, Geoffrey; Belli, Antonio; Giovannoni, Gavin; Di Pietro, Valentina; Polman, Chris (2009). «Increase of uric acid and purine compounds in biological fluids of multiple sclerosis patients». Clinical Biochemistry. 42 (10–11): 1001–6. PMID 19341721. doi:10.1016/j.clinbiochem.2009.03.020
- ↑ Becker, B (1993). «Towards the physiological function of uric acid». Free Radical Biology and Medicine. 14 (6): 615–31. PMID 8325534. doi:10.1016/0891-5849(93)90143-I
- ↑ a b c d Sautin, Yuri; Johnson, Richard (2008). «Uric Acid: The Oxidant-Antioxidant Paradox». Nucleosides, Nucleotides and Nucleic Acids. 27 (6): 608–19. doi:10.1080/15257770802138558
- ↑ Eggebeen, Aaron T (2007). «Gout: An update». American family physician. 76 (6): 801–8. PMID 17910294
- ↑ Campion, E; Glynn, RJ; Delabry, LO (1987). «Asymptomatic hyperuricemia. Risks and consequences in the normative aging study*1». The American Journal of Medicine. 82 (3): 421–6. PMID 3826098. doi:10.1016/0002-9343(87)90441-4
- ↑ Nazarewicz, Rafal R.; Ziolkowski, Wieslaw; Vaccaro, Patrick S.; Ghafourifar, Pedram (2007). «Effect of Short-Term Ketogenic Diet on Redox Status of Human Blood». Rejuvenation Research. 10 (4): 435–40. PMID 17663642. doi:10.1089/rej.2007.0540
- ↑ a b Dimitroula, Hariklia V.; Hatzitolios, Apostolos I.; Karvounis, Haralambos I. (2008). «The Role of Uric Acid in Stroke». The Neurologist. 14 (4): 238–42. PMID 18617849. doi:10.1097/NRL.0b013e31815c666b
- ↑ a b Strazzullo, P; Puig, J (2007). «Uric acid and oxidative stress: Relative impact on cardiovascular risk». Nutrition, Metabolism and Cardiovascular Diseases. 17 (6): 409–14. doi:10.1016/j.numecd.2007.02.011
- ↑ Smirnoff, Nicholas (2001). «L-Ascorbic acid biosynthesis». Vitamins and hormones. Vitamins & Hormones. 61: 241–66. ISBN 9780127098616. PMID 11153268. doi:10.1016/S0083-6729(01)61008-2
- ↑ Linster, Carole L.; Van Schaftingen, Emile (2007). «Vitamin C». FEBS Journal. 274 (1): 1–22. PMID 17222174. doi:10.1111/j.1742-4658.2006.05607.x
- ↑ a b Meister, Alton (1994). «Glutathione-ascorbic acid antioxidant system in animals». The Journal of biological chemistry. 269 (13): 9397–400. PMID 8144521
- ↑ Wells, William W.; Xu, Dian Peng; Yang, Yanfeng; Rocque, Pamela A. (1990). «Mammalian thioltransferase (glutaredoxin) and protein disulfide isomerase have dehydroascorbate reductase activity». The Journal of biological chemistry. 265 (26): 15361–4. PMID 2394726
- ↑ Padayatty, Sebastian J.; Katz, Arie; Wang, Yaohui; Eck, Peter; Kwon, Oran; Lee, Je-Hyuk; Chen, Shenglin; Corpe, Christopher; Dutta, Anand (2003). «Vitamin C as an antioxidant: evaluation of its role in disease prevention». Journal of the American College of Nutrition. 22 (1): 18–35. PMID 12569111
- ↑ Shigeoka, S.; Ishikawa, T; Tamoi, M; Miyagawa, Y; Takeda, T; Yabuta, Y; Yoshimura, K (2002). «Regulation and function of ascorbate peroxidase isoenzymes». Journal of Experimental Botany. 53 (372): 1305–19. PMID 11997377. doi:10.1093/jexbot/53.372.1305
- ↑ Smirnoff, Nicholas; Wheeler, Glen L. (2000). «Ascorbic Acid in Plants: Biosynthesis and Function». Critical Reviews in Biochemistry and Molecular Biology. 35 (4): 291–314. PMID 11005203. doi:10.1080/10409230008984166
- ↑ a b c d Meister, A; Anderson, M E (1983). «Glutathione». Annual Review of Biochemistry. 52: 711–60. PMID 6137189. doi:10.1146/annurev.bi.52.070183.003431
- ↑ Meister, Alton (1988). «Glutathione metabolism and its selective modification». The Journal of biological chemistry. 263 (33): 17205–8. PMID 3053703
- ↑ Gaballa A (2010). «Biosynthesis and functions of bacillithiol, a major low-molecular-weight thiol in Bacilli». Proc. Natl. Acad. Sci. U.S.A. 107 (14): 6482–6. PMC 2851989
 . PMID 20308541. doi:10.1073/pnas.1000928107
. PMID 20308541. doi:10.1073/pnas.1000928107 - ↑ Gerald L Newton; Mamta Rawat; James J La Clair; Vishnu Karthik Jothivasan; Tanya Budiarto; Chris J Hamilton; Al Claiborne; John D Helmann; Robert C Fahey (setembro de 2009). «Bacillithiol is an antioxidant thiol produced in Bacilli». Nature chemical biology. 5 (9): 625–627. ISSN 1552-4450. PMID 19578333. doi:10.1038/nchembio.189
- ↑ Fahey, Robert C. (2001). «Novelthiols Ofprokaryotes». Annual Review of Microbiology. 55: 333–56. PMID 11544359. doi:10.1146/annurev.micro.55.1.333
- ↑ Fairlamb, A H; Cerami, A (1992). «Metabolism and Functions of Trypanothione in the Kinetoplastida». Annual Review of Microbiology. 46: 695–729. PMID 1444271. doi:10.1146/annurev.mi.46.100192.003403
- ↑ Tan, Dun-Xian; Manchester, Lucien C.; Terron, Maria P.; Flores, Luis J.; Reiter, Russel J. (2007). «One molecule, many derivatives: A never-ending interaction of melatonin with reactive oxygen and nitrogen species?». Journal of Pineal Research. 42 (1): 28–42. PMID 17198536. doi:10.1111/j.1600-079X.2006.00407.x
- ↑ Reiter, Russel J.; Paredes, Sergio D.; Manchester, Lucien C.; Tan, Dan-Xian (2009). «Reducing oxidative/nitrosative stress: A newly-discovered genre for melatonin». Critical Reviews in Biochemistry and Molecular Biology. 44 (4): 175–200. PMID 19635037. doi:10.1080/10409230903044914
- ↑ Tan, Dun-Xian; Manchester, Lucien C.; Reiter, Russel J.; Qi, Wen-Bo; Karbownik, Malgorzata; Calvo, Juan R. (2000). «Significance of Melatonin in Antioxidative Defense System: Reactions and Products». Neurosignals. 9 (3–4): 137–59. PMID 10899700. doi:10.1159/000014635
- ↑ a b Herrera, E.; Barbas, C. (2001). «Vitamin E: Action, metabolism and perspectives». Journal of Physiology and Biochemistry. 57 (2): 43–56. PMID 11579997. doi:10.1007/BF03179812
- ↑ Packer, Lester; Weber, Stefan U.; Rimbach, Gerald (2001). «Molecular aspects of alpha-tocotrienol antioxidant action and cell signalling». The Journal of nutrition. 131 (2): 369S–73S. PMID 11160563
- ↑ a b Brigelius-Flohé, Regina; Traber, Maret G. (1999). «Vitamin E: Function and metabolism». The FASEB journal. 13 (10): 1145–55. PMID 10385606
- ↑ Traber, Maret G.; Atkinson, Jeffrey (2007). «Vitamin E, antioxidant and nothing more». Free Radical Biology and Medicine. 43 (1): 4–15. PMC 2040110
 . PMID 17561088. doi:10.1016/j.freeradbiomed.2007.03.024
. PMID 17561088. doi:10.1016/j.freeradbiomed.2007.03.024 - ↑ Wang, Xiaoyuan; Quinn, Peter J. (1999). «Vitamin E and its function in membranes». Progress in Lipid Research. 38 (4): 309–36. PMID 10793887. doi:10.1016/S0163-7827(99)00008-9
- ↑ Seiler, Alexander; Schneider, Manuela; Förster, Heidi; Roth, Stephan; Wirth, Eva K.; Culmsee, Carsten; Plesnila, Nikolaus; Kremmer, Elisabeth; Rådmark, Olof (2008). «Glutathione Peroxidase 4 Senses and Translates Oxidative Stress into 12/15-Lipoxygenase Dependent- and AIF-Mediated Cell Death». Cell Metabolism. 8 (3): 237–48. PMID 18762024. doi:10.1016/j.cmet.2008.07.005
- ↑ Brigelius-Flohé, Regina; Davies, Kelvin J.A. (2007). «Is vitamin E an antioxidant, a regulator of signal transduction and gene expression, or a 'junk' food? Comments on the two accompanying papers: 'Molecular mechanism of α-tocopherol action' by A. Azzi and 'Vitamin E, antioxidant and nothing more' by M. Traber and J. Atkinson». Free Radical Biology and Medicine. 43 (1): 2–3. PMID 17561087. doi:10.1016/j.freeradbiomed.2007.05.016
- ↑ Atkinson, Jeffrey; Epand, Raquel F.; Epand, Richard M. (2008). «Tocopherols and tocotrienols in membranes: A critical review». Free Radical Biology and Medicine. 44 (5): 739–64. PMID 18160049. doi:10.1016/j.freeradbiomed.2007.11.010
- ↑ a b Azzi, Angelo (2007). «Molecular mechanism of α-tocopherol action». Free Radical Biology and Medicine. 43 (1): 16–21. PMID 17561089. doi:10.1016/j.freeradbiomed.2007.03.013
- ↑ Zingg, Jean-Marc; Azzi, Angelo (2004). «Non-antioxidant activities of vitamin E». Current medicinal chemistry. 11 (9): 1113–33. PMID 15134510. Consultado em 1 de junho de 2019. Arquivado do original em 6 de outubro de 2011
- ↑ Sen, Chandan K.; Khanna, Savita; Roy, Sashwati (2006). «Tocotrienols: Vitamin E beyond tocopherols». Life Sciences. 78 (18): 2088–98. PMC 1790869
 . PMID 16458936. doi:10.1016/j.lfs.2005.12.001
. PMID 16458936. doi:10.1016/j.lfs.2005.12.001 - ↑ Duarte TL, Lunec J (2005). «Review: When is an antioxidant not an antioxidant? A review of novel actions and reactions of vitamin C». Free Radic. Res. 39 (7): 671–86. PMID 16036346. doi:10.1080/10715760500104025
- ↑ a b Carr A, Frei B (1999). «Does vitamin C act as a pro-oxidant under physiological conditions?». FASEB J. 13 (9): 1007–24. PMID 10336883
- ↑ Stohs SJ, Bagchi D (1995). «Oxidative mechanisms in the toxicity of metal ions». Free Radic. Biol. Med. 18 (2): 321–36. PMID 7744317. doi:10.1016/0891-5849(94)00159-H
- ↑ Valko M, Morris H, Cronin MT (2005). «Metals, toxicity and oxidative stress». Curr. Med. Chem. 12 (10): 1161–208. PMID 15892631. doi:10.2174/0929867053764635
- ↑ Schneider C (2005). «Chemistry and biology of vitamin E». Mol Nutr Food Res. 49 (1): 7–30. PMID 15580660. doi:10.1002/mnfr.200400049
- ↑ Halliwell, B (2008). «Are polyphenols antioxidants or pro-oxidants? What do we learn from cell culture and in vivo studies?». Archives of Biochemistry and Biophysics. 476 (2): 107–112. PMID 18284912. doi:10.1016/j.abb.2008.01.028
- ↑ a b c Ristow, M. .; Zarse, K. . (2010). «How increased oxidative stress promotes longevity and metabolic health: the concept of mitochondrial hormesis (mitohormesis)». Experimental gerontology. 45 (6): 410–418. PMID 20350594. doi:10.1016/j.exger.2010.03.014
- ↑ a b c d Bjelakovic G, Nikolova D, Gluud L, Simonetti R, Gluud C (2007). «Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention: Systematic Review and Meta-analysis». JAMA. 297 (8): 842–57. PMID 17327526. doi:10.1001/jama.297.8.842
- ↑ Tapia, P (2006). «Sublethal mitochondrial stress with an attendant stoichiometric augmentation of reactive oxygen species may precipitate many of the beneficial alterations in cellular physiology produced by caloric restriction, intermittent fasting, exercise and dietary phytonutrients: "Mitohormesis" for health and vitality». Medical Hypotheses. 66 (4): 832–43. PMID 16242247. doi:10.1016/j.mehy.2005.09.009
- ↑ Schulz TJ, Zarse K, Voigt A, Urban N, Birringer M, Ristow M (2007). «Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress». Cell Metab. 6 (4): 280–93. PMID 17908557. doi:10.1016/j.cmet.2007.08.011
- ↑ a b Ho YS, Magnenat JL, Gargano M, Cao J (1998). «The nature of antioxidant defense mechanisms: a lesson from transgenic studies». Environ. Health Perspect. 106 (Suppl 5): 1219–28. JSTOR 3433989. PMC 1533365
 . PMID 9788901. doi:10.2307/3433989
. PMID 9788901. doi:10.2307/3433989 - ↑ Zelko I, Mariani T, Folz R (2002). «Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression». Free Radic Biol Med. 33 (3): 337–49. PMID 12126755. doi:10.1016/S0891-5849(02)00905-X
- ↑ a b Bannister J, Bannister W, Rotilio G (1987). «Aspects of the structure, function, and applications of superoxide dismutase». CRC Crit Rev Biochem. 22 (2): 111–80. PMID 3315461. doi:10.3109/10409238709083738
- ↑ Johnson F, Giulivi C (2005). «Superoxide dismutases and their impact upon human health». Mol Aspects Med. 26 (4–5): 340–52. PMID 16099495. doi:10.1016/j.mam.2005.07.006
- ↑ Nozik-Grayck E, Suliman H, Piantadosi C (2005). «Extracellular superoxide dismutase». Int J Biochem Cell Biol. 37 (12): 2466–71. PMID 16087389. doi:10.1016/j.biocel.2005.06.012
- ↑ Melov S, Schneider J, Day B, Hinerfeld D, Coskun P, Mirra S, Crapo J, Wallace D (1998). «A novel neurological phenotype in mice lacking mitochondrial manganese superoxide dismutase». Nat Genet. 18 (2): 159–63. PMID 9462746. doi:10.1038/ng0298-159
- ↑ Reaume A, Elliott J, Hoffman E, Kowall N, Ferrante R, Siwek D, Wilcox H, Flood D, Beal M, Brown R, Scott R, Snider W (1996). «Motor neurons in Cu/Zn superoxide dismutase-deficient mice develop normally but exhibit enhanced cell death after axonal injury». Nat Genet. 13 (1): 43–7. PMID 8673102. doi:10.1038/ng0596-43
- ↑ Van Camp W, Inzé D, Van Montagu M (1997). «The regulation and function of tobacco superoxide dismutases». Free Radic Biol Med. 23 (3): 515–20. PMID 9214590. doi:10.1016/S0891-5849(97)00112-3
- ↑ Chelikani P, Fita I, Loewen P (2004). «Diversity of structures and properties among catalases». Cell Mol Life Sci. 61 (2): 192–208. PMID 14745498. doi:10.1007/s00018-003-3206-5
- ↑ Zámocký M, Koller F (1999). «Understanding the structure and function of catalases: clues from molecular evolution and in vitro mutagenesis». Prog Biophys Mol Biol. 72 (1): 19–66. PMID 10446501. doi:10.1016/S0079-6107(98)00058-3
- ↑ del Río L, Sandalio L, Palma J, Bueno P, Corpas F (1992). «Metabolism of oxygen radicals in peroxisomes and cellular implications». Free Radic Biol Med. 13 (5): 557–80. PMID 1334030. doi:10.1016/0891-5849(92)90150-F
- ↑ Hiner A, Raven E, Thorneley R, García-Cánovas F, Rodríguez-López J (2002). «Mechanisms of compound I formation in heme peroxidases». J Inorg Biochem. 91 (1): 27–34. PMID 12121759. doi:10.1016/S0162-0134(02)00390-2
- ↑ Mueller S, Riedel H, Stremmel W (1997). «Direct evidence for catalase as the predominant H2O2 -removing enzyme in human erythrocytes». Blood. 90 (12): 4973–8. PMID 9389716
- ↑ Ogata M (1991). «Acatalasemia». Hum Genet. 86 (4): 331–40. PMID 1999334. doi:10.1007/BF00201829
- ↑ Parsonage D, Youngblood D, Sarma G, Wood Z, Karplus P, Poole L (2005). «Analysis of the link between enzymatic activity and oligomeric state in AhpC, a bacterial peroxiredoxin». Biochemistry. 44 (31): 10583–92. PMID 16060667. doi:10.1021/bi050448i PDB 1YEX
- ↑ Rhee S, Chae H, Kim K (2005). «Peroxiredoxins: a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling». Free Radic Biol Med. 38 (12): 1543–52. PMID 15917183. doi:10.1016/j.freeradbiomed.2005.02.026
- ↑ Wood Z, Schröder E, Robin Harris J, Poole L (2003). «Structure, mechanism and regulation of peroxiredoxins». Trends Biochem Sci. 28 (1): 32–40. PMID 12517450. doi:10.1016/S0968-0004(02)00003-8
- ↑ Claiborne A, Yeh J, Mallett T, Luba J, Crane E, Charrier V, Parsonage D (1999). «Protein-sulfenic acids: diverse roles for an unlikely player in enzyme catalysis and redox regulation». Biochemistry. 38 (47): 15407–16. PMID 10569923. doi:10.1021/bi992025k
- ↑ Jönsson TJ, Lowther WT (2007). «The peroxiredoxin repair proteins». Sub-cellular biochemistry. Subcellular Biochemistry. 44: 115–41. ISBN 978-1-4020-6050-2. PMC 2391273
 . PMID 18084892. doi:10.1007/978-1-4020-6051-9_6
. PMID 18084892. doi:10.1007/978-1-4020-6051-9_6 - ↑ Neumann C, Krause D, Carman C, Das S, Dubey D, Abraham J, Bronson R, Fujiwara Y, Orkin S, Van Etten R (2003). «Essential role for the peroxiredoxin Prdx1 in erythrocyte antioxidant defence and tumour suppression». Nature. 424 (6948): 561–5. PMID 12891360. doi:10.1038/nature01819
- ↑ Lee T, Kim S, Yu S, Kim S, Park D, Moon H, Dho S, Kwon K, Kwon H, Han Y, Jeong S, Kang S, Shin H, Lee K, Rhee S, Yu D (2003). «Peroxiredoxin II is essential for sustaining life span of erythrocytes in mice». Blood. 101 (12): 5033–8. PMID 12586629. doi:10.1182/blood-2002-08-2548
- ↑ Dietz K, Jacob S, Oelze M, Laxa M, Tognetti V, de Miranda S, Baier M, Finkemeier I (2006). «The function of peroxiredoxins in plant organelle redox metabolism». J Exp Bot. 57 (8): 1697–709. PMID 16606633. doi:10.1093/jxb/erj160
- ↑ Nordberg J, Arner ES (2001). «Reactive oxygen species, antioxidants, and the mammalian thioredoxin system». Free Radic Biol Med. 31 (11): 1287–312. PMID 11728801. doi:10.1016/S0891-5849(01)00724-9
- ↑ Vieira Dos Santos C, Rey P (2006). «Plant thioredoxins are key actors in the oxidative stress response». Trends Plant Sci. 11 (7): 329–34. PMID 16782394. doi:10.1016/j.tplants.2006.05.005
- ↑ Arnér E, Holmgren A (2000). «Physiological functions of thioredoxin and thioredoxin reductase». Eur J Biochem. 267 (20): 6102–9. PMID 11012661. doi:10.1046/j.1432-1327.2000.01701.x. Consultado em 18 de janeiro de 2012. Arquivado do original em 22 de dezembro de 2007
- ↑ Mustacich D, Powis G (2000). «Thioredoxin reductase». Biochem J. 346 (Pt 1): 1–8. PMC 1220815
 . PMID 10657232. doi:10.1042/0264-6021:3460001
. PMID 10657232. doi:10.1042/0264-6021:3460001 - ↑ Creissen G, Broadbent P, Stevens R, Wellburn A, Mullineaux P (1996). «Manipulation of glutathione metabolism in transgenic plants». Biochem Soc Trans. 24 (2): 465–9. PMID 8736785
- ↑ Brigelius-Flohé R (1999). «Tissue-specific functions of individual glutathione peroxidases». Free Radic Biol Med. 27 (9–10): 951–65. PMID 10569628. doi:10.1016/S0891-5849(99)00173-2
- ↑ Ho Y, Magnenat J, Bronson R, Cao J, Gargano M, Sugawara M, Funk C (1997). «Mice deficient in cellular glutathione peroxidase develop normally and show no increased sensitivity to hyperoxia». J Biol Chem. 272 (26): 16644–51. PMID 9195979. doi:10.1074/jbc.272.26.16644
- ↑ de Haan J, Bladier C, Griffiths P, Kelner M, O'Shea R, Cheung N, Bronson R, Silvestro M, Wild S, Zheng S, Beart P, Hertzog P, Kola I (1998). «Mice with a homozygous null mutation for the most abundant glutathione peroxidase, Gpx1, show increased susceptibility to the oxidative stress-inducing agents paraquat and hydrogen peroxide». J Biol Chem. 273 (35): 22528–36. PMID 9712879. doi:10.1074/jbc.273.35.22528
- ↑ Sharma R, Yang Y, Sharma A, Awasthi S, Awasthi Y (2004). «Antioxidant role of glutathione S-transferases: protection against oxidant toxicity and regulation of stress-mediated apoptosis». Antioxid Redox Signal. 6 (2): 289–300. PMID 15025930. doi:10.1089/152308604322899350
- ↑ Hayes J, Flanagan J, Jowsey I (2005). «Glutathione transferases». Annu Rev Pharmacol Toxicol. 45: 51–88. PMID 15822171. doi:10.1146/annurev.pharmtox.45.120403.095857
- ↑ Christen Y (2000). «Oxidative stress and Alzheimer disease». Am J Clin Nutr. 71 (2): 621S–629S. PMID 10681270
- ↑ Nunomura A, Castellani R, Zhu X, Moreira P, Perry G, Smith M (2006). «Involvement of oxidative stress in Alzheimer disease». J Neuropathol Exp Neurol. 65 (7): 631–41. PMID 16825950. doi:10.1097/01.jnen.0000228136.58062.bf
- ↑ Cookson M, Shaw P (1999). «Oxidative stress and motor neurone disease». Brain Pathol. 9 (1): 165–86. PMID 9989458. doi:10.1111/j.1750-3639.1999.tb00217.x
- ↑ Wood-Kaczmar A, Gandhi S, Wood N (2006). «Understanding the molecular causes of Parkinson's disease». Trends Mol Med. 12 (11): 521–8. PMID 17027339. doi:10.1016/j.molmed.2006.09.007
- ↑ Davì G, Falco A, Patrono C (2005). «Lipid peroxidation in diabetes mellitus». Antioxid Redox Signal. 7 (1–2): 256–68. PMID 15650413. doi:10.1089/ars.2005.7.256
- ↑ Giugliano D, Ceriello A, Paolisso G (1996). «Oxidative stress and diabetic vascular complications». Diabetes Care. 19 (3): 257–67. PMID 8742574. doi:10.2337/diacare.19.3.257
- ↑ Hitchon C, El-Gabalawy H (2004). «Oxidation in rheumatoid arthritis». Arthritis Res Ther. 6 (6): 265–78. PMC 1064874
 . PMID 15535839. doi:10.1186/ar1447
. PMID 15535839. doi:10.1186/ar1447 - ↑ Van Gaal L, Mertens I, De Block C (2006). «Mechanisms linking obesity with cardiovascular disease». Nature. 444 (7121): 875–80. PMID 17167476. doi:10.1038/nature05487
- ↑ Aviram M (2000). «Review of human studies on oxidative damage and antioxidant protection related to cardiovascular diseases». Free Radic Res. 33 Suppl: S85–97. PMID 11191279
- ↑ Khan MA, Tania M, Zhang D, Chen H (2010). «Antioxidant enzymes and cancer». Chin J Cancer Res. 22 (2): 87–92. doi:10.1007/s11670-010-0087-7
- ↑ G. López-Lluch, N. Hunt, B. Jones, M. Zhu, H. Jamieson, S. Hilmer, M. V. Cascajo, J. Allard, D. K. Ingram, P. Navas, and R. de Cabo (2006). «Calorie restriction induces mitochondrial biogenesis and bioenergetic efficiency». Proc Natl Acad Sci USA. 103 (6): 1768–1773. PMC 1413655
 . PMID 16446459. doi:10.1073/pnas.0510452103
. PMID 16446459. doi:10.1073/pnas.0510452103 - ↑ Larsen P (1993). «Aging and resistance to oxidative damage in Caenorhabditis elegans». Proc Natl Acad Sci USA. 90 (19): 8905–9. PMC 47469
 . PMID 8415630. doi:10.1073/pnas.90.19.8905
. PMID 8415630. doi:10.1073/pnas.90.19.8905 - ↑ Helfand S, Rogina B (2003). «Genetics of aging in the fruit fly, Drosophila melanogaster». Annu Rev Genet. 37: 329–48. PMID 14616064. doi:10.1146/annurev.genet.37.040103.095211
- ↑ a b Sohal R, Mockett R, Orr W (2002). «Mechanisms of aging: an appraisal of the oxidative stress hypothesis». Free Radic Biol Med. 33 (5): 575–86. PMID 12208343. doi:10.1016/S0891-5849(02)00886-9
- ↑ a b Sohal R (2002). «Role of oxidative stress and protein oxidation in the aging process». Free Radic Biol Med. 33 (1): 37–44. PMID 12086680. doi:10.1016/S0891-5849(02)00856-0
- ↑ a b Rattan S (2006). «Theories of biological aging: genes, proteins, and free radicals». Free Radic Res. 40 (12): 1230–8. PMID 17090411. doi:10.1080/10715760600911303
- ↑ Pérez, Viviana I.; Bokov, A; Van Remmen, H; Mele, J; Ran, Q; Ikeno, Y; Richardson, A (2009). «Is the oxidative stress theory of aging dead?». Biochimica et Biophysica Acta (BBA) – General Subjects. 1790 (10): 1005–1014. PMC 2789432
 . PMID 19524016. doi:10.1016/j.bbagen.2009.06.003. Consultado em 14 de setembro de 2009
. PMID 19524016. doi:10.1016/j.bbagen.2009.06.003. Consultado em 14 de setembro de 2009 - ↑ Thomas D (2004). «Vitamins in health and aging». Clin Geriatr Med. 20 (2): 259–74. PMID 15182881. doi:10.1016/j.cger.2004.02.001
- ↑ Ward J (1998). «Should antioxidant vitamins be routinely recommended for older people?». Drugs Aging. 12 (3): 169–75. PMID 9534018. doi:10.2165/00002512-199812030-00001
- ↑ Aggarwal BB, Shishodia S (2006). «Molecular targets of dietary agents for prevention and therapy of cancer». Biochem. Pharmacol. 71 (10): 1397–421. PMID 16563357. doi:10.1016/j.bcp.2006.02.009
- ↑ O'Brien (1965). «Lipid composition of the normal human brain: gray matter, white matter and myelin». J. Lipid Research. 6: 537-544. PMID 5865382
- ↑ Reiter R (1995). «Oxidative processes and antioxidative defense mechanisms in the aging brain» (PDF). FASEB J. 9 (7): 526–33. PMID 7737461
- ↑ Warner D, Sheng H, Batinić-Haberle I (2004). «Oxidants, antioxidants and the ischemic brain». J Exp Biol. 207 (Pt 18): 3221–31. PMID 15299043. doi:10.1242/jeb.01022
- ↑ Wilson J, Gelb A (2002). «Free radicals, antioxidants, and neurologic injury: possible relationship to cerebral protection by anesthetics». J Neurosurg Anesthesiol. 14 (1): 66–79. PMID 11773828. doi:10.1097/00008506-200201000-00014
- ↑ Yamaguchi T, Sano K, Takakura K, Saito I, Shinohara Y, Asano T, Yasuhara H (1998). «Ebselen in acute ischemic stroke: a placebo-controlled, double-blind clinical trial. Ebselen Study Group». Stroke. 29 (1): 12–7. PMID 9445321. doi:10.1161/01.STR.29.1.12
- ↑ Lees K, Davalos A, Davis S, Diener H, Grotta J, Lyden P, Shuaib A, Ashwood T, Hardemark H, Wasiewski W, Emeribe U, Zivin J (2006). «Additional outcomes and subgroup analyses of NXY-059 for acute ischemic stroke in the SAINT I trial». Stroke. 37 (12): 2970–8. PMID 17068304. doi:10.1161/01.STR.0000249410.91473.44
- ↑ Di Matteo V, Esposito E (2003). «Biochemical and therapeutic effects of antioxidants in the treatment of Alzheimer's disease, Parkinson's disease, and amyotrophic lateral sclerosis». Curr Drug Targets CNS Neurol Disord. 2 (2): 95–107. PMID 12769802. doi:10.2174/1568007033482959
- ↑ Rao A, Balachandran B (2002). «Role of oxidative stress and antioxidants in neurodegenerative diseases». Nutr Neurosci. 5 (5): 291–309. PMID 12385592. doi:10.1080/1028415021000033767
- ↑ Kopke RD, Jackson RL, Coleman JK, Liu J, Bielefeld EC, Balough BJ (2007). «NAC for noise: from the bench top to the clinic». Hear. Res. 226 (1–2): 114–25. PMID 17184943. doi:10.1016/j.heares.2006.10.008
- ↑ «Antioxidant may prevent alcohol-induced liver disease». e! Science News. 2 de maio de 2011. Consultado em 9 de outubro de 2011
- ↑ a b c d Stanner SA, Hughes J, Kelly CN, Buttriss J (2004). «A review of the epidemiological evidence for the 'antioxidant hypothesis'». Public Health Nutr. 7 (3): 407–22. PMID 15153272. doi:10.1079/PHN2003543
- ↑ Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective. World Cancer Research Fund (2007). ISBN 978-0-9722522-2-5.
- ↑ a b c Shenkin A (2006). «The key role of micronutrients». Clin Nutr. 25 (1): 1–13. PMID 16376462. doi:10.1016/j.clnu.2005.11.006
- ↑ Cherubini A, Vigna G, Zuliani G, Ruggiero C, Senin U, Fellin R (2005). «Role of antioxidants in atherosclerosis: epidemiological and clinical update». Curr Pharm Des. 11 (16): 2017–32. PMID 15974956. doi:10.2174/1381612054065783
- ↑ Lotito SB, Frei B (2006). «Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: cause, consequence, or epiphenomenon?». Free Radic. Biol. Med. 41 (12): 1727–46. PMID 17157175. doi:10.1016/j.freeradbiomed.2006.04.033
- ↑ Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA, Willett WC (1993). «Vitamin E consumption and the risk of coronary heart disease in men». N Engl J Med. 328 (20): 1450–6. PMID 8479464. doi:10.1056/NEJM199305203282004
- ↑ Vivekananthan DP, Penn MS, Sapp SK, Hsu A, Topol EJ (2003). «Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials». Lancet. 361 (9374): 2017–23. PMID 12814711. doi:10.1016/S0140-6736(03)13637-9
- ↑ Sesso HD, Buring JE, Christen WG (2008). «Vitamins E and C in the prevention of cardiovascular disease in men: the Physicians' Health Study II randomized controlled trial». JAMA. 300 (18): 2123–33. PMC 2586922
 . PMID 18997197. doi:10.1001/jama.2008.600
. PMID 18997197. doi:10.1001/jama.2008.600 - ↑ Lee IM, Cook NR, Gaziano JM (2005). «Vitamin E in the primary prevention of cardiovascular disease and cancer: the Women's Health Study: a randomized controlled trial». JAMA. 294 (1): 56–65. PMID 15998891. doi:10.1001/jama.294.1.56
- ↑ Roberts LJ, Oates JA, Linton MF (2007). «The relationship between dose of vitamin E and suppression of oxidative stress in humans». Free Radic. Biol. Med. 43 (10): 1388–93. PMC 2072864
 . PMID 17936185. doi:10.1016/j.freeradbiomed.2007.06.019
. PMID 17936185. doi:10.1016/j.freeradbiomed.2007.06.019 - ↑ Bleys J, Miller E, Pastor-Barriuso R, Appel L, Guallar E (2006). «Vitamin-mineral supplementation and the progression of atherosclerosis: a meta-analysis of randomized controlled trials». Am. J. Clin. Nutr. 84 (4): 880–7; quiz 954–5. PMID 17023716
- ↑ Cook NR, Albert CM, Gaziano JM (2007). «A randomized factorial trial of vitamins C and E and beta carotene in the secondary prevention of cardiovascular events in women: results from the Women's Antioxidant Cardiovascular Study». Arch. Intern. Med. 167 (15): 1610–8. PMC 2034519
 . PMID 17698683. doi:10.1001/archinte.167.15.1610
. PMID 17698683. doi:10.1001/archinte.167.15.1610 - ↑ a b c Hercberg S, Galan P, Preziosi P, Bertrais S, Mennen L, Malvy D, Roussel AM, Favier A, Briancon S (2004). «The SU.VI.MAX Study: a randomized, placebo-controlled trial of the health effects of antioxidant vitamins and minerals». Arch Intern Med. 164 (21): 2335–42. PMID 15557412. doi:10.1001/archinte.164.21.2335
- ↑ Radimer K, Bindewald B, Hughes J, Ervin B, Swanson C, Picciano M (2004). «Dietary supplement use by US adults: data from the National Health and Nutrition Examination Survey, 1999–2000». Am J Epidemiol. 160 (4): 339–49. PMID 15286019. doi:10.1093/aje/kwh207
- ↑ Latruffe N, Delmas D, Jannin B, Cherkaoui Malki M, Passilly-Degrace P, Berlot JP (2002). «Molecular analysis on the chemopreventive properties of resveratrol, a plant polyphenol microcomponent». Int. J. Mol. Med. 10 (6): 755–60. PMID 12430003
- ↑ Woodside J, McCall D, McGartland C, Young I (2005). «Micronutrients: dietary intake v. supplement use». Proc Nutr Soc. 64 (4): 543–53. PMID 16313697. doi:10.1079/PNS2005464
- ↑ a b c Hail N, Cortes M, Drake EN, Spallholz JE (2008). «Cancer chemoprevention: a radical perspective». Free Radic. Biol. Med. 45 (2): 97–110. PMID 18454943. doi:10.1016/j.freeradbiomed.2008.04.004
- ↑ Williams RJ, Spencer JP, Rice-Evans C (2004). «Flavonoids: antioxidants or signalling molecules?». Free Radical Biology & Medicine. 36 (7): 838–49. PMID 15019969. doi:10.1016/j.freeradbiomed.2004.01.001
- ↑ Virgili F, Marino M (2008). «Regulation of cellular signals from nutritional molecules: a specific role for phytochemicals, beyond antioxidant activity». Free Radical Biology & Medicine. 45 (9): 1205–16. PMID 18762244. doi:10.1016/j.freeradbiomed.2008.08.001
- ↑ Schulz TJ, Zarse K, Voigt A, Urban N, Birringer M, Ristow M (2007). «Glucose Restriction Extends Caenorhabditis elegans Life Span by Inducing Mitochondrial Respiration and Increasing Oxidative Stress». Cell Metab. 6 (4): 280–93. PMID 17908557. doi:10.1016/j.cmet.2007.08.011
- ↑ Barros MH, Bandy B, Tahara EB, Kowaltowski AJ (2004). «Higher respiratory activity decreases mitochondrial reactive oxygen release and increases life span in Saccharomyces cerevisiae». J. Biol. Chem. 279 (48): 49883–8. PMID 15383542. doi:10.1074/jbc.M408918200
- ↑ Green GA (2008). «Review: antioxidant supplements do not reduce all-cause mortality in primary or secondary prevention». Evid Based Med. 13 (6): 177. PMID 19043035. doi:10.1136/ebm.13.6.177
- ↑ Dekkers J, van Doornen L, Kemper H (1996). «The role of antioxidant vitamins and enzymes in the prevention of exercise-induced muscle damage». Sports Med. 21 (3): 213–38. PMID 8776010. doi:10.2165/00007256-199621030-00005
- ↑ Tiidus P (1998). «Radical species in inflammation and overtraining». Can J Physiol Pharmacol. 76 (5): 533–8. PMID 9839079. doi:10.1139/cjpp-76-5-533[ligação inativa]
- ↑ Ristow M, Zarse K, Oberbach A (2009). «Antioxidants prevent health-promoting effects of physical exercise in humans». Proc. Natl. Acad. Sci. U.S.A. 106 (21): 8665–70. PMC 2680430
 . PMID 19433800. doi:10.1073/pnas.0903485106
. PMID 19433800. doi:10.1073/pnas.0903485106 - ↑ Leeuwenburgh C, Fiebig R, Chandwaney R, Ji L (1994). «Aging and exercise training in skeletal muscle: responses of glutathione and antioxidant enzyme systems». Am J Physiol. 267 (2 Pt 2): R439–45. PMID 8067452
- ↑ Leeuwenburgh C, Heinecke J (2001). «Oxidative stress and antioxidants in exercise». Curr Med Chem. 8 (7): 829–38. PMID 11375753
- ↑ Takanami Y, Iwane H, Kawai Y, Shimomitsu T (2000). «Vitamin E supplementation and endurance exercise: are there benefits?». Sports Med. 29 (2): 73–83. PMID 10701711. doi:10.2165/00007256-200029020-00001
- ↑ Mastaloudis A, Traber M, Carstensen K, Widrick J (2006). «Antioxidants did not prevent muscle damage in response to an ultramarathon run». Med Sci Sports Exerc. 38 (1): 72–80. PMID 16394956. doi:10.1249/01.mss.0000188579.36272.f6
- ↑ Peake J (2003). «Vitamin C: effects of exercise and requirements with training». Int J Sport Nutr Exerc Metab. 13 (2): 125–51. PMID 12945825
- ↑ Jakeman P, Maxwell S (1993). «Effect of antioxidant vitamin supplementation on muscle function after eccentric exercise». Eur J Appl Physiol Occup Physiol. 67 (5): 426–30. PMID 8299614. doi:10.1007/BF00376459
- ↑ Close G, Ashton T, Cable T, Doran D, Holloway C, McArdle F, MacLaren D (2006). «Ascorbic acid supplementation does not attenuate post-exercise muscle soreness following muscle-damaging exercise but may delay the recovery process». Br J Nutr. 95 (5): 976–81. PMID 16611389. doi:10.1079/BJN20061732
- ↑ Gavura, Scott. «Antioxidants and Exercise: More Harm Than Good?». Science Based Medicine. Consultado em 19 de Dezembro de 2011
- ↑ Hurrell R (2003). «Influence of vegetable protein sources on trace element and mineral bioavailability». J Nutr. 133 (9): 2973S–7S. PMID 12949395
- ↑ Hunt J (2003). «Bioavailability of iron, zinc, and other trace minerals from vegetarian diets». Am J Clin Nutr. 78 (3 Suppl): 633S–639S. PMID 12936958
- ↑ Gibson R, Perlas L, Hotz C (2006). «Improving the bioavailability of nutrients in plant foods at the household level». Proc Nutr Soc. 65 (2): 160–8. PMID 16672077. doi:10.1079/PNS2006489
- ↑ a b Mosha T, Gaga H, Pace R, Laswai H, Mtebe K (1995). «Effect of blanching on the content of antinutritional factors in selected vegetables». Plant Foods Hum Nutr. 47 (4): 361–7. PMID 8577655. doi:10.1007/BF01088275
- ↑ Sandberg A (2002). «Bioavailability of minerals in legumes». Br J Nutr. 88 (Suppl 3): S281–5. PMID 12498628. doi:10.1079/BJN/2002718
- ↑ a b Beecher G (2003). «Overview of dietary flavonoids: nomenclature, occurrence and intake». J Nutr. 133 (10): 3248S–3254S. PMID 14519822
- ↑ Prashar A, Locke I, Evans C (2006). «Cytotoxicity of clove (Syzygium aromaticum) oil and its major components to human skin cells». Cell Prolif. 39 (4): 241–8. PMID 16872360. doi:10.1111/j.1365-2184.2006.00384.x
- ↑ Hornig D, Vuilleumier J, Hartmann D (1980). «Absorption of large, single, oral intakes of ascorbic acid». Int J Vitam Nutr Res. 50 (3): 309–14. PMID 7429760
- ↑ Omenn G, Goodman G, Thornquist M, Balmes J, Cullen M, Glass A, Keogh J, Meyskens F, Valanis B, Williams J, Barnhart S, Cherniack M, Brodkin C, Hammar S (1996). «Risk factors for lung cancer and for intervention effects in CARET, the Beta-Carotene and Retinol Efficacy Trial». J Natl Cancer Inst. 88 (21): 1550–9. PMID 8901853. doi:10.1093/jnci/88.21.1550
- ↑ Albanes D (1999). «Beta-carotene and lung cancer: a case study». Am J Clin Nutr. 69 (6): 1345S–50S. PMID 10359235
- ↑ Study Citing Antioxidant Vitamin Risks Based On Flawed Methodology, Experts Argue Comunicado da Oregon State University, publicado na ScienceDaily; acedido em 19 de Abril de 2007
- ↑ Bjelakovic, G; Nikolova, D; Gluud, LL; Simonetti, RG; Gluud, C (2008). Bjelakovic, Goran, ed. «Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases». Cochrane Database of Systematic Reviews (2): CD007176. PMID 18425980. doi:10.1002/14651858.CD007176
- ↑ Miller E, Pastor-Barriuso R, Dalal D, Riemersma R, Appel L, Guallar E (2005). «Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality». Ann Intern Med. 142 (1): 37–46. PMID 15537682
- ↑ Bjelakovic G, Nagorni A, Nikolova D, Simonetti R, Bjelakovic M, Gluud C (2006). «Meta-analysis: antioxidant supplements for primary and secondary prevention of colorectal adenoma». Aliment Pharmacol Ther. 24 (2): 281–91. PMID 16842454. doi:10.1111/j.1365-2036.2006.02970.x
- ↑ Caraballoso M, Sacristan M, Serra C, Bonfill X (2003). Caraballoso, Magali, ed. «Drugs for preventing lung cancer in healthy people». Cochrane Database Syst Rev (2): CD002141. PMID 12804424. doi:10.1002/14651858.CD002141
- ↑ Bjelakovic G, Nagorni A, Nikolova D, Simonetti R, Bjelakovic M, Gluud C (2006). «Meta-analysis: antioxidant supplements for primary and secondary prevention of colorectal adenoma». Aliment. Pharmacol. Ther. 24 (2): 281–91. PMID 16842454. doi:10.1111/j.1365-2036.2006.02970.x
- ↑ Coulter I, Hardy M, Morton S, Hilton L, Tu W, Valentine D, Shekelle P (2006). «Antioxidants vitamin C and vitamin e for the prevention and treatment of cancer». Journal of general internal medicine: official journal of the Society for Research and Education in Primary Care Internal Medicine. 21 (7): 735–44. PMC 1924689
 . PMID 16808775. doi:10.1111/j.1525-1497.2006.00483.x
. PMID 16808775. doi:10.1111/j.1525-1497.2006.00483.x - ↑ Schumacker P (2006). «Reactive oxygen species in cancer cells: Live by the sword, die by the sword». Cancer Cell. 10 (3): 175–6. PMID 16959608. doi:10.1016/j.ccr.2006.08.015
- ↑ Seifried H, McDonald S, Anderson D, Greenwald P, Milner J (2003). «The antioxidant conundrum in cancer». Cancer Res. 63 (15): 4295–8. PMID 12907593
- ↑ Lawenda BD, Kelly KM, Ladas EJ, Sagar SM, Vickers A, Blumberg JB (2008). «Should supplemental antioxidant administration be avoided during chemotherapy and radiation therapy?». J. Natl. Cancer Inst. 100 (11): 773–83. PMID 18505970. doi:10.1093/jnci/djn148
- ↑ Block KI, Koch AC, Mead MN, Tothy PK, Newman RA, Gyllenhaal C (2008). «Impact of antioxidant supplementation on chemotherapeutic toxicity: a systematic review of the evidence from randomized controlled trials». Int. J. Cancer. 123 (6): 1227–39. PMID 18623084. doi:10.1002/ijc.23754
- ↑ Block KI, Koch AC, Mead MN, Tothy PK, Newman RA, Gyllenhaal C (2007). «Impact of antioxidant supplementation on chemotherapeutic efficacy: a systematic review of the evidence from randomized controlled trials». Cancer Treat. Rev. 33 (5): 407–18. PMID 17367938. doi:10.1016/j.ctrv.2007.01.005
- ↑ Cao G, Alessio H, Cutler R (1993). «Oxygen-radical absorbance capacity assay for antioxidants». Free Radic Biol Med. 14 (3): 303–11. PMID 8458588. doi:10.1016/0891-5849(93)90027-R
- ↑ Ou B, Hampsch-Woodill M, Prior R (2001). «Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe». J Agric Food Chem. 49 (10): 4619–26. PMID 11599998. doi:10.1021/jf010586o
- ↑ Prior R, Wu X, Schaich K (2005). «Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements». J Agric Food Chem. 53 (10): 4290–302. PMID 15884874. doi:10.1021/jf0502698
- ↑ Xianquan S, Shi J, Kakuda Y, Yueming J (2005). «Stability of lycopene during food processing and storage». J Med Food. 8 (4): 413–22. PMID 16379550. doi:10.1089/jmf.2005.8.413
- ↑ Rodriguez-Amaya D (2003). «Food carotenoids: analysis, composition and alterations during storage and processing of foods». Forum Nutr. 56: 35–7. PMID 15806788
- ↑ Baublis A, Lu C, Clydesdale F, Decker E (2000). «Potential of wheat-based breakfast cereals as a source of dietary antioxidants». J Am Coll Nutr. 19 (3 Suppl): 308S–311S. PMID 10875602. Consultado em 18 de janeiro de 2012. Arquivado do original em 23 de dezembro de 2009
- ↑ Rietveld A, Wiseman S (2003). «Antioxidant effects of tea: evidence from human clinical trials». J Nutr. 133 (10): 3285S–3292S. PMID 14519827
- ↑ Maiani G, Periago Castón MJ, Catasta G (2008). «Carotenoids: Actual knowledge on food sources, intakes, stability and bioavailability and their protective role in humans». Mol Nutr Food Res. 53: S194–218. PMID 19035552. doi:10.1002/mnfr.200800053
- ↑ Henry C, Heppell N (2002). «Nutritional losses and gains during processing: future problems and issues». Proc Nutr Soc. 61 (1): 145–8. PMID 12002789. doi:10.1079/PNS2001142
- ↑ «Antioxidants and Cancer Prevention: Fact Sheet». National Cancer Institute. Consultado em 27 de fevereiro de 2007
- ↑ Ortega RM (2006). «Importance of functional foods in the Mediterranean diet». Public Health Nutr. 9 (8A): 1136–40. PMID 17378953. doi:10.1017/S1368980007668530
- ↑ Goodrow EF, Wilson TA, Houde SC (2006). «Consumption of one egg per day increases serum lutein and zeaxanthin concentrations in older adults without altering serum lipid and lipoprotein cholesterol concentrations». J. Nutr. 136 (10): 2519–24. PMID 16988120
- ↑ Witschi A, Reddy S, Stofer B, Lauterburg B (1992). «The systemic availability of oral glutathione». Eur J Clin Pharmacol. 43 (6): 667–9. PMID 1362956. doi:10.1007/BF02284971
- ↑ Flagg EW, Coates RJ, Eley JW (1994). «Dietary glutathione intake in humans and the relationship between intake and plasma total glutathione level». Nutr Cancer. 21 (1): 33–46. PMID 8183721. doi:10.1080/01635589409514302
- ↑ a b Dodd S, Dean O, Copolov DL, Malhi GS, Berk M (2008). «N-acetylcysteine for antioxidant therapy: pharmacology and clinical utility». Expert Opin Biol Ther. 8 (12): 1955–62. PMID 18990082. doi:10.1517/14728220802517901
- ↑ van de Poll MC, Dejong CH, Soeters PB (2006). «Adequate range for sulfur-containing amino acids and biomarkers for their excess: lessons from enteral and parenteral nutrition». J. Nutr. 136 (6 Suppl): 1694S–1700S. PMID 16702341
- ↑ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (2004). «Glutathione metabolism and its implications for health». J. Nutr. 134 (3): 489–92. PMID 14988435
- ↑ Pan MH, Ho CT (2008). «Chemopreventive effects of natural dietary compounds on cancer development». Chem Soc Rev. 37 (11): 2558–74. PMID 18949126. doi:10.1039/b801558a
- ↑ Kader A, Zagory D, Kerbel E (1989). «Modified atmosphere packaging of fruits and vegetables». Crit Rev Food Sci Nutr. 28 (1): 1–30. PMID 2647417. doi:10.1080/10408398909527490
- ↑ Zallen E, Hitchcock M, Goertz G (1975). «Chilled food systems. Effects of chilled holding on quality of beef loaves». J Am Diet Assoc. 67 (6): 552–7. PMID 1184900
- ↑ Iverson F (1995). «Phenolic antioxidants: Health Protection Branch studies on butylated hydroxyanisole». Cancer Lett. 93 (1): 49–54. PMID 7600543. doi:10.1016/0304-3835(95)03787-W
- ↑ «E number index». UK food guide. Consultado em 5 de março de 2007
- ↑ Robards K, Kerr A, Patsalides E (1988). «Rancidity and its measurement in edible oils and snack foods. A review». Analyst. 113 (2): 213–24. PMID 3288002. doi:10.1039/an9881300213
- ↑ Del Carlo M, Sacchetti G, Di Mattia C, Compagnone D, Mastrocola D, Liberatore L, Cichelli A (2004). «Contribution of the phenolic fraction to the antioxidant activity and oxidative stability of olive oil». J Agric Food Chem. 52 (13): 4072–9. PMID 15212450. doi:10.1021/jf049806z
- ↑ Boozer, Charles E.; Hammond, George S.; Hamilton, Chester E.; Sen, Jyotirindra N. (1955). «Air Oxidation of Hydrocarbons.II. The Stoichiometry and Fate of Inhibitors in Benzene and Chlorobenzene». Journal of the American Chemical Society. 77 (12): 3233–7. doi:10.1021/ja01617a026
- ↑ «Market Study: Antioxidants». Ceresana Research]
- ↑ «Why use Antioxidants?». SpecialChem Adhesives. Consultado em 27 de fevereiro de 2007. Arquivado do original em 11 de fevereiro de 2007
- ↑ a b «Fuel antioxidants». Innospec Chemicals. Consultado em 27 de fevereiro de 2007. Arquivado do original em 15 de outubro de 2006
Bibliografia[editar | editar código-fonte]
- Nick Lane Oxygen: The Molecule That Made the World (Oxford University Press, 2003) ISBN 0-19-860783-0
- Barry Halliwell and John M.C. Gutteridge Free Radicals in Biology and Medicine(Oxford University Press, 2007) ISBN 0-19-856869-X
- Jan Pokorny, Nelly Yanishlieva and Michael H. Gordon Antioxidants in Food: Practical Applications (CRC Press Inc, 2001) ISBN 0-8493-1222-1
Ligações externas[editar | editar código-fonte]
- «U.S. National Institute Health, Office on Dietary Supplements» (em inglês)
- «MedlinePlus: Antioxidants» (em inglês)


 French
French Deutsch
Deutsch