Ciclo menstrual – Wikipédia, a enciclopédia livre
O ciclo menstrual é o termo científico para as alterações fisiológicas que ocorrem nas mulheres férteis que têm como finalidade a reprodução sexual e fecundação. Este artigo foca-se apenas no ciclo menstrual humano.
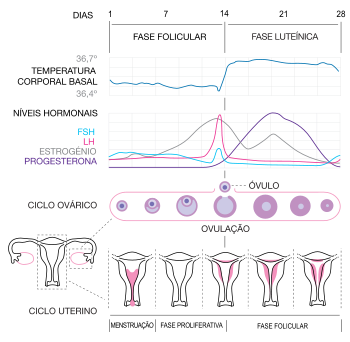
O ciclo menstrual, regulado pelo sistema endócrino, é fundamental para a reprodução. É frequentemente dividido em três fases: a fase folicular, a ovulação e a fase luteínica, embora algumas fontes refiram um conjunto diferente de fases: a menstruação, a fase proliferativa e a fase secretora.[1] Os ciclos menstruais contam-se a partir do primeiro dia de hemorragia menstrual. A contracepção hormonal intervém nas alterações hormonais naturais de forma a impedir a reprodução.
Estimuladas por quantidades cada vez mais elevadas de estrogénio durante a fase folicular, as hemorragias menstruais abrandam até cessarem por completo, e o endométrio do útero torna-se mais espesso. Inicia-se então o desenvolvimento dos folículos nos ovários, através da influência de um conjunto complexo de hormonas. Após vários dias, um ou ocasionalmente dois dos folículos tornam-se dominantes, e os restantes atrofiam e morrem. Por volta do meio do ciclo, e 24 a 36 horas depois do pico de afluência de hormona luteinizante (LH), o folículo dominante liberta um óvulo durante um estágio designado por ovulação. Depois deste estágio, o óvulo apenas sobrevive durante 24 horas ou menos caso não ocorra fertilização, enquanto que os resquícios do folículo dominante no ovário se tornam corpos lúteos, produzindo grandes quantidades de progesterona. Estimulado pela presença desta hormona, o endométrio altera-se de modo a preparar-se para potenciais nidações de um embrião iniciando-se assim a gravidez. Caso a nidação não ocorra em aproximadamente duas semanas, o corpo lúteo involui, causando quedas abruptas nos níveis de progesterona e de estrogénio. Estas quebras indicam ao útero o momento para eliminar o óvulo e a sua membrana de revestimento, num processo designado por menstruação, terminando assim um ciclo.
Durante o ciclo menstrual, ocorrem também alterações nos sistemas fisiológicos, sobretudo no sistema reprodutivo, que podem dar origem a mastodinia ou alterações de ânimo. A primeira menstruação da mulher é designada por menarca e ocorre frequentemente por volta dos 12 ou 13 anos. A idade média da menarca é de cerca de 12,2 anos em Portugal,[2] 12,5 anos nos Estados Unidos,[3] 12,72 no Canadá,[4] 12,9 no Reino Unido,[5] e 13,06 ± 0,1 anos na Islândia.[6] O fim da fase reprodutiva da mulher designa-se menopausa e ocorre normalmente entre os 45 e 55 anos de idade.
Terminologia[editar | editar código-fonte]
A menarca é um dos estágios mais avançados da puberdade feminina. A idade média para a sua ocorrência é entre os 12 e 13 anos nos humanos, mas são consideradas normais as ocorrências entre os 8 e os 16 anos. Esta variação pode ser influenciada e explicada por factores como a hereditariedade, a dieta alimentar e a condição geral de saúde da adolescente.[7] O fim dos ciclos menstruais após o período fértil da mulher é designado por menopausa. A idade média em que ocorre a menopausa são 52 anos nos países industrializados, sendo no entanto considerada normal a ocorrência entre os 45 e 55 anos. A menopausa que ocorra antes dos 45 anos é considerada prematura.[8] A idade a que ocorre é fundamentalmente resultado da genética. No entanto, determinadas doenças, cirurgias ou tratamentos clínicos podem fazer com que a menopausa se inicie mais cedo.[9]
A duração do ciclo menstrual normalmente varia entre ciclos mais curtos e outros ciclos mais longos. Uma variação de tempo entre os ciclos mais longos e mais curtos inferior a oito dias permite afirmar que a mulher tem ciclos regulares. Não é comum haver variações menores do que quatro dias. Uma variação entre 8 e 20 dias é considerada irregular. Variações superiores a 20 dias são consideradas muito irregulares.[10]
Fases[editar | editar código-fonte]
O ciclo menstrual pode ser dividido em diferentes fases. A duração média de cada fase pode ser vista em baixo. As primeiras três estão relacionadas com alterações no revestimento uterino, enquanto que as três últimas estão relacionadas com processos que decorrem nos ovários:
| Fase | Dia médio de início assumindo um ciclo de 28 dias | Dia médio do término |
| Menstruação | 1 | 4 |
| Fase proliferativa (Alguns autores incluem a menstruação nesta fase) | 5 | 13 |
| Ovulação | 13 | 16 |
| Fase luteínica (também designada por fase secretora) | 16 | 28 |
| Fase isquémica | 27 | 28 |
| Fase folicular | 1 | 13 |
Menstruação[editar | editar código-fonte]
A presença da menstruação, também designada por período, serve normalmente como indicador de que a mulher não se encontra grávida. Note-se, no entanto, que tal facto não pode ser encarado como garantia uma vez que existem inúmeras causas que levam a hemorragias vaginais durante a gravidez. Algumas destas causas são exclusivas do primeiro trimestre de gravidez, e alguns podem causar hemorragia obstétrica.[11][12]

O termo eumenorreia designa a menstruação regular e normal que ocorre durante alguns dias; normalmente 3 a 5, mas qualquer valor entre 2 e 7 dias é considerado normal.[14][15] O valor de sangue perdido durante a menstruação é de cerca de 35 mililitros, sendo normal qualquer valor entre 10 e 80 ml.[16] Em consequência da hemorragia menstrual, as mulheres são mais susceptíveis à deficiência de ferro do que os homens.[17] Uma enzima chamada plasmina impede a coagulação do fluido menstrual.[18]
Durante os primeiros dias da menstruação são comuns cólicas abdominais, assim como dores nas costas e nas ancas. A dor intensa no útero durante a menstruação designa-se por dismenorreia e é mais frequente entre adolescentes e mulheres jovens, afectando 67,2% das adolescentes.[19] Quando se inicia a menstruação, normalmente diminui também a intensidade dos sintomas associados à tensão pré-menstrual (TPM), como a mastodinia e irritabilidade.[15]
Fase folicular[editar | editar código-fonte]
Esta fase também é designada por fase proliferativa devido à acção hormonal que provoca o crescimento, ou proliferação, do revestimento uterino durante este período.[20]
O aumento dos valores da hormona folículo-estimulante (FSH) durante os primeiros dias do ciclo estimula alguns dos folículos ovarianos.[20] Estes folículos, presentes nos ovários desde o nascimento[20] e em desenvolvimento constante ao longo de um ano num processo designado por foliculogénese, competem entre si pelo domínio. Através da acção de várias hormonas, todos os folículos excepto um param de crescer, que será o dominante e continuará a crescer até à maturação. Um folículo que atinja a maturidade é designado por folículo terciário, ou folículo de Graaf, e formará o óvulo.[20]
À medida que amadurecem, os folículos segregam quantidades cada vez maiores de um estrogénio designado por estradiol. Os estrogénios dão início à formação de uma nova camada de endométrio no útero, classificado como endométrio proliferativo. O estrogénio também estimula as glândulas do colo do útero a produzir muco cervical fértil, o que pode ser registado por mulheres que pratiquem monitorização da fertilidade.[21]
Ovulação[editar | editar código-fonte]

Durante a fase folicular, o estradiol suprime a produção de hormonas luteinizantes (LH) na adenoipófise. À medida que o óvulo se aproxima da maturação, os níveis de estradiol alcançam um valor de referência acima do qual estimulam a produção de LH. As diferentes respostas das LH ao estradiol podem ser explicadas pela presença de dois receptores distintos de estrogénio no hipotálamo: o receptor de estrogénio alfa, responsável pelo ciclo estradiol-LH de retroalimentação negativa e o receptor de estrogénio beta, responsável pela relação estradiol-LH positiva. Num ciclo regular, a afluência de LH tem início no 12º dia e pode decorrer durante 48 horas.[22]
A libertação de LH amadurece o óvulo e enfraquece a parede do folículo no ovário, o que faz com que um folículo completamente desenvolvido liberte o seu ovócito secundário.[20] Este ovócito secundário tornar-se-á um óvulo, que no fim deste processo apresenta já um diâmetro de cerca de 0,2 mm.[23]
Qual dos dois ovários ovula - o direito ou esquerdo - aparenta ser de ordem aleatória, não sendo conhecido qualquer mecanismo de coordenação entre ambos.[24] Ocasionalmente, ambos os ovários podem libertar um óvulo,[24] e no caso de ambos serem fertilizados dão origem a gémeos bivitelinos.[25]
Depois de ser libertado pelo ovário, o óvulo é lançado nas trompas de falópio através da fímbria, uma pequena membrana de tecido no fim de cada trompa. Após cerca de um dia, um óvulo não fertilizado desintegra-se ou dissolve-se.[20]
A fertilização pelo espermatozoide, quando ocorre, dá-se normalmente na ampola uterina, a secção mais larga das trompas de Falópio. Um óvulo fertilizado começa imediatamente o processo de embriogénese. O embrião em desenvolvimento leva cerca de três dias a alcançar o útero e mais três dias a implantar-se no endométrio, altura em que já atingiu o estágio de blastocisto.[20]
Nalgumas mulheres, a ovulação é acompanhada por uma dor característica designada por mittelschmerz.[15] A alteração hormonal súbita nas hormonas durante o período da ovulação pode por vezes causar hemorragias ligeiras a meio do ciclo.[26]
Fase luteínica[editar | editar código-fonte]
A fase luteínica é também designada por fase secretora. O corpo lúteo, formado no ovário depois do óvulo ser libertado na trompa de falópio, desempenha um papel importante durante esta fase, continuando a crescer durante algum tempo após a ovulação e produzindo quantidades significativas de hormonas, sobretudo progesterona.[20] A progesterona é fundamental ao fazer com que o endométrio se torne receptivo à nidação do blastocisto e capaz de oferecer condições para o primeiro estágio da gravidez. Como efeito secundário, aumenta também a temperatura corporal basal da mulher.[27]
Após a ovulação, as hormonas pituitárias FSH e LH fazem com que os resquícios do folículo dominante se transformem no corpo lúteo, que produz progesterona. O aumento desta hormona na glândula suprarrenal induz a produção de estrogénio. As hormonas produzidas pelo corpo lúteo também suprimem a produção de FSH e HL de que o corpo lúteo necessita. Consequentemente, os níveis de FSH e HL decrescem rapidamente, fazendo com que o corpo lúteo atrofie.[20] A queda dos níveis de progesterona activa a menstruação e o início do ciclo seguinte. Desde a ovulação até à supressão de progesterona que dá início à menstruação, decorrem em média duas semanas, sendo considerado normal um período de 14 dias. Em cada mulher, a duração da fase folicular varia frequentemente de ciclo para ciclo. Pelo contrário, a duração da fase luteínica demonstra ser bastante coerente entre cada ciclo.[28]
A perda do corpo lúteo não ocorre quando existe fertilização do óvulo. O embrião produz gonadotrofina coriónica humana, que é bastante similar à LH e capaz de preservar o corpo lúteo. Uma vez que esta hormona é apenas produzida pelo embrião, muitos testes de gravidez são reactivos à sua presença.[20]
Duração[editar | editar código-fonte]
Embora muitas pessoas acreditem que o ciclo menstrual médio dure cerca de 28 dias, um estudo que analisou mais de 30 000 ciclos em mais de 2,3 mil mulheres veio a demonstrar que a duração média do ciclo é de 29,1 dias, com um desvio padrão de 7,5 dias e um intervalo de predição de 95% entre 15 a 45 dias.[29] No mesmo estudo, o subconjunto de dados com durações de ciclos entre 15 e 45 dias mostrava uma duração média de 28,1 dias, com um desvio padrão de 4 dias. Um estudo de menor escala, realizado em 2006 numa amostra de 140 mulheres, concluiu a existência de uma duração média de 28,9 dias.[30]
A variação da duração do ciclo menstrual é maior entre mulheres com 25 anos ou menos, e menor, ou seja, mais regular, entre os 35 e 39 anos de idade.[29] Normalmente, as variações entre 8 e 20 dias são consideradas ciclos menstruais moderadamente irregulares.[10] As variações de 21 ou mais dias são consideradas muito irregulares.[10]
Desde muito cedo que é proposto que o ciclo menstrual esteja de alguma forma associado às fases da lua. Um estudo realizado em 1979 com 305 mulheres demonstrou que cerca de um terço registava ciclos coincidentes com o ciclo lunar, isto é, uma duração média de 29,5 dias mais ou menos 1 dia. Quase dois terços revelaram que o seu ciclo se iniciava durante a fase mais brilhante do ciclo lunar, significativamente mais do que seria de esperar numa distribuição aleatória.[31] Outro estudo demonstrou que um número estatisticamente significativo de menstruações ocorria durante a lua nova.[32]
Período fértil[editar | editar código-fonte]
O período mais fértil, isto é, o período com maiores probabilidades de ocorrência de uma gravidez como resultado de uma relação sexual, ocorre durante os 5 dias que antecedem a ovulação até aos 1-2 dias que lhe sucedem.[33] Num ciclo de 28 dias com uma fase luteínica de 14 dias, isto corresponde à segunda e ao início da terceira semana. Foram desenvolvidos vários métodos para ajudar a mulher a fazer uma estimativa dos dias relativamente férteis ou inférteis durante o ciclo, designados por monitorização da fertilidade.
Os métodos de monitorização que apenas têm como base os registos de duração dos ciclos designam-se por métodos rítmicos.[34] Os métodos que requerem a observação de um ou mais dos três sinais básicos de fertilidade (temperatura corporal basal, muco do colo do útero e posição cervical)[35] são conhecidos como métodos de avaliação de sintomas.[34] Estão também disponíveis kits de testes de urina que detectam a afluência de HL que ocorre nas 24 a 36 horas antes da ovulação, conhecidos como kits de previsão de ovulação.[36]
A fertilidade feminina é também influenciada pela idade.[37] Uma vez que todos os óvulos de uma mulher se formam durante o feto,[38] para serem fertilizados apenas décadas mais tarde, tem sido proposto que este longo período de tempo pode fazer com que a cromatina dos óvulos se vá tornando mais vulnerável a problemas decorrentes da divisão, quebras e mutações, em relação à cromatina do esperma, que é produzido de forma contínua durante a fase reprodutiva do homem.[39]
Efeitos noutros sistemas[editar | editar código-fonte]
Algumas mulheres que apresentam um quadro clínico de distúrbios ou sintomas neurológicos sentem um aumento da actividade sintomática por volta da mesma altura de cada ciclo menstrual. Por exemplo, está demonstrado que as quebras nos níveis de estrogénio são a causa directa de enxaquecas,[40] sobretudo quando a mulher também está a tomar a pílula. Muitas mulheres com epilepsia demonstram ter um número mais frequente de ataques (epilepsia catamenial) segundo um padrão relacionado com o ciclo menstrual.[41] Parecem existir diferentes padrões, tais como ataques coincidentes com a menstruação ou com a ovulação, mas a frequência a que ocorrem ainda não foi alvo de conclusões sólidas. Recorrendo a uma definição própria, um grupo de investigadores descobriu que cerca de um terço das mulheres com epilepsia parcial intratável demonstram igualmente epilepsia catamenial.[41][42][43] Tem sido sugerido que tal se possa dever ao efeito das hormonas, em que a quebra da progesterona e o aumento de estrogénio espoletariam os ataques.[44] Mais recentemente, os estudos têm demonstrado que doses elevadas de estrogénio podem causar ou piorar os ataques, enquanto que doses elevadas de progesterona podem agir como uma droga antiepiléptica.[45] Alguns estudos levados a cabo por publicações médicas revelaram que as mulheres durante a menstruação são 1,68 vezes mais susceptíveis de cometer suicídio.[46]
Recorrendo a experiências em ratos de laboratório, têm sido investigados possíveis mecanismos através dos quais os níveis de hormonas esteroides sexuais possam regular funções do sistema nervoso. Durante a parte do ciclo em que a fêmea do rato apresenta os valores mais altos de progesterona, os níveis dos receptores GABA subtipo delta são igualmente altos. Uma vez que os receptores GABA são inibitórios, as células nervosas com mais receptores delta são menos propensas a ser deflagradas que as células com menor número de receptores delta. Durante a parte do ciclo em que os níveis de estrogénio são mais altos do que os níveis de progesterona, o número de receptores delta diminui, aumentando a actividade nos neurónios, aumentando também a ansiedade e susceptibilidade aos ataques.[47]
Os níveis de estrogénio podem também afectar o comportamento da tiroide.[48] Por exemplo, durante a fase luteínica, quando os níveis de estrogénio apresentam os valores mais baixos, a velocidade da corrente sanguínea na tiroide é menor do que durante a fase folicular, quando os níveis de estrogénio são altos.[49]
Durante algum tempo foi proposta a existência de sincronia menstrual entre mulheres que vivessem juntas. Este efeito foi sugerido originalmente em 1971, tendo sido proposta em 1998 uma possível explicação através da acção das feromonas.[50] No entanto, estudos posteriores têm posto em causa esta hipótese.[51]
Anomalias e irregularidades no ciclo[editar | editar código-fonte]
A ovulação irregular ou pouco frequente designa-se por oligo-ovulação.[52] A ausência de ovulação designa-se por anovulação. Mesmo que não se processe a ovulação, a hemorragia menstrual pode decorrer normalmente, fenómeno que se designa por ciclo anovulatório. Nalguns ciclos, os folículos podem começar o processo de maturação, mas esse processo nunca chegar a ser completo; no entanto, o estrogénio continua a estimular a formação do revestimento da parede do útero. Níveis elevados, contínuos e prolongados de estrogénio que provocam um endométrio bastante espesso, podem levar à ocorrência de hemorragias menstruais anovulatórias fora do período normal de menstruação. A hemorragia anovulatória espoletada por uma queda súbita dos níveis de estrogénio é designada por hemorragia de privação.[53][54] Os ciclos anovulatórios ocorrem normalmente antes da menopausa e em mulheres com síndrome do ovário policístico.[55]
Um fluxo muito diminuto (menos de 10 ml) designa-se por hipomenorreia. ciclos regulares com intervalos de 21 dias ou menos designam-se por polimenorreia. A menstruação frequente, mas irregular, designa-se por metrorragia. Fluxos consideráveis e súbitos de quantidades superiores a 80 ml designam-se por menorragia.[56] A hemorragia abundante que ocorra frequente e irregularmente designa-se por menometrorragia. O termo para ciclos com intervalos que excedam 35 dias é oligomenorreia.[57] Por sua vez, amenorreia refere-se a períodos entre três a seis meses sem menstruação fora da gravidez e durante a idade fértil da mulher.[56][57]
Supressão da ovulação[editar | editar código-fonte]
Contracepção hormonal[editar | editar código-fonte]

Enquanto que algumas formas de planeamento familiar não afectam o ciclo menstrual, os contraceptivos hormonais actuam através da sua interrupção. A retroalimentação negativa da progesterona diminui a frequência de libertação da hormona libertadora de gonadotrofina (GnRH) pelo hipotálamo, o que diminui a libertação de hormona folículo-estimulante (FSH) e hormona luteinizante (LH) pela adenoipófise. Os baixos níveis de FSH inibem o desenvolvimento folicular, impedindo o aumento dos níveis de estradiol. A retroalimentação negativa da progesterona e a ausência de retroalimentação positiva de estrogénio na libertação de LH impedem uma afluência de LH a meio do ciclo. Por sua vez, a inibição do desenvolvimento folicular e a ausência da afluência de LH impedem a ovulação.[58][59][60]
O grau de supressão de ovulação nos contraceptivos exclusivamente de progestágenos depende da actividade e dosagem do progestágeno. Contraceptivos exclusivamente de progestágeno de baixa dosagem – como a pílula de progestágeno, implantes sub-dérmicos como o Norplant e o sistema intrauterino – inibem a ovulação apenas em cerca de metade dos ciclos e a sua eficácia anticoncepcional assenta sobretudo noutras acções, como o aumento da espessura do muco cervical.[61] Os contraceptivos com uma dosagem intermédia permitem algum desenvolvimento folicular, mas inibem a ovulação de forma mais frequente, em 97 a 99% dos ciclos. As alterações do muco cervical são semelhantes às que ocorrem com progestágeno de baixa dosagem. Os contraceptivos com doses elevadas de progestágeno, normalmente injectáveis, inibem completamente o desenvolvimento folicular e a ovulação.[61]
Os contraceptivos hormonais combinados são compostos tanto por um estrogénio como por um progestágeno. A retroalimentação negativa da progesterona, ao diminuir a frequência de libertação da hormona libertadora de gonadotrofina pelo hipotálamo, que diminui também a libertação de FSH, faz com que os contraceptivos combinados sejam mais eficazes na inibição do desenvolvimento folicular e na supressão da ovulação. O estrogénio reduz também a incidência de hemorragias irregulares.[58][59][60] Vários dos contraceptivos combinados são normalmente usados de forma a causar hemorragias regulares. Durante um ciclo normal, a menstruação ocorre quando os níveis de estrogénio e progesterona têm uma quebra abrupta.[27]
Método de amenorreia lactacional[editar | editar código-fonte]
A amamentação faz com que haja realimentação negativa nas secreções de hormona libertadora de gonadotrofina (GnRH) e hormona luteinizante (LH). Dependendo da intensidade desta realimentação negativa, pode dar-se o caso da suspensão completa do desenvolvimento folicular, ou desenvolvimento folicular em ovulação, ou então o retomar do ciclo menstrual normal.[62] A supressão da ovulação é mais provável nos casos em que a amamentação seja mais frequente.[63] A produção de prolactina é importante para manter a amenorreia lactacional.[64] As mulheres que amamentam os filhos a tempo inteiro cujos filhos mamam frequentemente observam, em média, um regresso da menstruação catorze meses e meio após o parto. No entanto, existe uma grande variedade na resposta entre mulheres, entre o regresso da menstruação apenas dois meses após o parto até casos de amenorreia até 42 meses pós-parto.[65]
Referências
- ↑ Greenberg, Jerrold S.; Clint E. Bruess, Sarah C. Conklin (2007). Exploring the dimensions of human sexuality 3rd ed. [S.l.]: Jones & Bartlett. pp. 136–137
- ↑ Leitão, Raquel (Maio de 2011). "A obesidade da infância para a adolescência : um estudo longitudinal em meio escolar" . Universidade do Minho. Acessado em Fevereiro de 2012.
- ↑ Anderson SE, Dallal GE, Must A (2003). «Relative weight and race influence average age at menarche: results from two nationally representative surveys of US girls studied 25 years apart». Pediatrics. 111 (4 Pt 1): 844–50. PMID 12671122. doi:10.1542/peds.111.4.844
- ↑ BMC Public Health (2010). «Age at menarche in Canada: results from th...»
- ↑ Hamilton-Fairley, Diana. «Lecture Notes: Obstetrics and Gynaecology» (PDF). Consultado em 27 de Fevereiro de 2012
- ↑ Magnússon, T.E. (1978). «Age at menarche in Iceland.». American journal of physical anthropology. 48 (4): 511–4. ISSN 0002-9483. PMID 655271. doi:10.1002/ajpa.1330480410
- ↑ «At what age does a girl get her first period?». National Women's Health Information Center. Consultado em 20 de novembro de 2011. Arquivado do original em 23 de novembro de 2011
- ↑ «Clinical topic - Menopause». NHS. Consultado em 2 de Novembro de 2009. Arquivado do original em 7 de julho de 2009
- ↑ Shuman, Tracy (2006). «Your Guide to Menopause». WebMD. Consultado em 16 de Dezembro de 2006
- ↑ a b c Kippley, John; Sheila Kippley (1996). The Art of Natural Family Planning 4th ed. Cincinnati, OH: The Couple to Couple League. p. 92. ISBN 0-926412-13-2
- ↑ Anderson-Berry, Ann L; Terence Zach (10 de Dezembro de 2007). «Vanishing Twin Syndrome». WebMD. Emedicine.com. Consultado em 21 de Setembro de 2008
- ↑ Ko, Patrick; Young Yoon (23 de Agosto de 2007). «Placenta Previa». WebMD. Emedicine.com. Consultado em 21 de Setembro de 2008
- ↑ As referências e a descrição mais detalhada dos valores são oferecidos na página da imagem no Wikimedia Commons em Commons:File:Hormones estradiol, progesterone, LH and FSH during menstrual cycle.svg.
- ↑ The National Women's Health Information Center (2002). «What is a typical menstrual period like?». U.S. Department of Health and Human Services. Consultado em 11 de Junho de 2005. Arquivado do original em 2 de março de 2007
- ↑ a b c John M Goldenring (1 de Fevereiro de 2007). «All About Menstruation». WebMD. Consultado em 5 de Outubro de 2008
- ↑ David L Healy (24 de novembro de 2004). «Menorrhagia Heavy Periods - Current Issues». Monash University. ABN 12 377 614 012. Consultado em 16 de fevereiro de 2012. Arquivado do original em 16 de outubro de 2013
- ↑ Harvey LJ, Armah CN, Dainty JR,; et al. (2005). «Impact of menstrual blood loss and diet on iron deficiency among women in the UK». The British journal of nutrition. 94 (4): 557–64. PMID 16197581. doi:10.1079/BJN20051493. Consultado em 5 de Outubro de 2008
- ↑ Shiraishi M (1962). «Studies on identification of menstrual blood stain by fibrin-plate method. I. A study on the incoagulability of menstrual blood» (PDF). Acta medicinae Okayama. 16: 192–200. PMID 13977381. Consultado em 22 de Fevereiro de 2012. Arquivado do original (PDF) em 10 de abril de 2014
- ↑ Sharma P, Malhotra C, Taneja DK, Saha R (2008). "Problems related to menstruation amongst adolescent girls". Indian J Pediatr 75 (2): 125–9. doi:10.1007/s12098-008-0018-5. PMID 18334791
- ↑ a b c d e f g h i j Losos, Jonathan B.; Raven, Peter H.; Johnson, George B.; Singer, Susan R. (2002). Biology. New York: McGraw-Hill. pp. 1207–09. ISBN 0-07-303120-8
- ↑ Weschler, Toni (2002). Taking Charge of Your Fertility Revised ed. New York: HarperCollins. pp. 359–361. ISBN 0-06-093764-5
- ↑ Hu L, Gustofson RL, Feng H,; et al. (2008). «Converse Regulatory Functions of Estrogen Receptor-α and -β Subtypes Expressed in Hypothalamic Gonadotropin-Releasing Hormone Neurons». Mol. Endocrinol. 22 (10): 2250–9. PMC 2582533
 . PMID 18701637. doi:10.1210/me.2008-0192
. PMID 18701637. doi:10.1210/me.2008-0192 - ↑ Gray, Henry David (2000). «The Ovum». Anatomy of the human body. Philadelphia: Bartleby.com. ISBN 1-58734-102-6. Consultado em 5 de Outubro de 2008
- ↑ a b Ecochard R, Gougeon A (2000). «Side of ovulation and cycle characteristics in normally fertile women». Human reproduction (Oxford, England). 15 (4): 752–5. PMID 10739814. doi:10.1093/humrep/15.4.752
- ↑ «Multiple Pregnancy: Twins or More - Topic Overview». WebMD Medical Reference from Healthwise. 24 de Julho de 2007. Consultado em 5 de Outubro de 2008
- ↑ Weschler (2002), p.65
- ↑ a b Weschler (2002), pp.361-2
- ↑ Weschler (2002), p.47
- ↑ a b Chiazze Jr, L; Brayer, FT; MacIsco Jr, JJ; Parker, MP; Duffy, BJ (1968). «The length and variability of the human menstrual cycle». JAMA : the journal of the American Medical Association. 203 (6): 377–80. PMID 5694118. doi:10.1001/jama.203.6.377
- ↑ Fehring, Richard; Schneider, Mary (2006). «Variability in the Phases of the Menstrual Cycle». Journal of Obstetric, Gynecologic, and Neonatal Nursing. 35 (3). doi:10.1111/j.1552-6909.2006.00051.x
- ↑ Friedmann, E (1981). «Menstrual and lunar cycles». American journal of obstetrics and gynecology. 140 (3). 350 páginas. PMID 7246643
- ↑ Law, Sung Ping (1986). «The Regulation of Menstrual Cycle and its Relationship to the Moon». Acta Obstetricia et Gynecologica Scandinavica. 65 (1): 45–8. PMID 3716780. doi:10.3109/00016348609158228
- ↑ Weschler (2002), pp.242,374
- ↑ a b «Medical Eligibility Criteria for Contraceptive Use:Fertility awareness-based methods». World Health Organization. Third edition. 2004. Consultado em 29 de Abril de 2008
- ↑ Weschler (2002), p.52
- ↑ MedlinePlus Encyclopedia LH urine test (home test)
- ↑ Henri Leridon (2004). «Can assisted reproduction technology compensate for the natural decline in fertility with age? A model assessment». 19 (7). doi:dx.doi.org/10.1093/humrep/deh304 Verifique
|doi=(ajuda) - ↑ Krock, Lexi (2001). «Fertility Throughout Life». 18 Ways to Make a Baby. NOVA Online. Consultado em 24 de Dezembro de 2006 Haines, Cynthiac (2006). «Your Guide to the Female Reproductive System». The Cleveland Clinic Women's Health Center. WebMD. Consultado em 24 de Dezembro de 2006
- ↑ Medvedev, ZA (1984). «Age changes of chromatin. A review.». PMID 6394910
- ↑ The Daily Headache. «Migraine and Estrogen Officially Linked». Consultado em 27 de Fevereiro de 2012
- ↑ a b Herzog AG (2008). «Catamenial epilepsy: definition, prevalence pathophysiology and treatment». Seizure : the journal of the British Epilepsy Association. 17 (2): 151–9. PMID 18164632. doi:10.1016/j.seizure.2007.11.014
- ↑ Herzog AG, Harden CL, Liporace J,; et al. (2004). «Frequency of catamenial seizure exacerbation in women with localization-related epilepsy». Annals of neurology. 56 (3): 431–4. PMID 15349872. doi:10.1002/ana.20214
- ↑ Herzog AG, Klein P, Ransil BJ (1997). «Three patterns of catamenial epilepsy». Epilepsia. 38 (10): 1082–8. PMID 9579954. doi:10.1111/j.1528-1157.1997.tb01197.x
- ↑ Scharfman HE, MacLusky NJ (2006). «The Influence of Gonadal Hormones on Neuronal Excitability, Seizures, and Epilepsy in the Female». Epilepsia. 47 (9): 1423–40. PMC 1924802
 . PMID 16981857. doi:10.1111/j.1528-1167.2006.00672.x[ligação inativa]
. PMID 16981857. doi:10.1111/j.1528-1167.2006.00672.x[ligação inativa] - ↑ epilepsy.com. «Menstrual cycle». Consultado em 27 de Fevereiro de 2012. Arquivado do original em 15 de outubro de 2012
- ↑ Enrique Baca-García, Carmen Diaz-Sastre, Antonio Ceverino, Jeronimo Saiz-Ruiz, Francisco J. Diaz, and Jose de Leon, E; Diaz-Sastre, C; Ceverino, A; Saiz-Ruiz, J; Diaz, FJ; De Leon, J (março–abril de 2003). «Association Between the Menses and Suicide Attempts: A Replication Study». Psychosomatic Medicine. 65 (2): 237–44. PMID 12651991. doi:10.1097/01.PSY.0000058375.50240.F6. Consultado em 2 de Dezembro de 2008
- ↑ Maguire JL, Stell BM, Rafizadeh M, Mody I (2005). «Ovarian cycle-linked changes in GABAA receptors mediating tonic inhibition alter seizure susceptibility and anxiety». Nat. Neurosci. 8 (6): 797–804. PMID 15895085. doi:10.1038/nn1469
- ↑ Doufas AG, Mastorakos G (2000). «The hypothalamic-pituitary-thyroid axis and the female reproductive system». Annals of the New York Academy of Sciences. 900: 65–76. PMID 10818393. doi:10.1111/j.1749-6632.2000.tb06217.x[ligação inativa]
- ↑ Krejza J, Nowacka A, Szylak A, Bilello M, Melhem LY (2004). «Variability of thyroid blood flow Doppler parameters in healthy women». Ultrasound in medicine & biology. 30 (7): 867–76. PMID 15313319. doi:10.1016/j.ultrasmedbio.2004.05.008
- ↑ Stern K, McClintock MK (1998). «Regulation of ovulation by human pheromones». Nature. 392 (6672): 177–9. PMID 9515961. doi:10.1038/32408
- ↑ Adams, Cecil (20 de Dezembro de 2002). «Does menstrual synchrony really exist?». The Straight Dope. The Chicao Reader. Consultado em 10 de Janeiro de 2007
- ↑ Galan, Nicole (16 de Abril de 2008). «Oligoovulation». about.com. Consultado em 12 de Outubro de 2008
- ↑ Weschler (2002), p.107
- ↑ Lucas V. Machado. «Sangramento Uterino Disfuncional»
- ↑ Anovulation no eMedicine
- ↑ a b Menstruation Disorders no eMedicine
- ↑ a b Oriel KA, Schrager S (1999). «Abnormal uterine bleeding». American Family Physician. 60 (5): 1371–80; discussion 1381–2. PMID 10524483. Consultado em 12 de Outubro de 2008
- ↑ a b Trussell, James (2007). «Contraceptive Efficacy». In: Hatcher, Robert A.; et al. Contraceptive Technology 19th rev. ed. New York: Ardent Media. ISBN 0-9664902-0-7
- ↑ a b Speroff, Leon; Darney, Philip D. (2005). «Oral Contraception». A Clinical Guide for Contraception 4th ed. Philadelphia: Lippincott Williams & Wilkins. pp. 21–138. ISBN 0-7817-6488-2
- ↑ a b Loose, Davis S.; Stancel, George M. (2006). «Estrogens and Progestins». In: Brunton, Laurence L.; Lazo, John S.; Parker, Keith L. (eds.). Goodman & Gilman's The Pharmacological Basis of Therapeutics 11th ed. New York: McGraw-Hill. pp. 1541–71. ISBN 0-07-142280-3
- ↑ a b Glasier, Anna (2006). «Contraception». In: DeGroot, Leslie J.; Jameson, J. Larry (eds.). Endocrinology 5th ed. Philadelphia: Elsevier Saunders. pp. 3000–1. ISBN 0-7216-0376-9
- ↑ McNeilly AS (2001). «Lactational control of reproduction». Reprod. Fertil. Dev. 13 (7–8): 583–90. PMID 11999309. doi:10.1071/RD01056
- ↑ Kippley, John; Sheila Kippley (1996). The Art of Natural Family Planning 4th ed. Cincinnati, OH: The Couple to Couple League. p. 347. ISBN 0-926412-13-2
- ↑ Stallings JF, Worthman CM, Panter-Brick C, Coates RJ (1996). «Prolactin response to suckling and maintenance of postpartum amenorrhea among intensively breastfeeding Nepali women». Endocr. Res. 22 (1): 1–28. PMID 8690004. doi:10.3109/07435809609030495
- ↑ «Breastfeeding: Does It Really Space Babies?». The Couple to Couple League International. Internet Archive. 17 de Janeiro de 2008. Consultado em 21 de Setembro de 2008. Arquivado do original em 17 de janeiro de 2008, que cita:
- Sheila K. and John F. Kippley (novembro–dezembro de 1972). «The relation between breastfeeding and amenorrhea». Journal of obstetric, gynecologic, and neonatal nursing. 1 (4): 15–21. PMID 4485271
- Sheila Kippley. novembro–dezembro de 1986 e Janeiro-Fevereiro de 1987. «Breastfeeding survey results similar to 1971 study». The CCL News. 13 (3): 10 e 13(4): 5.


 French
French Deutsch
Deutsch