Cromatóforo – Wikipédia, a enciclopédia livre
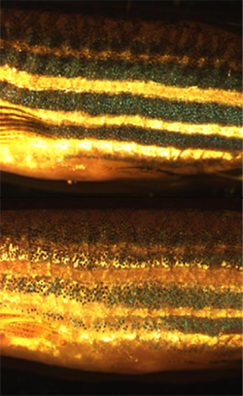
Os cromatóforos ou cromatócitos são células tegumentares especializadas, com muitas projeções citoplasmáticas, que lhe conferem aspecto dendrítico e são responsáveis por sintetizar e armazenar pigmentos. São células (ou grupos de células nalguns táxons) que contêm pigmentos no seu interior que reflectem a luz, conferindo-lhes cor. Podem ser encontradas numa ampla variedade de seres vivos como os peixes, anfíbios, répteis, crustáceos e alguns cefalópodes. O termo é também utilizado em bactérias fotossintetizadoras,[1][2][3] diatomáceas[4] e dinoflagelados[5] para se referir vesículas ou plastos na célula com concentrações de pigmentos. Os mamíferos e aves, em vez de cromatóforos, possuem células chamadas melanócitos que lhes conferem cor.
Os cromatóforos são em grande medida responsáveis por gerar a cor da pele e dos olhos em animais ectotérmicos, e originam-se na crista neural durante o desenvolvimento embrionário. Os cromatóforos maduros podem ser divididos em subclasses segundo a cor que reflectem sob luz branca: xantóforos (amarelos), eritróforos (vermelhos), iridóforos (reflectivo/iridescentes), leucóforos (brancos), melanóforos (pretos/castanhos), e cianóforos (azuis).
Algumas espécies podem alterar rapidamente a cor por meio de mecanismos que translocam o pigmento e reorientam placas reflectoras nos cromatóforos. Este processo, muitas vezes utilizado como um mecanismo de camuflagem, recebe o nome mudança de cor fisiológica ou metacrose.[6] Os cefalópodes como o polvo possuem órgãos cromatóforos complexos controlados por músculos para mudar de cor, enquanto que os vertebrados como os camaleões produzem efeitos similares por sinalização celular. Estes sinais podem ser hormonas ou neurotransmissores e podem ser induzidos por mudanças no estado de ânimo, temperatura, stress ou alterações significativas do ambiente local.
Diferentemente dos animais ectotérmicos, os mamíferos e os pássaros apresentam apenas uma classe de células cromatóforas: os melanócitos. O seu equivalente nos animais ectotérmicos, os melanóforos, são estudados atualmente em laboratórios de investigação com o objetivo de contribuir para compreender certas doenças humanas, e são utilizados como ferramenta para a descoberta e desenvolvimento de novos fármacos.
Descoberta[editar | editar código-fonte]
Aristóteles mencionou a capacidade do polvo de alterar a cor para camuflagem e sinalização na sua Historia animalium (à cerca 400 a.C.):[7]
O polvo ... caça a sua presa alterando a sua cor para se tornar da cor das pedras que o rodeiam; fá-lo também quando está assustado.
Giosuè Sangiovanni foi o primeiro que descobriu as células de invertebrados que contém pigmentos dando-lhes o nome de "cromoforo" numa revista científica italiana em 1819.[8] No entanto, actualmente cromóforo tem outro significado.[9]
Charles Darwin descreveu a capacidade do choco de mudar de cor no seu The Voyage of the Beagle (1860):[10]
Estes animais também fogem da detecção a partir de um extraordinário poder de mudar de cor, parecido com o do camaleão. Parecem variar os seus tons de acordo com a natureza do terreno por onde passam: quando estão em águas profundas, o seu tom geral é púrpura acastanhado, mas quando se encontram em terra ou em águas pouco profundas, este tom escuro converte-se num verde amarelado. A cor, cuidadosamente examinada, seria um verde francês, com várias pintas amarelas brilhantes: a primeira destas variava em intensidade; a última desaparecia completamente e aparecia de novo alternadamente. Estas alterações eram feitas de tal modo que manchas de cor, que variavam de tonalidade entre a cor jacinto e o castanho, estavam continuamente atravessando o seu corpo. Qualquer parte, ao ser submetida a um ligeiro choque de galvanismo, tornava-se quase branca: um efeito similar, mas de menor grau, era produzido ao arranhar a pele com uma agulha. Estas manchas de cor, ou rubores como se lhes pode chamar, diz-se serem produzidos pela expansão e contracção alternada de diminutas vesículas que contêm fluídos de várias cores.
Classificação[editar | editar código-fonte]
O termo "cromatóforo" foi adoptado (a partir do precedente "cromóforo" utilizado pelo italiano G. Sangiovanni no século XIX[8]) para denominar as células portadoras de pigmentos derivadas da crista neural de vertebrados de sangue frio e cefalópodes. A própria palavra deriva das palavras gregas khrōma (χρωμα) que significa "cor", e phoros (φορος) que significa "portador".[11] Por outro lado, a própria palavra "cromatócito" é por vezes utilizada para as células responsáveis pela cor de mamíferos e aves, mas só está identificado um tipo de célula nestas classes de animais, o melanócito.[12]
A estrutura e coloração dos cromatóforos só foi estabelecida em finais da década de 1960, período em que foi possível desenvolver um sistema de classificação com base na aparência destes cromatóforos. O sistema de classificação daquela época permanece em vigor até hoje, embora estudos recentes sobre o tema tenham posto em evidência alguns aspectos da bioquímica dos pigmentos que podem ser úteis para compreender a sua função dentro da célula.[13]
As moléculas que produzem cor podem ser divididas em duas classes: biocromos e cores estruturais ou esquemocromos.[14] Os biocromos apresentam pigmentos autênticos, como por exemplo os carotenóides e pteridinas. Estes pigmentos absorvem seletivamente partes do espectro visível da luz (luzes de determinados comprimentos de onda) compostos de luz branca, ao mesmo tempo que permitem que outros comprimentos de onda atinjam o olho do observador, produzindo a sensação de cor. As cores estruturais são produzidas por combinações de difracção, reflexão ou dispersão da luz quando esta incide em estruturas com uma escala de aproximadamente um quarto do comprimento de onda da luz. Muitas destas estruturas interferem em alguns comprimentos de onda (cores) da luz visível e transmitem outros, simplesmente devido à sua escala, de modo que muitas vezes produzem iridescência, gerando diferentes cores conforme a posição de onde são observadas.[15][16] Muitos animais têm simultaneamente cores estruturais e cores pigmentárias (biocromos); por exemplo as penas do peru possuem melanina castanha mas também iridiscência.[17][18]
Embora todos os cromatóforos contenham pigmentos ou estruturas reflectoras (excepto quando são resultado de uma mutação, como o albinismo), nem todas as células que contêm pigmentos são cromatóforos. O grupo hemo da proteína hemoglobina, por exemplo, é um biocromo responsável pela cor vermelha do sangue (apesar de a sua função ser a de transportar oxigénio). Encontra-se fundamentalmente nos eritrócitos, que são células que se formam ao longo de toda a vida na medula óssea, e não apenas durante o desenvolvimento embrionário. Portanto, os eritrócitos são células pigmentadas que não se classificam como cromatóforos porque não têm origem nas células da crista neural.[19]

Xantóforos e eritróforos[editar | editar código-fonte]
Os cromatóforos que possuem grandes quantidades de pigmentos de pteridina amarelos são denominados xantóforos; e os que são principalmente carotenoides vermelhos ou laranjas são denominados eritróforos.[13] Em todo o caso, pode-se verificar que as vesículas que contêm estes pigmentos, pteridinas e carotenóides, podem encontrar-se dentro da mesma célula, e nesse caso a cor global depende da proporção dos pigmentos vermelhos e amarelos.[20] Portanto, a distinção entre estes dois tipos de cromatóforos nem sempre é clara.[21]
A maioria dos cromatóforos podem gerar pteridinas a partir da guanosina trifosfato, mas os xantóforos parecem ter vias bioquímicas suplementares que lhes permitem acumular pigmentos amarelos. Por outro lado, os carotenóides são metabolizados e transportados para os eritróforos. Isto foi demonstrado pela primeira vez com uma simples experiência, criando rãs por norma verdes com uma dieta restrita em caroteno à base de grilos. A ausência de caroteno na dieta das rãs resultou numa ausência de pigmentos de cor vermelha alaranjados do carotenóide nos seus eritróforos, provocando nas rãs uma aparência azul em vez de verde.[22]
Iridóforos e leucóforos[editar | editar código-fonte]
Os iridóforos, também denominados guanóforos, são pigmentos celulares que reflectem a luz utilizando placas cristalinas de quimiocromos formados a partir da guanina.[23] Quando estas placas são iluminadas, geram cores iridescentes por causa da difracção da luz nas placas amontoadas. A orientação dos esquemocromos determina a natureza da cor observada.[24] Ao utilizar biocromos como filtros coloridos, os iridóforos criam um efeito óptico conhecido como efeito Tyndall ou difusão de Rayleigh, produzindo cores brilhantes azuis ou verdes.[25]
Existem outros tipos de cromatóforos relacionados, os leucóforos, que podem ser encontrados nalguns peixes, especialmente no Tapetum lucidum. Tal como os iridóforos, os leucóforos utilizam purinas (geralmente guanina) cristalizadas para reflectir a luz. Diferentemente dos iridóforos, os leucóforos apresentam cristais mais organizados que reduzem a difracção. Quando recebem luz branca, produzem um brilho branco. Tal como ocorre com os xantóforos e eritróforos, nos peixes a distinção entre iridóforos e leucóforos nem sempre é evidente, mas, no geral, considera-se que os iridóforos produzem cores metálicas ou iridescentes, enquanto que os leucóforos geram reflexos de diferentes tons brancos.[25]
Melanóforos[editar | editar código-fonte]
Os melanóforos contêm eumelanina, um tipo de melanina de cor preta ou castanho fosco devido à sua significativa capacidade de absorção de luz. O pigmento está empaquetado em vesículas chamadas melanossomas, as quais se distribuem por todo o citoplasma celular. A eumelanina sintetiza-se a partir do aminoácido tirosina numa série de reacções de catálise químicas. É um complexo químico que contém unidades de dihidroxiindol e dihidroxiindol-2-ácido carboxílico com alguns anéis pirrólicos.[26] A enzima clave na síntese da melanina é a tirosinase. Assim que esta proteína se torna defectiva, a melanina não pode sintetizar-se o que desemboca diversos tipos de albinismo. Nalgumas espécies de anfíbios podem observar-se outros pigmentos diferentes junto com a eumelanina, como por exemplo, foi identificado um novo pigmento de cor vermelha escura nos melanóforos de rãs filomedusinas.[27] Posteriormente, este pigmento foi identificado como sendo pterorrodina, uma pteridina dímera que se acumula ao redor de um núcleo de eumelanina, e encontra-se também presente numa variedade de espécies de rãs arborícolas da Austrália e Papua-Nova Guiné. Embora seja provável que outras espécies menos estudadas tenham pigmentos melanóforos complexos, até ver tudo indica que a maioria dos melanóforos estudados contêm exclusivamente eumelanina.[28]

Os seres humanos possuem somente uma classe de células pigmentárias, que é o equivalente nos mamíferos aos melanóforos, responsável por gerar a cor da pele, pêlos e olhos, denominada melanócito. Por esta razão e por causa do grande número de cores diferentes que apresentam, fazendo com que geralmente sejam fáceis de visualizar, estes são de longe os cromatóforos mais amplamente estudados. Não obstante isso, existem diferenças entre a biologia dos melanóforos e a dos melanócitos. Para além da eumelanina, os melanócitos podem sintetizar pigmentos de cor avermelhada ou amarelada denominados feomelaninas.[29]
Cianóforos[editar | editar código-fonte]
Quase todos os azuis brilhantes nos animais e plantas são gerados por coloração estrutural em vez de pigmentos. Porém, alguns tipos de peixe-mandarim (Synchiropus splendidus) possuem vesículas de biocromo de cor cião cuja estrutura química se desconhece nas células denominadas cianóforos.[25] Apesar de parecerem incomuns pela sua limitada classe taxonómica, pode haver cianóforos (e outros tipos de cromatóforos raros) noutros peixes e anfíbios. Por exemplo, os cromatóforos de cores brilhantes, com pigmentos ainda não identificados, podem encontrar-se em rãs-dardo-venenosas e rãs-de-cristal,[30] e foram descobertos cromatóforos dicromáticos atípicos, denominados eritro-iridóforos no peixe Pseudochromis diadema.[31]
Translocação do pigmento[editar | editar código-fonte]

Muitas espécies podem deslocar o pigmento dentro dos seus cromatóforos, proporcionando alteração na cor dos seus corpos. Este processo, conhecido como troca de cor fisiológica, foi estudado mais intensivamente nos melanóforos, uma vez que a melanina é o pigmento mais escuro e visível. Na maioria das espécies com uma derme relativamente fina, os melanóforos dérmicos tendem a ser planos e a cobrir uma grande superfície. Não obstante isso, nos animais com camadas dérmicas espessas, como os répteis adultos, os melanóforos dérmicos normalmente formam unidades tridimensionais com outros cromatóforos. Estas unidades de cromatóforos dérmicos (UCD ou, em inglês, DCU) são constituídos por uma camada superior de xantóforos ou eritróforos, seguida de uma camada de iridóforos, e finalmente uma camada de melanóforos.[32]
Estes dois tipos de melanóforos são importantes no processo de alteração da cor fisiológica. Os melanóforos dérmicos planos normalmente cobrem outros cromatóforos, pelo que quando os pigmento se dispersam através da célula, a pele adquire uma aparência fosca. Do contrário, quando os pigmentos estão concentrados no centro da célula, os pigmentos dos cromatóforos que se encontram nas camadas inferiores estão expostos à luz, o que faz com que a pele adquira outras tonalidades. De modo similar, depois de a melanina se agregar em unidades de cromatóforos dérmicos (UDCs), a pele fica com aspecto esverdeado devido à filtração exercida pelos xantóforos (amarelos) da luz dispersa na camada de iridóforos. Com a difusão da melanina, a luz não se dispersa tanto e a pele torna-se escura. Tal como outros cromotóforos biocromáticos que são também capazes de deslocar pigmentos, os animais com vários tipos de cromatóforos podem gerar um conjunto espectacular de cores na sua pele ao tirar proveito do efeito divisional.[33][34]

O controlo e os mecanismos implicados nas rápidas translocações de pigmentos têm sido amplamente estudados em várias espécies, particularmente nos anfíbios e peixes teleósteos.[25][35] Foi demonstrado que esse processo pode ser regulado pelo baixo controlo hormonal ou neuronal ou por ambos. Entre os compostos neuroquímicos que se conhecem que deslocam os pigmentos estão a noradrenalina, por meio do seu receptor na superfície dos melanóforos.[36] As principais hormonas envolvidas na regulação da translocação parecem ser as melanocortinas, a melatonina e a hormona concentradora de melanina (MCH), as quais são produzidas principalmente na hipófise, glândula pineal e hipotálamo, respectivamente. Estas hormonas podem também ser geradas de modo parácrino por células da pele. Na superficie do melanóforo, as hormonas activam receptores acoplados à proteína G específicos que, por sua vez, transduzem o sinal ao interior da célula. As melanocortinas causam a dispersão dos pigmentos, enquanto que a melatonina e a MCH causam a sua agregação.[37]
Foram identificados numerosos receptores de melanocortina, MCH e melatonina em determinadas espécies de peixes[38] e rãs,[39] incluindo um homólogo do MC1R,[40] um receptor da melanocortina conhecido por regular o processo de coloração da pele e cabelo nos humanos.[41] Foi demonstrado que o MC1R é necessário no peixe-zebra para a difusão de melanina.[42] Por sua vez, no interior celular, constatou-se que o AMP cíclico (AMPc) é um importante segundo mensageiro na translocação pigmentária. Por meio de um mecanismo que ainda não é totalmente compreendido, o AMPc atua sobre outras enzimas como a proteína quinase A como a finalidade de activar motores moleculares que transportam as vesículas que contém pigmentos ao longo de microtúbulos e microfilamentos.[43][44][45]
Adaptação ao fundo[editar | editar código-fonte]
A maioria dos peixes, répteis e anfíbios são capazes de realizar limitadas alterações de cor fisiológicas em resposta à mudanças do ambiente em que se encontram. Este tipo de camuflagem, conhecido como adaptação ao fundo, manifesta-se normalmente com um tom ligeiramente mais escuro ou claro na pele cuja finalidade é imitar o tom do ambiente no qual o animal está localizado. O processo de adaptação ao fundo depende da visão (o animal precisa ver o aspecto do ambiente que o rodeia para adaptar-se a ele)[46] e a translocação da melanina nos melanóforos é o principal factor na alteração da cor.[37] Alguns animais, como os camaleões e as iguanídeos anolis, desenvolveram uma resposta de adaptação ao fundo, capaz de gerar muito rapidamente várias cores diferentes. Adaptaram a sua capacidade de mudar de cor como resposta a alterações de temperatura, estado de ânimo, níveis de stress e comportamentos sociais, e não simplesmente o imitar o aspecto do seu meio ambiente.[47]
Desenvolvimento[editar | editar código-fonte]

Durante o desenvolvimento embrionário de vertebrados, os cromatóforos pertencem a um dos tipos de células geradas na crista neural, um par de faixas de células incipientes que se originam nas margens do tubo neural. Estas células têm a capacidade de migrar a grandes distâncias, o que permite que os cromatóforos se estabeleçam em diferentes órgãos do corpo, como a pele, olhos, ouvidos e cérebro. Depois de abandonarem a crista neural em ondas, os cromatóforos apanham duas rotas possíveis: ou a rota dorsolateral através da derme, entrando no ectoderma através de pequenos orifícios na lâmina basal, ou a rota ventromedial entre os somitos e o tubo neural. Uma excepção a isto são os melanóforos do epitélio pigmentado da retina do olho, os quais não derivam da crista neural, mas de uma invaginação do tubo neural que gera a copa óptica, a qual, por sua vez, forma a retina.[48]
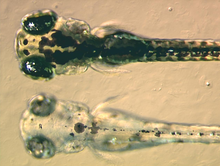
Actualmente é objeto de investigação quando e como as células multipotentes precursoras dos cromatóforos, denominadas cromatoblastos se desenvolvem nos seus diversos subtipos de células-filhas. Sabe-se que nos embriões do peixe-zebra, por exemplo, cerca de 3 dias depois da fertilização cada uma das classes de células que se encontram no peixe adulto — melanóforos, xantóforos e iridóforos — já estão presentes. Estudos realizados com peixes mutantes terão demonstrado que certos factores de transcrição como o kit, sox10 e mitf são fundamentais no controlo da diferenciação dos cromatóforos.[49] Quando estes genes são defeituosos, os cromatóforos podem estar parcialmente ou totalmente ausentes, o que dá origem a transtornos leucísticos.[50][51]
Aplicações práticas[editar | editar código-fonte]
Para além da pesquisa básica feita para obter uma melhor compreensão dos cromatóforos, têm sido procuradas diversas utilidades para estas células. Por exemplo, as larvas dos peixes-zebra são atualmente utilizadas para estudar como os cromatóforos se organizam e se comunicam para gerar com precisão o típico padrão de bandas horizontais regular que pode ser observado nos peixes adultos.[52] Estas têm sido extremamente úteis para alcançar um sistema modelo e compreender a formação de padrões no campo da biologia evolutiva do desenvolvimento. A biologia dos cromatóforos também tem sido utilizada como modelo de certas doenças humanas, como no caso do melanoma e do albinismo. Recentemente, constatou-se que as variações de pigmentação mais claras, tanto nos seres humanos como na variedade "dourada" do peixe-zebra, deve-se a um menor número, tamanho e densidade dos melanossomas, os organelos pigmentados dos melanócitos. Tal característica está associada a um gene que codifica um permutador de catiões localizado numa membrana intracelular denominado Slc24a5.[53] O gene ortólogo em humanos apresenta dois alelos principais, os quais diferem num único nucleótido que determina uma troca de alanina para treonina na posição 111 da proteína. O alelo ancestral que conduz a alanina foi achado em cerca de 93-100% das amostras de africanos, asiáticos do leste e populações originárias da América. Por outro lado, o alelo que transporta a treonina, que teve origem entre 6 000 e 12 000 anos atrás e que está associado à pigmentação mais clara, está presente em 98,7% - 100% das amostras colhidas das populações europeias.[54] Portanto, as variações neste gene, que se encontra no cromossoma 15 do genoma humano, explicariam as diferenças na coloração da pele da nossa espécie.[55]
Os cromatóforos são também utilizados como biomarcadores de cegueira em espécies de ectotérmicas, uma vez que os animais com determinados defeitos visuais são incapazes de se adaptar ao fundo de sitio iluminado onde vivem.[46] Pensa-se que os receptores homólogos em humanos que mediam a translocação pigmentária nos melanóforos, estão implicados em processos como a perda de apetite e bronzeado solar, o que os torna possíveis alvos na busca de fármacos.[40] Por isso, as companhias farmacêuticas desenvolveram uma ensaio biológico para identificar rapidamente potenciais compostos bioativos utilizando os melanóforos do anfíbio Xenopus laevis.[56] Outros cientistas desenvolveram técnicas para utilizar os melanóforos como biossensores,[57] e para a deteccão rápida de doenças (baseada no descoberta de que a toxina produzida pela bactéria Bordetella pertussis bloqueia a agregação de pigmentos nos melanóforos dos peixes).[58] Foi ainda propostas potenciais aplicações dos cromatóforos no campo militar, no qual poderiam ser utilizados para rápidas mudanças de cor e, principalmente como um tipo de camuflagem activa, que poderia tornar objectos quase invisíveis, tal como fazem os chocos.[59][60]
Cromatóforos de cefalópodes[editar | editar código-fonte]

Os cefalópodes da subclasse dos Coleoidea (entre os quais se incluem os polvos, lulas e chocos) apresentam complexos órgãos multicelulares que utilizam para alterar a cor rapidamente, produzindo uma ampla variedade de cores brilhantes e padrões. Cada unidade cromatófora está composta por uma única célula cromatófora e numerosos músculos, nervos, células da glia, e células da bainha.[61] No interior da célula cromatófora, os grânulos de pigmentos encontram-se fechados dentro dum saco elástico, chamado cytoelastic sacculus. Para modificar a cor, o animal distorce a forma ou tamanho do sáculo por contracção muscular, alterando o seu grau de transparência, reflectividade ou opacidade. Este mecanismo é diferente do utilizado pelos peixes, anfíbios e répteis porque a forma do sáculo altera, em vez de se produzir uma translocação de pigmentos no interior da célula. Não obstante isso, o efeito conseguido é muito parecido.[62][63][64]
Os polvos podem fazer funcionar os seus cromatóforos em complexas exibições cromáticas em forma de ondas, que dão lugar a uma variedade de esquemas de cor que alteram rapidamente. Acredita-se que os nervos que controlam os cromatóforos situam-se no cérebro num padrão semelhante ao dos cromatóforos que controlam. Isto significa que o padrão de alteração da cor está de acordo com os padrões de activação neuronal. Isto pode explicar por que, quando os neurónios são activados uns após outros, a alteração da cor é produzida na forma de ondas.[65] Tal como nos camaleões, os cefalópodes utilizam as alterações da cor fisiológicas como meio de interacção social. Ademais, estão também entre os que possuem maior habilidade para se adaptarem ao fundo, visto terem a capacidade de imitar tanto a cor como a textura do seu ambiente local com enorme precisão.[66]
Bactérias e algas[editar | editar código-fonte]
O termo cromatóforo pode também ser utilizado para se referir a certas partes coloridas de bactérias e, por vezes, de algumas algas como os dinoflagelados.[67] Nas membranas das bactérias fototróficas encontram-se cromatóforos, utilizados essencialmente para a executar a fotossíntese e são compostos por pigmentos de bacterioclorofilas e carotenoides.[68] Nas bactérias púrpuras, como a Rhodospirillum rubrum, as proteínas que captam a luz são proteínas intrínsecas das membranas do cromatóforo. Porém, nas bactérias verdes sulfurosas, encontram-se dispostos em complexos-antena especializados chamados clorossomas.[69]
Ver também[editar | editar código-fonte]
Referências
- ↑ Nas bactérias fotossintetizadoras os cromatóforos são vesículas de cor associadas à membrana e nas quais se realiza a fotossíntese.
- ↑ Lascelles, Junho (1962). J. gen. Microbiology, ed. «The Chromatophores of Photosynthetic Bacteria». Grã Bretanha
- ↑ Salton, MR (1987). «Bacterial membrane proteins» 4 ed. Microbiological sciences. 4: 100–5. PMID 3153178
- ↑ Werner, Dietrich (1977). The Biology of Diatoms. [S.l.]: University of California Press. ISBN 978-0-520-03400-6
- ↑ Tait, R. V. (22 de outubro de 2013). Elements of Marine Ecology: An Introductory Course. [S.l.]: Elsevier. ISBN 978-1-4831-4188-6
- ↑ Scott M. Boback & Lynn M. Siefferman (2010). «Variation in Color and Color Change in Island and Mainland Boas (Boa constrictor)». Journal of Herpetology. 44 (4): 506–515. doi:10.1670/09-026.1
- ↑ Aristotle. Historia Animalium. IX, 622a: 2-10. About 400 BC. Cited in Luciana Borrelli, Francesca Gherardi, Graziano Fiorito. A catalogue of body patterning in Cephalopoda. Firenze University Press, 2006. Abstract Google books
- ↑ a b Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9:1–13.
- ↑ «Chromophore». IUPAC Gold Book. Consultado em 10 de março de 2016
- ↑ Darwin, Charles (1860). «Chapter 1. Habits of a Sea-slug and Cuttle-fish». Journal Of Researches Into The Natural History And Geology Of The Countries Visited During The Voyage Round The World Of H.M.S. 'Beagle' Under The Command Of Captain Fitz Roy, R.N. [S.l.]: John Murray, London. p. 7
- ↑ «Chromatophore». Online Etymology Dictionary. Consultado em 10 de março de 2016
- ↑ Lapedriza, Alberto; Petratou, Kleio; Kelsh, Robert N. «14. Neural Crest Cells and Pigmentation». In: Paul Trainor. Neural Crest Cells: Evolution, Development and Disease. [S.l.]: Academic Press. 288 páginas. ISBN 9780124017306
- ↑ a b Bagnara, JT (1966). «Cytology and cytophysiology of non-melanophore pigment cells». International Review of Cytology. International Review of Cytology. 20: 173–205. ISBN 978-0-12-364320-9. PMID 5337298. doi:10.1016/S0074-7696(08)60801-3
- ↑ Fox, DL. Animal Biochromes and Structural Colors: Physical, Chemical, Distributional & Physiological Features of Colored Bodies in the Animal World. University of California Press, Berkeley, 1976. ISBN 0-520-02347-1
- ↑ «Iridescence in Lepidoptera». Photonics in Nature (originally in Physics Review). University of Exeter. Setembro de 1998. Consultado em 27 de abril de 2012. Arquivado do original em 19 de novembro de 2015
- ↑ Wallin, Margareta (2002). «Nature's Palette: How animals, including humans, produce colours» (PDF). Bioscience explained. 1 (2): 1–12. Consultado em 17 de novembro de 2011
- ↑ Smyth, S.; et al. (2007). «What Makes the Peacock Feather Colorful?» (PDF). NNIN REU Journal)
- ↑ Smyth, S. (2009). «What Makes the Peacock Feather Bright and Colorful». University of Alaska, Fairbanks (Honors Thesis). Consultado em 9 de março de 2016. Arquivado do original em 4 de março de 2016
- ↑ Masato Kinoshita, Kenji Murata, Kiyoshi Naruse, Minoru Tanaka. Medaka: Biology, Management, and Experimental Protocols. Google books. Página 119. [1]
- ↑ Matsumoto, J (1965). «Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri, with special reference to their pigment granules (pterinosomes)». J Cell Biol. 27 (3): 493–504. PMC 2106771
 . PMID 5885426. doi:10.1083/jcb.27.3.493
. PMID 5885426. doi:10.1083/jcb.27.3.493 - ↑ Parker, George Howard. «Color Changes in Vertebrates». Animal Colour Changes and Their Neurohumours. [S.l.]: Cambridge University Press. p. 116
- ↑ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues. In: The Pigmentary System: Physiology and Pathophysiology, Oxford University Press, 1998. ISBN 0-19-509861-7
- ↑ Taylor, JD. (1969). «The effects of intermedin on the ultrastructure of amphibian iridophores». Gen Comp Endocrinol. 12 (3): 405–16. PMID 5769930. doi:10.1016/0016-6480(69)90157-9
- ↑ Morrison, RL. (1995). «A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores». Pigment Cell Res. 8 (1): 28–36. PMID 7792252. doi:10.1111/j.1600-0749.1995.tb00771.x
- ↑ a b c d Fujii, R. (2000). «The regulation of motile activity in fish chromatophores». Pigment Cell Res. 13 (5): 300–19. PMID 11041206. doi:10.1034/j.1600-0749.2000.130502.x
- ↑ Ito, S; Wakamatsu, K. (2003). «Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review». Pigment Cell Res. 16 (5): 523–31. PMID 12950732. doi:10.1034/j.1600-0749.2003.00072.x
- ↑ Bagnara, J.T.; Taylor, JD; Prota, G (1973). «Color changes, unusual melanosomes, and a new pigment from leaf frogs». Science. 182 (4116): 1034–5. PMID 4748673. doi:10.1126/science.182.4116.1034
- ↑ Bagnara, J.T. (2003). «Enigmas of Pterorhodin, a Red Melanosomal Pigment of Tree Frogs». Pigment Cell Research. 16 (5): 510–516. PMID 12950730. doi:10.1034/j.1600-0749.2003.00075.x
- ↑ Hunt G, Kyne S, Ito S, Wakamatsu K, Todd C, Thody A. Eumelanin and phaeomelanin contents of human epidermis and cultured melanocytes. Pigment Cell Res. 1995 Aug;8(4):202-8. PMID 8610071.
- ↑ Schwalm, PA; Starrett, PH; McDiarmid, RW (1977). «Infrared reflectance in leaf-sitting neotropical frogs». Science. 196 (4295): 1225–7. PMID 860137. doi:10.1126/science.860137
- ↑ Goda M, Ohata M, Ikoma H, Fujiyoshi Y, Sugimoto M, Fujii R (2011). «Integumental reddish-violet coloration owing to novel dichromatic chromatophores in the teleost fish, Pseudochromis diadema». Pigment Cell Melanoma Res. 24 (4): 614–7. PMID 21501419. doi:10.1111/j.1755-148X.2011.00861.x
- ↑ Bagnara, JT; Taylor, JD; Hadley, ME (1968). «The dermal chromatophore unit». J Cell Biol. 38 (1): 67–79. PMC 2107474
 . PMID 5691979. doi:10.1083/jcb.38.1.67
. PMID 5691979. doi:10.1083/jcb.38.1.67 - ↑ Palazzo, RE; Lynch, TJ; Lo, SJ; Taylor, JD; Tchen, TT (1989). «Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores». Cell Motil Cytoskeleton. 13 (1): 9–20. PMID 2543509. doi:10.1002/cm.970130103
- ↑ Porras, MG; De Loof, A; Breuer, M; Aréchiga, H (2003). «Procambarus clarkii». Peptides. 24 (10): 1581–9. PMID 14706537. doi:10.1016/j.peptides.2003.08.016
- ↑ Deacon, SW; Serpinskaya, AS; Vaughan, PS; Lopez Fanarraga, M; Vernos, I; Vaughan, KT; Gelfand, VI (2003). «Dynactin is required for bidirectional organelle transport». The Journal of Cell Biology. 160 (3): 297–301. PMC 2172679
 . PMID 12551954. doi:10.1083/jcb.200210066
. PMID 12551954. doi:10.1083/jcb.200210066 - ↑ Aspengren, S; Sköld, HN; Quiroga, G; Mårtensson, L; Wallin, M (2003). «Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores». Pigment Cell Res. 16 (1): 59–64. PMID 12519126. doi:10.1034/j.1600-0749.2003.00003.x
- ↑ a b Logan, D. W.; Burn, SF; Jackson, IJ (2006). «Regulation of pigmentation in zebrafish melanophores». Pigment Cell Research. 19 (3): 206–213. PMID 16704454. doi:10.1111/j.1600-0749.2006.00307.x
- ↑ Logan, DW; Bryson-Richardson, RJ; Taylor, MS; Currie, P; Jackson, IJ (2003). «Sequence characterization of teleost fish melanocortin receptors». Ann N Y Acad Sci. 994: 319–30. PMID 12851332. doi:10.1111/j.1749-6632.2003.tb03196.x
- ↑ Sugden, D; Davidson, K; Hough, KA; Teh, MT (2004). «Melatonin, melatonin receptors and melanophores: a moving story». Pigment Cell Res. 17 (5): 454–60. PMID 15357831. doi:10.1111/j.1600-0749.2004.00185.x
- ↑ a b Logan, DW; Bryson-Richardson, RJ; Pagán, KE; Taylor, MS; Currie, PD; Jackson, IJ (2003). «The structure and evolution of the melanocortin and MCH receptors in fish and mammals». Genomics. 81 (2): 184–91. PMID 12620396. doi:10.1016/S0888-7543(02)00037-X
- ↑ Valverde, P; Healy, E; Jackson, I; Rees, JL; Thody, AJ (1995). «Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans». Nat Genet. 11 (3): 328–30. PMID 7581459. doi:10.1038/ng1195-328
- ↑ Richardson, J; Lundegaard, PR; Reynolds, NL; Dorin, JR; Porteous, DJ; Jackson, IJ; Patton, EE (2008). «mc1r Pathway regulation of zebrafish melanosome dispersion». Zebrafish. 5 (4): 289–95. PMID 19133827. doi:10.1089/zeb.2008.0541
- ↑ Snider, J; Lin, F; Zahedi, N; Rodionov, V; Yu, CC; Gross, SP (2004). «Intracellular actin-based transport: How far you go depends on how often you switch». Proceedings of the National Academy of Sciences of the United States of America. 101 (36): 13204–9. PMC 516548
 . PMID 15331778. doi:10.1073/pnas.0403092101
. PMID 15331778. doi:10.1073/pnas.0403092101 - ↑ Rodionov, VI; Hope, AJ; Svitkina, TM; Borisy, GG (1998). «Functional coordination of microtubule-based and actin-based motility in melanophores». Current biology : CB. 8 (3): 165–8. PMID 9443917. doi:10.1016/S0960-9822(98)70064-8
- ↑ Kashina, AS; Semenova, IV; Ivanov, PA; Potekhina, ES; Zaliapin, I; Rodionov, VI (2004). «Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles». Current biology : CB. 14 (20): 1877–81. PMID 15498498. doi:10.1016/j.cub.2004.10.003
- ↑ a b Neuhauss, SC. (2003). «Behavioral genetic approaches to visual system development and function in zebrafish». J Neurobiol. 54 (1): 148–60. PMID 12486702. doi:10.1002/neu.10165[ligação inativa]
- ↑ Stuart-Fox, D.; Moussalli, A. (2008). «Selection for Social Signalling Drives the Evolution of Chameleon Colour Change». PLoS Biology. 6 (1): e25. PMC 2214820
 . PMID 18232740. doi:10.1371/journal.pbio.0060025
. PMID 18232740. doi:10.1371/journal.pbio.0060025 - ↑ Jan Borovansky, Patrick A. Riley (2011). Melanins and Melanosomes: Biosynthesis, Structure, Physiological and Pathological Functions (em inglês). [S.l.]: John Wiley & Sons. p. 45. 407 páginas. ISBN 3527328920. Consultado em 10 de março de 2016
- ↑ Kelsh, RN; Schmid, B; Eisen, JS (2000). «Genetic analysis of melanophore development in zebrafish embryos». Dev Biol. 225 (2): 277–93. PMID 10985850. doi:10.1006/dbio.2000.9840
- ↑ «Coat colour, dominant white». Online Mendelian Inheritance in Animals. Consultado em 10 de março de 2016
- ↑ Ichiro Yajima; Shigeru Sato; Takaharu Kimura; Ken-ichi Yasumoto; Shigeki Shibahara; Colin R. Goding; Hiroaki Yamamoto (1999). «An L1 Element Intronic Insertion in the Black-Eyed White (Mitfmi-bw) Gene: The Loss of a Single Mitf Isoform Responsible for the Pigmentary Defect and Inner Ear Deafness». Hum. Mol. Genet. 8 (8): 1431-1441. doi:10.1093/hmg/8.8.1431
- ↑ Kelsh, RN (2004). «Genetics and evolution of pigment patterns in fish». Pigment cell research / sponsored by the European Society for Pigment Cell Research and the International Pigment Cell Society. 17 (4): 326–36. PMID 15250934. doi:10.1111/j.1600-0749.2004.00174.x
- ↑ Lamason, RL; Mohideen, MA; Mest, JR; Wong, AC; Norton, HL; Aros, MC; Jurynec, MJ; Mao, X; et al. (2005). «SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans». Science. 310 (5755): 1782–6. PMID 16357253. doi:10.1126/science.1116238
- ↑ Peen State University: fish gene sheds light on human skin color variation.[2] Arquivado em 21 de julho de 2010, no Wayback Machine.
- ↑ Gibbons A (2007). «American Association of Physical Anthropologists meeting. European skin turned pale only recently, gene suggests». Science. 316 (5823). 364 páginas. PMID 17446367. doi:10.1126/science.316.5823.364a
- ↑ Jayawickreme, CK; Sauls, H; Bolio, N; Ruan, J; Moyer, M; Burkhart, W; Marron, B; Rimele, T; Shaffer, J (1999). «Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library». J Pharmacol Toxicol Methods. 42 (4): 189–97. PMID 11033434. doi:10.1016/S1056-8719(00)00083-6
- ↑ Andersson, TP; Filippini, D; Suska, A; Johansson, TL; Svensson, SP; Lundström, I (2005). «Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing». Biosens Bioelectron. 21 (1): 111–20. PMID 15967358. doi:10.1016/j.bios.2004.08.043
- ↑ Karlsson, JO; Andersson, RG; Askelöf, P; Elwing, H; Granström, M; Grundström, N; Lundström, I; Ohman, L (1991). «The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough». FEMS Microbiol Lett. 66 (2): 169–75. PMID 1936946
- ↑ Hansford, Dave (6 de agosto de 2008). «Cuttlefish Change Color, Shape-Shift to Elude Predators». National Geographic News. Wellington, New Zealand.
[...] os chocos pelo contrário confiram na invisibilidade, um talento que pode ter aplicações na tecnologia humana. Norman diz que os militares mostraram interesse na camuflagem dos chocos com vista a um dia incorporar mecanismos similares nos uniformes dos soldados.
- ↑ Lee I. Nanotubes for noisy signal processing PhD Thesis. 2005; University of Southern California.
- ↑ Cloney, RA; Florey, E (1968). «Ultrastructure of cephalopod chromatophore organs». Zeitschrift fur Zellforschung und mikroskopische Anatomie (Vienna, Austria: 1948). 89 (2): 250–80. PMID 5700268. doi:10.1007/BF00347297
- ↑ Universidade da CalifórniaZeitschrift fuer zellforschung und mikroskopische anatomie. 145. 1973. ISSN 0301-5564
- ↑ Clifford Ladd Prosser, ed. (1973). Comparative Animal Physiology: Sensory, effector, and integrative physiology. [S.l.]: W. B. Saunders. p. 916. 966 páginas. ISBN 072167383X
- ↑ Mollusca, Cephalopoda (em espanhol). [S.l.]: Editorial CSIC - CSIC Press. 1992. p. 51-52. 327 páginas. ISBN 8400072677
- ↑ Demski, LS (1992). «Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems». Brain, behavior and evolution. 40 (2–3): 141–56. PMID 1422807. doi:10.1159/000113909
- ↑ Marion Nixon; J.Z. Young (2003). The brains and lives of cephalopods. Nova Iorque: Oxford University Press. ISBN 0-19-852761-6
- ↑ W. A. S. Sarjeant. Fossil and Living Dinoflagellates. Página 23. Google books. [3]
- ↑ Salton, MR (1987). «Bacterial membrane proteins». Microbiological sciences. 4 (4): 100–5. PMID 3153178
- ↑ Frigaard, NU; Bryant, DA (2004). «Seeing green bacteria in a new light: genomics-enabled studies of the photosynthetic apparatus in green sulfur bacteria and filamentous anoxygenic phototrophic bacteria». Archives of Microbiology. 182 (4): 265–76. PMID 15340781. doi:10.1007/s00203-004-0718-9
Ligações externas[editar | editar código-fonte]
- Nature's Palette - Como os animais produzem cor 1,20 MB
- Vídeo da adaptação do polvo ao fundo
- Vídeo sobre o padrão de cromatóforos das lulas
- Tree of Life Web Project: Cephalopod Chromatophores


 French
French Deutsch
Deutsch