Resistência antibiótica – Wikipédia, a enciclopédia livre

A resistência antibiótica, resistência a antibióticos ou resistência antimicrobiana é a capacidade de um micróbio ou bactérias de resistir aos efeitos da medicação anteriormente utilizada para tratá-los, como antibióticos.[2][3][4] A resistência surge através de uma das três maneiras seguintes: resistência natural em certos tipos de bactérias; mutação genética ou por uma espécie que adquire resistência de outra.[5] A resistência pode aparecer espontaneamente por mutações aleatórias; ou mais comumente após o acúmulo gradual ao longo do tempo e devido ao mau uso de antibióticos ou antimicrobianos.[6] Os micróbios resistentes são cada vez mais difíceis de tratar, exigindo doses mais elevadas ou medicamentos alternativos, que podem ser mais caros ou mais tóxicos. Os micróbios resistentes a múltiplos antimicrobianos são chamados de "resistente a múltiplos medicamentos" (RMM); ou às vezes superbactéria.[7] A resistência antimicrobiana está a aumentar com milhões de mortes a cada ano.[8] Todas as classes de micróbios desenvolvem resistência: os fungos desenvolvem resistência antifúngica, os vírus desenvolvem resistência antiviral, os protozoários desenvolvem resistência antiprotozoária e as bactérias desenvolvem resistência aos antibióticos.
Os antibióticos só devem ser utilizados quando necessário, conforme prescrito pelos profissionais da saúde.[9] O prescritor deve aderir aos cinco direitos da administração de medicamentos: o direito do paciente, o medicamento certo, a dose certa, a via correta e o tempo adequado.[10] Os antibióticos de espectro estreito são preferidos, quando possível,em relação aos antibióticos de amplo espectro, uma vez que a alocação efetiva e precisa de organismos específicos torna a resistência menos provável.[11] Os medicamentos devem ser tomados antes do tratamento quando indicado e o tratamento pode mudar de acordo com o relatório de susceptibilidade.[12][13] Para as pessoas que tomam esses medicamentos em casa, a educação sobre o uso adequado é essencial. Os prestadores de assistência médica podem minimizar a propagação de infecções resistentes pelo uso de saneamento e higiene adequados (como a lavagem das mãos e a desinfecção) e devem encorajar o mesmo entre os pacientes, visitantes e membros da família.[12]
O aumento da resistência aos medicamentos é causada principalmente pelo uso indevido de antimicrobianos em seres humanos, bem como em animais, e pela disseminação de cepas resistentes entre os dois.[6] Os antibióticos aumentam a pressão seletiva nas populações bacterianas, causando a morte de bactérias vulneráveis; isto aumenta a porcentagem de bactérias resistentes que continuam crescendo. Com a resistência aos antibióticos tornando-se mais comum, há uma maior necessidade de tratamentos alternativos. Pedidos de novas terapias com antibióticos foram emitidos, mas o desenvolvimento de novos medicamentos está se tornando mais raro.[14]
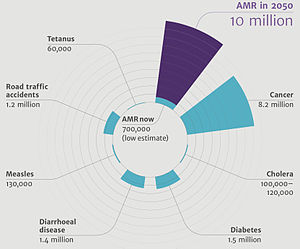
Um relatório da Organização Mundial de Saúde (OMS) divulgado em abril de 2014 afirmou: "esta ameaça séria não é mais uma previsão para o futuro, está acontecendo agora em todas as regiões do mundo e tem o potencial de afetar qualquer pessoa, de qualquer idade, em qualquer país. A resistência aos antibióticos - quando as bactérias mudam, de modo que os antibióticos já não funcionam em pessoas que precisam delas para tratar infecções - agora é uma grande ameaça para a saúde pública".[15] O aumento das chamadas públicas para ação coletiva global para enfrentar esta ameaça inclui propostas para tratados internacionais sobre resistência antimicrobiana.[16] A resistência mundial aos antibióticos não está totalmente mapeada, mas os países mais pobres com sistemas de saúde deficientes são os mais afetados.[9] De acordo com os Centros de Controle e Prevenção de Doenças: "Anualmente nos Estados Unidos, ao menos 2 milhões de pessoas ficam infectadas com bactérias resistentes a antibióticos e pelo menos 23 mil pessoas morrem todos os anos como resultado direto dessas infecções".[17] Existem múltiplos programas de monitoramento nacionais e internacionais sobre ameaças resistentes a medicamentos, como o Staphylococcus aureus resistente à meticilina (MRSA), a betalactamase de espectro estendido (ESBL) e a Acinetobacter baumannii multirresistente (MRAB).[18]
Definição[editar | editar código-fonte]
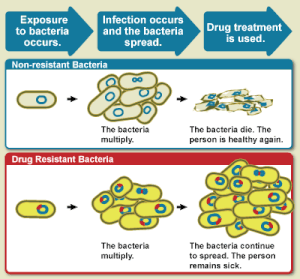
A OMS define a resistência anti-microbiana como uma resistência do microorganismo ao medicamento anti-microbiano que antes servia para tratar eficazmente a infecção por esse microorganismo.[3] Uma pessoa não pode tornar-se resistente aos antibióticos, uma vez que a resistência é uma propriedade do micróbio que infecta essa pessoa.[20]
Causas[editar | editar código-fonte]

As bactérias com resistência aos antibióticos são anteriores ao uso médico de antibióticos por humanos;[21][22] no entanto, o uso generalizado destes medicamentos tornou mais bactérias resistentes através do processo de pressão seletiva.[23][24]
Entre as razões para o uso generalizado de antibióticos estão:
- aumento da disponibilidade global ao longo do tempo desde a década de 1950
- venda descontrolada em muitos países de renda baixa ou média, onde podem ser obtidos sem receita médica, o que pode resultar em uso de antibióticos quando não há necessidade.[25] Isto pode resultar no desenvolvimento da resistência em qualquer bactéria restante.
O uso de antibióticos em alimentos para animais com baixas doses para promoção do crescimento é uma prática aceita em muitos países industrializados e é conhecido por levar a níveis aumentados de resistência.[26][27] Liberar grandes quantidades de antibióticos no meio ambiente durante a fabricação de produtos farmacêuticos através de um tratamento inadequado de águas residuais também aumenta o risco de desenvolver e espalhar cepas resistentes a antibióticos.[28][29] Não é certo se antibacterianos em sabões e outros produtos contribuem para a resistência aos antibióticos, mas são desencorajados por outros motivos.[30][31]
Medicina humana[editar | editar código-fonte]
O aumento da resistência bacteriana está relacionado com o volume de antibióticos prescrito, e com o facto de não se seguir exactamente as instruções da prescrição (não seguir o tratamento até o final).[32] As prescrições inadequadas de antibióticos atribuem-se a várias causas, incluindo quando os pacientes fazem questão de solicitar ao médico a sua prescrição, com os médicos que os prescrevem quando não têm tempo de explicar por que não são necessários, ou porque os prescrevem por cautela e por razões médicas ou legais.[33]
Considera-se que metade dos antibióticos usados em humanos são desnecessários e inapropriados.[6][6] Por exemplo, segundo o resultado de um estudo, um terço das pessoas acha que os antibióticos são efectivos contra o catarro comum,[34] e os catarros são uma das razões comuns para prescrever antibióticos[35] apesar de ser uma doença vírica e os antibióticos serem inúteis contra os vírus.[36][37]
A resistência a antibióticos aumenta com a duração do tratamento; portanto, contando que se mantenha o mínimo efectivo, é provável que os tratamentos curtos com antibióticos diminuam as taxas de resistência, reduzam os custos, e tenham melhores resultados e menores complicações.[11] Há tratamentos curtos para a pneumonia adquirida na comunidade[38] peritonite bacteriana espontânea,[39] infecções pulmonares em cuidados intensivos,[40] o denominado abdómen agudo,[41] infecções do ouvido médio, sinusite e infecções de garganta,[42] e lesões intestinais penetrantes.[43][44] Nalgumas situações um tratamento curto pode não curar a infecção mas um tratamento mais longo também pode não resultar.[45][46] Como o paciente pode sentir-se melhor antes de que a infecção seja erradicada, os médicos podem dar-lhe instruções para que saiba quando é seguro deixar de tomá-los. Alguns investigadores advogam para que os médicos usem tratamentos curtos com antibióticos, e reavaliem o paciente uns dias depois, e parem o tratamento caso já não houver sintomas da infecção.[47]
Algumas classes de antibióticos originam mais resistência do que outras. Por exemplo, observam-se maiores taxas de infecções por SARM quando se usam glicopeptídeos, cefalosporinas, e quinolonas.[48][49] As cefalosporinas e especialmente as quinolonas e a clindamicina, é mais provável que facilitem a colonização por Clostridium difficile.[50][51]
Determinados factores tido em unidades de cuidados intensivos como a aplicação de ventilação mecânica e múltiplas doenças subjacentes também parecem contribuir para a resistência bacteriana assim que se utilizam antibióticos.[52] A proliferação de organismos resistentes está associada a uma má higiene do pessoal do hospital.[53][54]
Os factores sociais, como a violência estrutural ou pobreza em algumas regiões afectam os programas de tratamento de cepas resistentes.[55]
Prevenção[editar | editar código-fonte]
Os programas de administração de antibióticos parecem úteis na redução das taxas de resistência a antibióticos..[56]
Em 2014, a Organização Mundial da Saúde (OMS) afirmou:[15]
As pessoas podem ajudar a enfrentar a resistência antibiótica ao:
- usar antibióticos apenas quando prescrito por um médico;
- completar toda prescrição médica, mesmo que se sinta melhor;
- nunca compartilhar antibióticos com outros ou usar prescrições antigas.
Trabalhadores de saúde e farmacêuticos podem ajudar a enfrentar a resistência ao:
- reforçar a prevenção e o controle de infecções;
- apenas prescrever e dispensar antibióticos quando são realmente necessários;
- prescrever e dispensar o(s) antibiótico(s) certo(s) para tratar a doença.
Os políticos podem ajudar a enfrentar a resistência ao:
- reforçar o rastreamento da resistência e da capacidade do laboratório;
- regular e promover o uso adequado de medicamentos.
Os formuladores de políticas públicas e a indústria podem ajudar a enfrentar a resistência ao:
- promover a inovação e pesquisa e desenvolvimento de novas ferramentas médicas;
- promover a cooperação e o compartilhamento de informações entre todas as partes interessadas.
Superbactérias[editar | editar código-fonte]
As bactérias KPC, superbactérias ou bactérias super-resistentes a antibióticos são um fenômeno recente, observado em pacientes que viajaram ao sul da Ásia para fazerem cirurgias plásticas e retornaram a seus países. O primeiro estudo foi publicado em 2009, na revista médica The Lancet e se refere ao gene NDM-1, encontrado até o momento nas bactérias Klebsiella pneumoniae e Escherichia coli, que causam, respectivamente, pneumonia e infecção urinária. Esse gene produz resistência até aos antibióticos da classe das carbapenemas e pode levar a uma preocupante pandemia em futuro próximo.
Segundo os cientistas da Universidade de Madras, as novas bactérias chegaram à Grã-Bretanha trazidas por pacientes que viajaram à Índia ou ao Paquistão para realizarem tratamentos cosméticos. Ao acompanharem pacientes com sintomas suspeitos, eles encontraram 44 casos (1,5% dos investigados) em Chennai e 26 (8%) em Haryana, na Índia. Eles também detectaram a superbactéria em Bangladesh e no Paquistão, bem como em 37 casos na Grã-Bretanha. Os únicos antibióticos efetivos foram a tigeciclina e a colistina.[58]
Os pesquisadores[59] alertam que o gene se instala nos plasmídeos, estruturas de DNA que podem facilmente ser copiadas e transmitidas para diversos outros tipos de bactéria. "Isso sugere uma alarmante possibilidade de o gene se espalhar e modificar toda a população de bactérias", disse ao Correio Braziliense Timothy Walsh, médico descobridor do gene. A mutação foi causada pelo uso excessivo de antibióticos e devido à falta de grandes cuidados higiênicos nos países citados.
O gene já foi detectado também na Austrália[60] no Brasil e em Portugal,[61] onde a notificação compulsória foi instituída em outubro, sempre que a investigação de bactérias resistentes aos carbapenemos revelar a enzima NDM-1.[62] Até o momento, há casos relatados no Brasil,[63] mas as autoridades médicas afirmam que ainda não se classifica a moléstia como Emergência de Saúde Pública de Importância Internacional, classificação definida pelo Regulamento Sanitário Internacional (RSI 2005) para medidas contra novos agentes infecciosos. Autoridades da Índia protestaram contra a insinuação de que o país não é seguro para cirurgias.[64] Por causa[65] do turismo médico e das viagens internacionais, e devido à baixa expectativa de novos antibióticos, a bactéria pode se tornar grave problema de saúde pública no mundo todo.
O fenômeno da resistência bacteriana é antigo e decorre[66] de uso indiscriminado de antibióticos e de má higienização nos hospitais. A diferença é que desta vez a resistência chegou ao nível em que nenhum antibiótico surte efeito contra as bactérias. Nas palavras[67] do médico David Livermore, da Agência Britânica para a Proteção de Saúde:
Se isto for ignorado, o nosso receio é que a resistência comece a se propagar por outras bactérias no Reino Unido. As bactérias que têm revelado essa resistência são as que normalmente causam infecções urinárias, particularmente em pacientes hospitalizados. Por vezes causam infecções em feridas e outras vezes pneumonias, um vasto leque de infecções que afetam principalmente pessoas mais vulneráveis, que já estejam doentes.
Em outubro de 2010, um surto da superbactéria causou a morte de 18 pessoas no Distrito Federal, dentro de um universo de 183 contaminados. Entretanto, não é o mesmo micro-organismo da Ásia, apenas possui a mesma origem no gene mutante da Klebsiella pneumoniae.[68] As autoridades médicas posteriormente reconheceram casos em Paraíba, Espírito Santo, Rio de Janeiro, São Paulo, Rio Grande do Sul e Paraná. Anunciaram também uma reunião da Anvisa para restringir a venda de antibióticos no Brasil e discutir outros meios de evitar a propagação da superbactéria.[69]

O surto de superbactéria no Distrito Federal foi causado sobretudo pela má higiene hospitalar e pela falta de recursos materiais, enfatizando a necessidade de mais verbas para o SUS e a conscientização de médicos e pacientes contra o uso indiscriminado de antibióticos, o que causa seleção bacteriana.[70] Entretanto, o problema ainda se restringe a ambientes hospitalares. O infectologista Alexandre Cunha, presidente da Sociedade Brasileira de Infectologia do Distrito Federal, explica o problema da seguinte forma:[71]
quem corre mais risco de infecção são pacientes que estão com sonda, catéter, punção venosa ou em outra situação que possa favorecer a infecção bacteriana. Mas, para quem visita o paciente, o risco é de ser colonizado pela bactéria, algo muito diferente de ser contaminado. Ou seja, a bactéria pode estar presente nas mãos, nos braços e no trato digestivo do visitante que manteve contato com o paciente, mas ele só correrá o risco de contaminação se sua saúde estiver debilitada e ele estiver com a imunidade baixa.
Segundo o médico David Uip, diretor do Instituto Emílio Ribas, unidade de referênia em infectologia no Brasil, o custo de desenvolvimento de novos antibióticos é muito elevado e os laboratórios farmacêuticos podem não se interessar, exigindo-se portanto pesados investimentos públicos. Ele afirnou que os infectologistas brasileiros estão se valendo da polimixina para enfrentarem as supebactérias, mas isso poderá causar nova seleção bacteriana. A Sociedade Americana de Doenças Infecciosas estabeleceu como meta, até 2020, colocar dez novos produtos no mercado.[72]
Em 2011, uma cepa de Staphylococcus aureus também foi identificada como uma bactéria resistente a todos os antibióticos. A amostra foi colhida no leite de vaca na Escócia, Inglaterra, Dinamarca, Irlanda e Alemanha, mas o mesmo germe se encontra em seres humanos, principalmente na pele. Geralmente o estafilococo só causa doença quando a pessoa se corta e essa variedade não é mais patogênica, mas resiste a qualquer antibiótico, tornando mais difícil o tratamento. Isso se deve a um gene chamado CFR, que codifica uma proteína capaz de proteger o ribossomo da bactéria contra o antibiótico.[73][74]
Entretanto, pode haver uma alternativa. O Hospital das Clínicas de São Paulo investigou o efeito do ozônio em dez bactérias, incluindo a KPC, e concluiu que essa substância pode destrui-las por meio de corrosão de suas membranas. O teste foi feito in vitro, com colônias de bactérias, e deve ser repetido em pacientes de hospitais e UTIs, cujos ambientes podem ser vaporizados com ozônio. Esse gás há tempo vem sendo usado com sucesso em infecções bacterianas.[75]
Ver também[editar | editar código-fonte]
- Seleção natural
- Marcador seleccionável
- Bactérias super-resistentes
- Restrição à venda de antibióticos no Brasil
Referências
- ↑ Kirby-Bauer Disk Diffusion Susceptibility Test Protocol Arquivado em 2011-06-26 no Wayback Machine, Jan Hudzicki, ASM
- ↑ «Review on Antimicrobial Resistance». amr-review.org. Consultado em 20 de maio de 2016
- ↑ a b «Antimicrobial resistance Fact sheet N°194». who.int. Abril de 2014. Consultado em 7 de março de 2015
- ↑ «About Antimicrobial Resistance - Antibiotic/Antimicrobial Resistance - CDC». www.cdc.gov. 19 de setembro de 2017
- ↑ «General Background: About Antibiotic Resistance». www.tufts.edu. Consultado em 30 de outubro de 2015. Arquivado do original em 23 de outubro de 2015
- ↑ a b c d «About Antimicrobial Resistance». www.cdc.gov. Consultado em 30 de outubro de 2015
- ↑ «Antibiotic Resistance Questions & Answers». Get Smart: Know When Antibiotics Work. Centers for Disease Control and Prevention, USA. 30 de junho de 2009. Consultado em 20 de março de 2013
- ↑ WHO (Abril de 2014). «Antimicrobial resistance: global report on surveillance 2014». WHO. WHO. Consultado em 9 de maio de 2015
- ↑ a b Swedish work on containment of antibiotic resistance – Tools, methods and experiences (PDF). Stockholm: Public Health Agency of Sweden. 2014. pp. 16–17, 121–128. ISBN 978-91-7603-011-0
- ↑ «The Five Rights of Medication Administration». www.ihi.org. Consultado em 30 de outubro de 2015
- ↑ a b «Duration of antibiotic therapy and resistance». NPS Medicinewise. National Prescribing Service Limited trading, Australia. 13 de junho de 2013. Consultado em 22 de julho de 2015. Arquivado do original em 23 de julho de 2015
- ↑ a b «CDC Features – Mission Critical: Preventing Antibiotic Resistance». www.cdc.gov. Consultado em 22 de julho de 2015
- ↑ Leekha, Surbhi; Terrell, Christine L.; Edson, Randall S. (1 de janeiro de 2011). «General Principles of Antimicrobial Therapy». Mayo Clinic Proceedings. 86 (2): 156–167. PMC 3031442
 . PMID 21282489. doi:10.4065/mcp.2010.0639
. PMID 21282489. doi:10.4065/mcp.2010.0639 - ↑ Cassir, N; Rolain, JM; Brouqui, P (2014). «A new strategy to fight antimicrobial resistance: the revival of old antibiotics.». Frontiers in Microbiology. 5. 551 páginas. PMC 4202707
 . PMID 25368610. doi:10.3389/fmicb.2014.00551
. PMID 25368610. doi:10.3389/fmicb.2014.00551 - ↑ a b "WHO's first global report on antibiotic resistance reveals serious, worldwide threat to public health" Retrieved 2014-05-02
- ↑ Hoffman S.J.; Outterson K.; Røttingen J-A.; Cars O.; Clift C.; Rizvi Z.; Rotberg F.; Tomson G.; Zorzet A. (Fevereiro de 2015). «An International Legal Framework to Address Antimicrobial Resistance». Bulletin of the World Health Organization. 93 (2): 66. PMC 4339972
 . PMID 25883395. doi:10.2471/BLT.15.152710
. PMID 25883395. doi:10.2471/BLT.15.152710 - ↑ «Antibiotic / Antimicrobial Resistance - CDC». www.cdc.gov. 18 de agosto de 2017
- ↑ «Biggest Threats - Antibiotic/Antimicrobial Resistance - CDC». www.cdc.gov. Consultado em 5 de maio de 2016
- ↑ «What is Drug Resistance?». www.niaid.nih.gov. Consultado em 26 de julho de 2015
- ↑ «CDC: Get Smart: Know When Antibiotics Work». Cdc.gov. Consultado em 12 de junho de 2013
- ↑ D'Costa VM, King CE, Kalan L, Morar M, Sung WW, Schwarz C, Froese D, Zazula G, Calmels F, Debruyne R, Golding GB, Poinar HN, Wright GD (2011). «Antibiotic resistance is ancient». Nature. 477 (7365): 457–461. Bibcode:2011Natur.477..457D. PMID 21881561. doi:10.1038/nature10388
- ↑ Caldwell & Lindberg 2011.
- ↑ Hawkey & Jones 2009, pp. i3-i10.
- ↑ Goossens H, Ferech M, Vander Stichele R, Elseviers M (2005). «Outpatient antibiotic use in Europe and association with resistance: a cross-national database study». Lancet. 365 (9459): 579–87. PMID 15708101. doi:10.1016/S0140-6736(05)17907-0
- ↑ Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, Vlieghe E, Hara GL, Gould IM, Goossens H, Greko C, So AD, Bigdeli M, Tomson G, Woodhouse W, Ombaka E, Peralta AQ, Qamar FN, Mir F, Kariuki S, Bhutta ZA, Coates A, Bergstrom R, Wright GD, Brown ED, Cars O (2013). «Antibiotic resistance-the need for global solutions». Lancet Infect Dis. 13 (12): 1057–98. PMID 24252483. doi:10.1016/S1473-3099(13)70318-9. hdl:10161/8996
- ↑ Ferber D (4 de janeiro de 2002). «Livestock Feed Ban Preserves Drugs' Power». Science. 295 (5552): 27–28. PMID 11778017. doi:10.1126/science.295.5552.27a
- ↑ Mathew AG, Cissell R, Liamthong S (2007). «Antibiotic resistance in bacteria associated with food animals: a United States perspective of livestock production». Foodborne Pathog. Dis. 4 (2): 115–33. PMID 17600481. doi:10.1089/fpd.2006.0066
- ↑ «Pharmaceuticals Sold In Sweden Cause Serious Environmental Harm In India, Research Shows». ScienceDaily. ScienceDaily, LLC. 7 de fevereiro de 2009. Consultado em 29 de janeiro de 2015.
We estimated that the[water] treatment plant released 45 kilograms of the antibiotic ciprofloxacin in one day, which is equivalent to five times the daily consumption of Sweden,"
- ↑ Larsson DG, Fick J (janeiro de 2009). «Transparency throughout the production chain – a way to reduce pollution from the manufacturing of pharmaceuticals?». Regul Toxicol Pharmacol. 53 (3): 161–3. PMID 19545507. doi:10.1016/j.yrtph.2009.01.008
- ↑ CDC. «Antibiotic Resistance Questions and Answers» [Are antibacterial-containing products (soaps, household cleaners, etc.) better for preventing the spread of infection? Does their use add to the problem of resistance?]. Atlanta, Georgia, USA.: Centers for Disease Control and Prevention. Consultado em 25 de fevereiro de 2015
- ↑ Allison E. Aiello; Elaine L. Larson; Stuart B. Levy (2007). «Consumer Antibacterial Soaps: Effective or Just Risky?». Clinical Infectious Diseases. 45 (Supplement 2): S137-47. PMID 17683018. doi:10.1086/519255
- ↑ Pechère JC (setembro de 2001). «Patients' interviews and misuse of antibiotics». Clin. Infect. Dis. 33 Suppl 3: S170–3. PMID 11524715. doi:10.1086/321844.
Noncompliance may have an impact on antibiotic resistance... Type A consists in shorter than prescribed courses. By reducing the antibiotic pressure, provided that the daily doses are otherwise respected, one may see a theoretical advantage... Type B noncompliance reduces the number of daily doses... indicate that such underdosing may promote the selection of resistance
- ↑ Arnold SR, Straus SE (2005). Arnold SR, ed. «Interventions to improve antibiotic prescribing practices in ambulatory care». Cochrane Database of Systematic Reviews (4): CD003539. PMID 16235325. doi:10.1002/14651858.CD003539.pub2
- ↑ McNulty CA, Boyle P, Nichols T, Clappison P, Davey P (agosto de 2007). «The public's attitudes to and compliance with antibiotics». J. Antimicrob. Chemother. 60 Suppl 1: i63–8. PMID 17656386. doi:10.1093/jac/dkm161
- ↑ Olaf Weber (2009). Common cold Online-Ausg. ed. Basel: Birkhäuser. p. 234. ISBN 978-3-7643-9894-1
- ↑ Costelloe C, Metcalfe C, Lovering A, Mant D, Hay AD (2010). «Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis». British Medical Journal. 340: c2096. PMID 20483949. doi:10.1136/bmj.c2096
- ↑ Antimicrobial Resistance: Tackling a Crises for the Health and Welfare of Nations: 2014. [S.l.]: Jim O'Neill Gibbs Building, 215 Euston Road, London, NW1 2BE. 11 de dezembro de 2014
- ↑ Li JZ, Winston LG, Moore DH, Bent S (setembro de 2007). «Efficacy of short-course antibiotic regimens for community-acquired pneumonia: a meta-analysis». Am. J. Med. 120 (9): 783–90. PMID 17765048. doi:10.1016/j.amjmed.2007.04.023
- ↑ Runyon BA, McHutchison JG, Antillon MR, Akriviadis EA, Montano AA (junho de 1991). «Short-course versus long-course antibiotic treatment of spontaneous bacterial peritonitis. A randomized controlled study of 100 patients». Gastroenterology. 100 (6): 1737–42. PMID 2019378
- ↑ Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL (1 de agosto de 2000). «Short-course Empiric Antibiotic Therapy for Patients with Pulmonary Infiltrates in the Intensive Care Unit A Proposed Solution for Indiscriminate Antibiotic Prescription». Am. J. Respir. Crit. Care Med. 162 (2): 505–511. PMID 10934078. doi:10.1164/ajrccm.162.2.9909095
- ↑ Gleisner AL, Argenta R, Pimentel M, Simon TK, Jungblut CF, Petteffi L, de Souza RM, Sauerssig M, Kruel CD, Machado AR (30 de abril de 2004). «Infective complications according to duration of antibiotic treatment in acute abdomen». International Journal of Infectious Diseases. 8 (3): 155–162. PMID 15109590. doi:10.1016/j.ijid.2003.06.003
- ↑ Pichichero ME, Cohen R (1997). «Shortened course of antibiotic therapy for acute otitis media, sinusitis and tonsillopharyngitis». The Pediatric Infectious Disease Journal. 16 (7): 680–95. PMID 9239773. doi:10.1097/00006454-199707000-00011
- ↑ Dellinger EP, Wertz MJ, Lennard ES, Oreskovich MR (1986). «Efficacy of Short-Course Antibiotic Prophylaxis After Penetrating Intestinal Injury». Archives of Surgery. 121 (1): 23–30. PMID 3942496. doi:10.1001/archsurg.1986.01400010029002
- ↑ Perez-Gorricho B, Ripoll M (2003). «Does short-course antibiotic therapy better meet patient expectations?». International Journal of Antimicrobial Agents. 21 (3): 222–8. PMID 12636982. doi:10.1016/S0924-8579(02)00360-6
- ↑ Keren R, Chan E (2002). «A Meta-analysis of Randomized, Controlled Trials Comparing Short- and Long-Course Antibiotic Therapy for Urinary Tract Infections in Children». Pediatrics. 109 (5): E70–0. PMID 11986476. doi:10.1542/peds.109.5.e70
- ↑ McCormack J, Allan GM (2012). «A prescription for improving antibiotic prescribing in primary care». British Medical Journal. 344: d7955. PMID 22302779. doi:10.1136/bmj.d7955
- ↑ Marc Bonten, MD; Eijkman-Winkler Institute for Medical Microbiology, Utrecht, the Netherland | Infectious Diseases, and Inflammation Arquivado em 2013-05-17 no Wayback Machine
- ↑ Tacconelli E, De Angelis G, Cataldo MA, Pozzi E, Cauda R (janeiro de 2008). «Does antibiotic exposure increase the risk of methicillin-resistant Staphylococcus aureus (MRSA) isolation? A systematic review and meta-analysis». J. Antimicrob. Chemother. 61 (1): 26–38. PMID 17986491. doi:10.1093/jac/dkm416
- ↑ Muto CA, Jernigan JA, Ostrowsky BE, Richet HM, Jarvis WR, Boyce JM, Farr BM (maio de 2003). «SHEA guideline for preventing nosocomial transmission of multidrug-resistant strains of Staphylococcus aureus and enterococcus». Infect Control Hosp Epidemiol. 24 (5): 362–86. PMID 12785411. doi:10.1086/502213
- ↑ Vonberg, Dr Ralf-Peter. [2009-06-11 «Clostridium difficile: a challenge for hospitals»] Verifique valor
|arquivourl=(ajuda). European Center for Disease Prevention and Control. Institute for Medical Microbiology and Hospital Epidemiology: IHE. Consultado em 27 de julho de 2009. Arquivado do original em|arquivourl=requer|arquivodata=(ajuda) - ↑ Kuijper EJ, van Dissel JT, Wilcox MH (agosto de 2007). «Clostridium difficile: changing epidemiology and new treatment options». Current Opinion in Infectious Diseases. 20 (4): 376–83. PMID 17609596. doi:10.1097/QCO.0b013e32818be71d. (pede subscrição (ajuda))
- ↑ Thomas JK, Forrest A, Bhavnani SM, Hyatt JM, Cheng A, Ballow CH, Schentag JJ (março de 1998). «Pharmacodynamic Evaluation of Factors Associated with the Development of Bacterial Resistance in Acutely Ill Patients during Therapy». Antimicrob. Agents Chemother. 42 (3): 521–7. PMC 105492
 . PMID 9517926
. PMID 9517926 - ↑ Girou E, Legrand P, Soing-Altrach S, Lemire A, Poulain C, Allaire A, Tkoub-Scheirlinck L, Chai SH, Dupeyron C, Loche CM (outubro de 2006). «Association between hand hygiene compliance and methicillin-resistant Staphylococcus aureus prevalence in a French rehabilitation hospital». Infect Control Hosp Epidemiol. 27 (10): 1128–30. PMID 17006822. doi:10.1086/507967
- ↑ Predefinição:Citar periódico periódica
- ↑ Farmer, Paul E., Bruce Nizeye, Sara Stulac, and Salmaan Keshavjee. 2006. Structural Violence and Clinical Medicine. PLoS Medicine, 1686–1691. url=?
- ↑ Baur, David; Gladstone, Beryl Primrose; Burkert, Francesco; Carrara, Elena; Foschi, Federico; D?bele, Stefanie; Tacconelli, Evelina (Junho de 2017). «Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis». The Lancet Infectious Diseases. 17: 990–1001. doi:10.1016/S1473-3099(17)30325-0
- ↑ Baym, Michael; Lieberman, Tami D.; Kelsic, Eric D.; Chait, Remy; Gross, Rotem; Yelin, Idan; Kishony, Roy (9 de setembro de 2016). «Spatiotemporal microbial evolution on antibiotic landscapes». Science (em inglês). 353 (6304): 1147–1151. ISSN 0036-8075. PMID 27609891. doi:10.1126/science.aag0822
- ↑ Bactéria resistente a antibióticos se espalha pelo sul da Ásia e chega à Europa. Zero Hora, acessado em 17 de agosto de 2010.
- ↑ Alerta para NDM-1 Arquivado em 15 de agosto de 2010, no Wayback Machine.. Correio Braziliense, acessado em 17 de agosto de 2010.
- ↑ NDM-1 // Bactéria achada em australianos. O Norte, acessado em 17 de agosto de 2010.
- ↑ Autoridades sanitárias dizem que bactéria NDM-1 já está em Portugal Arquivado em 27 de abril de 2011, no Wayback Machine.. Portugal Digital, acessado em 17 de agosto de 2010.
- ↑ DGS alerta para 'superbactérias' no Brasil[ligação inativa]. On Ciência, acessado em 18 de novembro de 2010.
- ↑ Controle de superbactérias depende de uso racional de antibióticos. Portal G1, acessado em 23 de setembro de 2010.
- ↑ A primeira vítima da superbactéria Arquivado em 4 de outubro de 2010, no Wayback Machine.. Correio Braziliense, acessado em 17 de agosto de 2010.
- ↑ Cientistas alertam sobre possível disseminação da superbactéria. O Globo, acessado em 17 de agosto de 2010.
- ↑ A superbactéria e o medo de contágio. Veja, acessado em 17 de agosto de 2010.
- ↑ Superbactérias desesperam cientistas. FxPro, acessado em 17 de agosto de 2010.
- ↑ Superbactéria matou 18 pessoas em dez hospitais do Distrito Federal. O Estadão, acessado em 8 de outubro de 2010.
- ↑ Temporão diz que SP e PR têm casos confirmados de superbactéria. Portal G1, acessado em 20 de outubro de 2010.
- ↑ Secretaria de Saúde do DF confirma mais três mortes pela superbactéria. Portal G1, acessado em 21 de outubro de 2010.
- ↑ Aumento do número de mortes por superbactéria deixa população receosa Arquivado em 22 de outubro de 2010, no Wayback Machine.. Correio Braziliense, acessado em 21 de outubro de 2010.
- ↑ Hermano Freitas e Marcelo Becker, Médicos pedem pressa em antibiótico contra superbactéria. Portal Terra, acessado em 16 de novembro de 2010.
- ↑ Novo tipo de bactéria superresistente é identificado na Grã-Bretanha. Portal G1, acessado em 4 de junho de 2011.
- ↑ Cientistas explicam como grupo de bactérias fica resistente a drogas. Portal G1, acessado em 4 de junho de 2011.
- ↑ Cientistas encontram forma de combater bactérias super-resistentes. Correio da Bahia, acessado em 11 de dezembro de 2010.
Ligações externas[editar | editar código-fonte]
 Media relacionados com Resistência antibiótica no Wikimedia Commons
Media relacionados com Resistência antibiótica no Wikimedia Commons


 French
French Deutsch
Deutsch