Resposta policlonal das células B – Wikipédia, a enciclopédia livre

A resposta policlonal das células B é um tipo natural de resposta imune que o sistema imunitário adaptativo dos mamíferos apresenta. Possibilita que um determinado antígeno seja reconhecido e atacado pelas suas partes sobrepostas, chamadas epítopos, por múltiplos clones de células B.[1][2]
No decurso duma resposta imunitária normal, algumas partes do patógeno (por exemplo, uma bactéria) são reconhecidas pelo sistema imunitário como algo estranho (impróprio), e eliminadas ou neutralizadas para reduzir os possíveis danos que poderiam causar. A substância reconhecível é chamada antígeno. O sistema imunitário pode responder de muitas maneiras ao antígeno; uma característica fundamental desta resposta é a produção de anticorpos pelas células B (ou linfócitos B) que intervêm num conjunto de acções do sistema imunitário chamado imunidade humoral. Os anticorpos são solúveis e não requerem um contacto directo célula a célula entre o patógeno e a célula B para o seu funcionamento.
Os antígenos podem ser substâncias grandes e complexas, e qualquer anticorpo pode apenas ligar-se a uma área pequena e específica do antígeno. Como consequência, uma resposta imune efectiva implica, frequentemente, a produção de muitos anticorpos distintos pelas células B contra o mesmo antígeno. Daí o termo "policlonal", que deriva das palavras gregas poly, que significa 'muitos', e klon, 'broto', 'raminho'.[3][4][5] Um clone é um grupo de células que se originam a partir da divisão duma célula "parental" comum. Os anticorpos assim produzidos numa resposta policlonal são denominados anticorpos policlonais. Os anticorpos policlonais são heterogéneos e distintos das moléculas de anticorpos monoclonais, as quais são idênticas e reagem contra um só epítopo, ou seja, são mais específicas.
Embora a resposta policlonal confira certas vantagens ao sistema imunitário, como ter uma maior probabilidade de reagir contra os patógenos, também aumenta as possibilidades de desenvolver certas doenças auto-imunes que resultam da reacção do sistema imunitário contra moléculas nativas produzidas pelo próprio hóspede.
Resposta humoral a uma infecção[editar | editar código-fonte]
As doenças que podem transmitir-se dum organismo para outro denominam-se doenças infecciosas, e o agente biológico que as causa denomina-se patógeno. O processo pelo qual o patógeno se introduz no corpo denomina-se inoculação,[nota 1][6] e o organismo afectado denomina-se hospedeiro. Quando o agente patogénico se estabelece numa etapa chamada colonização,[7] pode provocar uma infecção,[7] danificando o hóspede directamente ou por meio da produção de substancias prejudiciais chamadas toxinas.[7] Isto dá origem aos diversos sintomas e sinais característicos duma doença infecciosa como a pneumonia ou a difteria.
É muito importante neutralizar as doenças infecciosas para garantir a sobrevivência do organismo e da espécie. Isto consegue-o o hóspede eliminando o patógeno e as suas toxinas ou tornando-os não-funcionais. O conjunto de células, tecidos e órgãos que se especializam na protecção do corpo contra as infecções constituem o sistema imunitário. O sistema imunitário realiza este trabalho por meio do contacto directo que certos leucócitos estabelecem com o patógeno invasor, formando uma rede do sistema imunitário chamada imunidade mediada por células, ou produzindo substâncias que se movem pelo corpo até chegar a sítios distantes de onde se segregaram, "procuram" células causantes da doença e toxinas unindo-se especificamente[nota 2] a elas, e neutralizando-as no processo chamado imunidade humoral. Tais substâncias defensivas são os anticorpos solúveis, que desempenham funções importantes na luta contra infecções, inclusive:
- Recobrem o patógeno, impedindo-o de aderir-se à célula hospedeira e impossibilitando assim a colonização;
- Fazem com que precipitem (que se agreguem e "afundem" deixando de circular ao unirem-se a eles) os antígenos solúveis, e promovem a sua remoção dos tecidos e sangue por outras células do sistema imunitário;
- Recobrem o microorganismo, o que atrai células que fagocitam o patógeno. Este recobrimento chama-se opsonização Deste modo, o anticorpo actua como uma opsonina;
- Activam o sistema do complemento, que causa perforações na envoltura externa do patógeno (a sua membrana plasmática), o que o mata;
- Marcam células do hóspede infectadas por vírus para que sejam destruídas num processo chamado citotoxicidade mediada por células dependente de anticorpos.[8]
- Tipos de leucócitos
Resposta das células B[editar | editar código-fonte]

Os anticorpos realizam várias funções na protecção do hóspede contra o patógeno. As suas formas solúveis (anticorpos) que levam a cabo estas funções são produzidas pelas células B plasmáticas, um tipo de linfócito B. Esta produção é estreitamente regulada e requer a activação de células B pelas células T activadas (outro tipo de leucócito), que é um procedimento sequencial. Os principais passos implicados são:[9]
- Reconhecimento específico ou não específico do patógeno (por meio dos seus antígenos) com a sub-seguinte fagocitose do antígeno por células B ou por macrófagos. Isto activa apenas parcialmente a célula B;
- Processamento do antígeno;
- Apresentação do antígeno;
- Activação das células T colaboradoras (ajudante ou auxiliar) pelas células apresentadoras do antígeno;
- Co-estimulação da célula B pela célula T activada, o que tem como resultado a sua completa activação;
- Proliferação[nota 3] das células B com a produção resultante de anticorpos solúveis.

Reconhecimento de patógenos[editar | editar código-fonte]
Os patógenos sintetizam proteínas que podem servir como antígenos reconhecíveis; podem expressar essas moléculas na sua superfície ou libertá-las nos seus arredores (fluidos corporais). O que faz com que estas substâncias sejam reconhecíveis é que se unem muito especificamente e com alguma força a certas proteínas do hóspede chamadas anticorpos Os anticorpos podem estar ancorados à superfície das células do sistema imunitário, e neste caso servem como receptores imunitários, ou podem ser segregados para o sangue (anticorpos solúveis). À escala molecular, as proteínas são relativamente grandes, pelo que não podem ser reconhecidas no seu conjunto total; pelo contrário, têm segmentos mais pequenos chamados epítopos, que são os que serão reconhecidos.[1] Um epítopo põem-se em contacto com uma pequena região (de 15 a 22 aminoácidos) da molécula de anticorpo; esta região é conhecida como parátopo.[1] No sistema imunitário, os anticorpos unidos à membrana são o receptor de células B (BCR). Além disso, embora o receptor de células T (TCR) não se classifique bioquimicamente como um anticorpo, realiza uma função semelhante na qual se une especificamente a epítopos complexados a moléculas do complexo principal de histocompatibilidade (MHC).[nota 4][10]
A união entre um parátopo e o seu antígeno correspondente é muito específica devido à sua estrutura, e é estabelecida por meio de várias ligações não-covalentes, de modo não muito diferente ao apareamento de outros tipos de ligantes (quaisquer átomo, ião ou molécula que se liga a um receptor com pelo menos algum grau de especificidade e força). A especificidade da ligação não se origina por um tipo de interacção rígida de chave e fechadura, mas sim necessita que tanto o parátopo como o epítopo experimentem ligeiras alterações conformacionais quando estão um na presença do outro.[11]
Reconhecimento específico do epítopo pelas células B[editar | editar código-fonte]

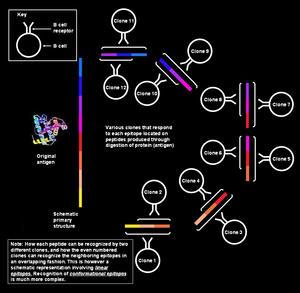
Na figura da esquerda, os diversos segmentos que formam o epítopo são co-lineares de forma contínua, ou seja, são sequenciais; porém, no que diz respeito ao reconhecimento de antígenos a partir das células B, esta explicação é muito simplista. Tais epítopos conhecem-se como sequenciais ou lineares, uma vez que todos os aminoácidos que os formam estão na mesma sequência (linha). Esta forma de reconhecimento só é possível quando o péptido é pequeno (com cerca de seis a oito aminoácidos de comprimento), e é empregue pelas células T.
Porém, as células B de memória/virgens reconhecem as proteínas intactas presentes na superfície do patógeno.[nota 5] Nesta situação, a proteína na sua estrutura terciária está tão enovelada que alguns bucles da sequência de aminoácidos ficam situados no interior da proteína, e os segmentos que os flanqueiam podem ficar na superfície. O parátopo no receptor de células B põe-se em contacto apenas com aqueles aminoácidos que estão situados na superfície da proteína. Os aminoácidos da superfície podem na realidade não estar em sequência contínua na estrutura primária da proteína, mas ficam juntos depois do enovelamento da proteína (como se pode ver na figura anexa). Tais epítopos são conhecidos como epítopos conformacionais e tendem a ser mais compridos (de 15 a 22 resíduos de aminoácidos) do que os epítopos lineares.[1] Da mesma forma, os anticorpos produzidos pelas células plasmáticas que pertencem ao mesmo clone unir-se-ão aos mesmos epítopos conformacionais das proteínas do patógenos.[12][13][14][15]
A união de um antígeno específico com as moléculas correspondentes BCR resulta no aumento da produção de moléculas MHC-II. Isto tem importância, já que o mesmo não acontece quando o mesmo antígeno é interiorizado por um processo relativamente não-específico chamado pinocitose, no qual o antígeno juntamente com o fluído que o rodeia é absorvido formando uma pequena vesícula pela célula B. Portanto, esse antígeno denomina-se antígeno não-específico e não conduz à activação da célula B, nem à produção de anticorpos contra ele.
Reconhecimento não-específico pelos macrófagos[editar | editar código-fonte]
Os macrófagos e as células dendríticas empregam um mecanismo diferente para reconhecer o patógeno. Os seus receptores reconhecem certos motivos presentes nos patógenos invasores que é muito improvável que estejam presentes numa célula hóspede. Esses motivos repetidos são reconhecidos pelos receptores de reconhecimento de padrões (PRRs) como os receptores do tipo Toll (TLRs) expressados pelos macrófagos.[1][16] Como o mesmo receptor poderia unir-se a um determinado motivo presente nas superfícies de microorganismos muito diferentes, esta forma de reconhecimento é relativamente não-específica e constitui uma resposta imunitária inata.
Processamento de antígenos[editar | editar código-fonte]

Depois de reconhecer um antígeno, uma célula apresentadora do antígeno, como o macrófago ou o linfócito B, fagocita-o por completo num processo chamado fagocitose. A partícula fagocitada, juntamente com parte do material que a rodeia, passa a fazer parte de uma vesícula endocítica (ou fagossoma), que se funde depois com lisossomas Dentro do lisossoma em digestão, o antígeno é rompido em pequenos fragmentos chamados péptidos pela acção de proteases (enzimas que degradam as grandes proteínas). Cada péptido é depois acomplexado com moléculas do complexo principal de histocompatibilidade de classe II (MHC-II) localizadas no lisossoma (este método de "manejo" do antígeno denomina-se processamento por via endocítica ou exógena que é diferente da via citosólica ou endógena,[16][17][18] a qual acomplexa as proteínas anormais produzidas dentro da célula (por exemplo, sob influência duma infecção viral ou numa célula tumoral) com moléculas de MHC-I.
Uma via alternativa de processamento endocítico demonstrou-se também quando certas proteínas como o fibrinogénio e a mioglobina podem ligar-se como um todo a moléculas de MHC-II para depois serem desnaturalizadas e reduzidas as suas ligações dissulfeto (o que rompe a ligação ao acrescentar-lhe átomos de hidrogénio). Posteriormente, as proteases degradam as regiões expostas do complexo proteína-MHC II.[18]
Apresentação do antígeno[editar | editar código-fonte]
Uma vez que o antígeno (péptido) processado forma o complexo com a molécula do MHC, ambos migram juntos para a membrana plasmática, onde são exibidos (elaborados) como um complexo que pode ser reconhecido pela célula CD 4+ (ou linfócito T colaborador) (um tipo de linfócito).[nota 6][19] Isto denomina-se apresentação de antígenos. Porém, os epítopos (conformacionais) que são reconhecidos pela célula B antes da sua digestão não podem ser os mesmos que os apresentados à célula T colaboradora. Adicionalmente, uma célula B pode apresentar diferentes péptidos acomplexados a diferentes moléculas MHC-II.[20]
Estimulação das células T colaboradoras[editar | editar código-fonte]
As células CD4+ através do seu complexo receptor de células T-CD3 reconhecem as moléculas MHC II ligadas a epítopos na superfície de células apresentadoras do antígeno, e são assim activadas. Com esta activação, estas células T proliferam e diferenciam-se em células Th2.[20][21] Isto faz com que comecem a produzir sinais químicos solúveis que promovem a sua própria sobrevivência. Porém, outra importante função que levam a cabo é a estimulação das células B ao estabelecerem um contacto físico directo com elas.[10]
Co-estimulação de células B por células T colaboradoras activadas[editar | editar código-fonte]
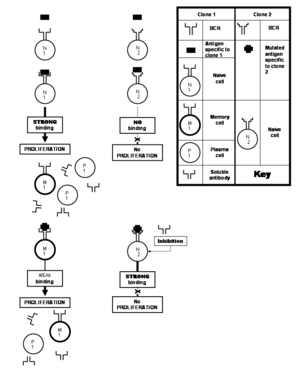
A estimulação completa das células T colaboradoras necessita da proteína B7 presente na célula apresentadora do antígeno para se unir com a molécula CD28 presente à superfície da célula T (em estreita proximidade com o receptor da célula T).[10] Da mesma forma, uma segunda interacção entre o ligante CD40 ou CD154 (CD40L) presente à superfície da célula T e o CD40 presente na superfície da célula B, é também necessária.[21] As mesmas interacções que estimulam a célula T colaboradora também estimulam a célula B, daí que se utilize o termo co-estimulação. O mecanismo inteiro assegura que uma célula T activada só estimula a célula B que reconhece o antígeno que contém o mesmo epítopo que reconhece o receptor TCR da célula T colaboradora co-estimulante. A célula B fica estimulada, para além de aplicar a co-estimulação directa, por certos factores de crescimento, como as interleucinas IL-2, IL-4, IL-5 e IL-6 de maneira parácrina Estes factores são geralmente produzidos pelas células T colaboradoras acabadas de activar.[22] Contudo, esta activação ocorre só depois de o receptor da célula B presente numa célula B de memória ou na própria célula B virgem se ligar ao epítopo correspondente, sem o qual os passos que iniciam a fagocitose e o processamento do antígeno não teriam ocorrido.
Proliferação e diferenciação das células B[editar | editar código-fonte]
Uma célula B virgem ou inexperimentada é a célula que pertence a um clone que nunca se encontrou com o epítopo para o qual é específico. Em contrapartida, uma célula B de memória é a célula que deriva da activação duma célula B virgem ou de memória. A activação duma célula B virgem ou de memória é seguida por uma grande proliferação dessa célula B particular, a maioria cuja progénie se diferencia finalmente em células B plasmáticas;[nota 7] o restante sobrevive como célula B de memória. Assim, quando as células virgens pertencentes a um clone particular se encontram com o seu antígeno específico para dar lugar às células plasmáticas, deixam também umas quantas células diferenciadas como células B de memória, a isto dá-se o nome de resposta imunitária primária. No decurso da proliferação deste clone, os genes do receptor da célula B podem sofrer frequentes mutações (uma em cada duas divisões celulares)[8] nos genes que codificam os parátopos dos anticorpos. Estas mutações frequentes denominam-se hipermutações somáticas. Cada uma destas mutações altera ligeiramente a capacidade de ligação ao epítopo do parátopo, criando novos clones de células B no processo. Alguns dos parátopos da nova criação ligam-se com mais vigor ao mesmo epítopo (o que conduz à selecção dos clones que os possuam), isto é conhecido por maturação da afinidade.[8][21] Outros parátopos ligam-se melhor a epítopos que são ligeiramente diferentes dos epítopos originais que estimularam a proliferação. As variações na estrutura do epítopo produzem-se também geralmente por mutações nos genes do patógeno que codifica o seu antígeno. Assim, a hipermutação somática, faz com que os receptores da célula B e os anticorpos solúveis em encontros posteriores com os antígenos, sejam mais inclusivos no seu potencial de reconhecimento de antígenos com epítopos alterados, além de oferecerem uma maior especificidade para o antígeno que induziu a proliferação em primeiro lugar. Quando as células de memória são estimuladas pelo antígeno para que originem células plasmáticas (de igual modo que na resposta primária aos clones), deixam inclusive mais células de memória no processo, isto denomina-se resposta imunitária secundária,[21] o que se traduz em maiores quantidades de células plasmáticas e uma velocidade maior de produção de anticorpos que se mantém durante grandes períodos de tempo. As células B com memória produzidas como parte duma resposta secundária reconhecem o antígeno correspondente mais rápido e unem-se com maior vigor a ele (ou seja, com maior afinidade de união) devido à maturação da afinidade. Os anticorpos solúveis produzidos pelo clone mostram uma potenciação similar na união ao antígeno.[21]
Bases de policlonalidade[editar | editar código-fonte]
As respostas são de natureza policlonal, uma vez que cada clone está em maior ou menor grau especializado na produção de anticorpos contra um determinado epítopo e porque cada antígeno contém múltiplos epítopos, cada um dos quais por sua vez pode ser reconhecido por mais de um clone de células B. Para poder reagir a inúmeros antígenos, e com os múltiplos epítopos que os constituem, o sistema imunitário deve ter a capacidade de reconhecer uma grande quantidade de epítopos, ou seja, deveria haver uma grande diversidade de clones de células B.
Clonalidade das células B[editar | editar código-fonte]
No corpo há quantidades relativamente pequenas de células B de memória e virgens. Como o corpo necessita poder responder a uma grande quantidade de potenciais patógenos, mantém um conjunto de células B com uma ampla gama de especificidades.[16] Consequentemente, embora haja quase sempre pelo menos uma célula B (virgem ou de memória) que pode responder a qualquer epítopo particular (dentre todos contra os que o sistema imunitário pode reagir), há muito poucos que sejam duplicados exactos. Porém, quando uma célula B encontra um antígeno ao qual pode unir-se, pode proliferar muito rapidamente.[21] Esse grupo de células com especificidade idêntica para o epítopo é um clone, e deriva duma célula "parental" comum. Todas as células B "filhas" têm a mesma especificidade para o epítopo que tem a célula "parental" original e segregam anticorpos com parátopos idênticos. Estes anticorpos são anticorpos monoclonais, já que derivam de clones da mesma célula parental. Uma resposta policlonal é aquela na qual clones de múltiplas células B reagem com o mesmo antígeno.
Um antígeno contém múltiplos epítopos sobrepostos[editar | editar código-fonte]

Um só antígeno pode ser considerado como uma sequência de múltiplos epítopos que se sobrepõem. Aos diversos epítopos podem unir-se muitos clones de células B únicos. Isto origina uma multiplicidade ainda maior na resposta global.[3] Todas estas células B podem ser activadas e produzir grandes colónias de clones de células plasmáticas, cada uma das quais pode segregar até mil moléculas de anticorpos iguais contra cada epítopo por segundo.[21]
Múltiplos clones reconhecem um só epítopo[editar | editar código-fonte]
Para além de diferentes células B reagirem com diferentes epítopos do mesmo antígeno, as células B que pertencem a diferentes clones podem também reagir com o mesmo epítopo. Um epítopo que pode ser atacado por muitas células B diferentes diz-se que é muito imunogénico. Nesses casos, as afinidades de ligação para com os respectivos pares epítopo-parátopo variam, e alguns clones de células B produzem anticorpos que se unem fortemente ao epítopo, e outros que produzem anticorpos que se unem debilmente.[1]
Selecção clonal[editar | editar código-fonte]
Os clones que se ligam a um determinado epítopo com maior força é mais provável que sejam seleccionados para experimentar uma maior proliferação nos centros germinativos dos folículos em vários tecidos linfoides como os gânglios linfáticos. Isto não é muito diferente da selecção natural: os clones são seleccionados pela sua aptidão para atacar os epítopos (força de ligação) do patógeno que encontram.[23] O que faz com que a analogia seja ainda mais evidente é que os linfócitos B têm que competir entre eles pelos sinais que promovem a sua sobrevivência nos centros germinativos.
Diversidade dos clones de células B[editar | editar código-fonte]
Como há muitos e muito diversos agentes patogénicos, muitos dos quais sofrem constantemente mutação, é surpreendente que a maioria dos indivíduos permaneçam livres de infecções a maior parte do tempo. Assim, para a manutenção da saúde é preciso que o corpo reconheça todos os patógenos (os antígenos que estes apresentam ou produzem) que possam existir. Isto só é possível mantendo um conjunto enormemente grande (cerca de 109) de clones de células B, cada um dos quais reagem contra um epítopo específico reconhecendo-o e produzindo anticorpos contra ele. Porém, em qualquer momento muito poucos clones permanecem realmente receptivos ao seu epítopo específico. Assim, todos os clones de células B combinados podem reconhecer aproximadamente 107 epítopos diferentes.[21] Além disso, durante toda a vida de um indivíduo, este requer geralmente a geração de anticorpos contra muito poucos antígenos em comparação com o número que o corpo poderia reconhecer e contra os que poderia responder.[21]
Importância do fenómeno[editar | editar código-fonte]
Aumento da possibilidade de reconhecimento de antígenos[editar | editar código-fonte]
Se um antígeno pode ser reconhecido por mais de um componente da sua estrutura, então é menos provável que passe despercebido ao sistema imunitário.[nota 8] A mutação dos organismos patogénicos pode ter como resultado a modificação do antígeno, e, portanto, da estrutura do epítopo. Se o sistema imunitário se "lembra" como são os outros epítopos, o antígeno e o organismo invasor ainda serão reconhecidos e submetidos à resposta imunitária do corpo. Deste modo, a resposta policlonal amplia a gama de patógenos que podem ser reconhecidos.[24]
Limitação do sistema imunológico ante os vírus que sofrem rápidas mutações[editar | editar código-fonte]
Muitos vírus sofrem frequentemente mutações que originam mudanças na composição de aminoácidos de importantes proteínas virais. Os epítopos localizados na proteína podem também sofrer alterações nesse processo. Um epítopo assim alterado une-se com menos força com os seus anticorpos específicos que o epítopo original que estimulava o sistema imunitário. O que é pena porque as hipermutações somáticas dariam lugar a clones com capacidade de produzir anticorpos solúveis que se uniriam ao epítopo alterado com suficiente avidez para neutralizá-lo. Mas estes clones consistiriam em células virgens as quais os anticorpos debilmente unidos produzidos pelo clone estimulado anteriormente não permitem proliferar. Esta teoria é conhecida como o pecado original antigénico.[21] Este fenómeno entra em funcionamento especialmente nas respostas imunes contra vírus como os da gripe, dengue e VIH.[25] Porém, esta limitação não é imposta pelo fenómeno da resposta policlonal, mas sim contra ela por uma resposta imune que tende em favor de células de memória experimentadas e contra as células virgens "novatas".
Aumento da possibilidade de reacções auto-imunitárias[editar | editar código-fonte]
Na auto-imunidade o sistema imunitário reconhece erroneamente certas moléculas nativas do próprio corpo como se fossem alheias, e desencadeia uma resposta imunitária contra elas. Como estas moléculas, que são componentes normais do corpo, sempre existem de forma natural no corpo, o ataque contra elas pode ser cada vez mais forte ao longo do tempo (de forma semelhante ao que ocorre nas respostas imunitárias secundárias). Para além disso, muitos organismos apresentam mimetismo molecular, o que faz com que mostrem antígenos na superfície celular que são antigenicamente parecidos a proteínas do hospedeiro. Isto tem duas possíveis consequências: primeiro, o organismo invasor pode ser considerado como um antígeno próprio e pode não ser atacado; ou por outro lado, os anticorpos produzidos contra ele unir-se-ão também às proteínas nativas próprias imitadas. Os anticorpos atacarão os antígenos próprios e os tecidos que os albergam ao activarem-se vários mecanismos como o sistema complemento e a citotoxicidade mediada por células dependente de anticorpos. Portanto, quanto mais amplo for a gama de especificidades dos anticorpos, maior é a possibilidade de que algum reaja contra antígenos próprios (as moléculas nativas do corpo).[26][27]
Produção de anticorpos monoclonais[editar | editar código-fonte]
Os anticorpos monoclonais são moléculas de imunoglobulinas estruturalmente idênticas entre si com especificidade de epítopo idêntica (todas com o mesmo epítopo e com a mesma afinidade), em relação aos seus anticorpos policlonais, que mostram várias afinidades para o mesmo epítopo. Normalmente não se produzem na resposta imune natural, mas sim apenas em doenças como o mieloma múltiplo, ou então são produzidos por técnicas especializadas em laboratório. Devido à sua especificidade, os anticorpos monoclonais utilizam-se em verdadeiras aplicações para quantificar ou detectar a presença de substâncias (as quais actuam como antígenos dos anticorpos monoclonais), e para dirigi-los contra determinadas células (por exemplo, células cancerígenas). Os anticorpos monoclonais são úteis em várias modalidades de diagnóstico (como a western blot e a imunofluorescência) e em verdadeiras terapias, especialmente do cancro e de doenças com um componente autoimune. Mas, como virtualmente todas as respostas na natureza são policlonais, isto faz com que a produção dos imensamente úteis anticorpos monoclonais não seja tão fácil.[8]
História[editar | editar código-fonte]
As primeiras evidências da presença de uma substância neutralizante no sangue que poderia combater as infecções foram encontradas quando Emil von Behring juntamente com Kitasato Shibasaburō em 1890 desenvolveu um soro contra a difteria, doença bacteriana em que as bactérias soltam uma toxina. Para isso transferiram soro produzido por animais imunizados contra a difteria naqueles que dela padeciam. Ao transferirem o soro curaram os animais infectados. Behring recebeu o Prémio Nobel por este trabalho em 1901.[28]
Nessa época não se conhecia a natureza química da substância que estava no sangue e que proporcionava este tipo protecção. Poucas décadas depois demonstrou-se que este soro protector podia neutralizar e fazer precipitar as toxinas, e aglutinar bactérias. Todas estas funções foram atribuídas a diferentes substâncias presentes no soro, e denominadas consequentemente antitoxinas, precipitinas e aglutininas. As três substâncias eram na realidade uma só (proteínas gamaglobulinas), como demonstrou Elvin A. Kabat em 1939. Um ano antes Kabat demonstrou a heterogeneidade dos anticorpos através de estudos de ultracentrifugação de soros de cavalos.[29]
Até então, a imunidade humoral e a mediada por células eram consideradas teorias rivais para explicar a resposta imunitária, mas a segunda ficou atrás devido ao avanço de certas técnicas.[16] A imunidade mediada por células adquiriu um novo impulso quando, em 1942, Merrill Chase transferiu com sucesso a imunidade contra a tuberculose entre porcos ao administrar-lhes leucócitos.[16][30]
Posteriormente, em 1948, Astrid Fagraeus demonstrou na sua tese de doutoramento que as células B plasmáticas eram as responsáveis pela produção de anticorpos.[31] O papel dos linfócitos nas respostas mediadas por células e humorais foi mais tarde demonstrado por James Gowans, em 1959.[30]
Para explicar a ampla variedade de antígenos que o sistema imunitário pode reconhecer, Paul Ehrlich em 1900 hipotetizou que uns "receptores de corrente lateral" pré-existentes se uniam a um determinado patógeno e que esta interacção é a que induziria a célula que tinha o receptor a multiplicar-se e produzir mais cópias do mesmo receptor. Esta teoria, chamada "a teoria selectiva" não se conseguiu provar durante as cinco décadas que se seguiram, e fora desafiada por várias "teorias instrucionais" alternativas, que estavam baseadas na ideia de que um anticorpo adopta a sua estrutura efectiva ao enovelar-se ao redor do antígeno.[16] Porém, em finais da década de 1950, os trabalhos de três cientistas: Jerne, Talmage e Burnet (que modificaram amplamente a teoria inicial), deram lugar à teoria da selecção clonal, que provou todos os elementos da hipótese de Ehrlich excepto que os receptores específicos que podiam neutralizar o agente eram solúveis e não estavam unidos a membranas.[16][30]
Com Gustav Nossal, ao mostrar que uma célula B produzia sempre um único anticorpo, verificara-se então que teoria da selecção clonal estava correcta.[32]
Em 1974, Rolf Zinkernagel e Peter C. Doherty demonstraram o papel do MHC na apresentação de antígenos.[30]
Ver também[editar | editar código-fonte]
- Anticorpo policlonal
- Processamento de antígenos
- Antissoro, uma preparação de anticorpos policlonais usada para tratar envenenamentos por picadas
Notas[editar | editar código-fonte]
- ↑ O termo "inoculação" utiliza-se maioritariamente no contexto duma imunização activa, ou seja, a introdução deliberada da substância antigénica no hóspede. Porém, em muitas discussões de doenças infecciosas, é relativamente frequente usar este termo para se referir a um evento espontâneo (ou seja, sem a intervenção humana) que tem como resultado a introdução do organismo causante no corpo, como ao beber água contaminada com Salmonella typhi, o agente causante da febre tifoide. Em tais situações o organismo causante denomina-se inóculo, e o número de organismos introduzidos "dose do inóculo".
- ↑ A "especificidade" implica que dois patógenos diferentes serão vistos pelo sistema imunológico como duas entidades diferentes, e serão neutralizados usando diferentes moléculas de anticorpos solúveis.
- ↑ Proliferação neste contexto significa multiplicação por mitose e diferenciação.
- ↑ O complexo principal de histocompatibilidade é uma região genética no ADN que codifica a síntese de moléculas do complexo principal de histocompatibilidade de classe I e de classe II e outras proteínas envolvidas no funcionamento do sistema do complemento (MHC de classe III). Os primeiros dois produtos são importantes na apresentação de antígenos. A compatibilidade do MHC é algo essencial para realizar transplantes de órgãos, e nos humanos também se chama antígeno leucocitário humano (HLA).
- ↑ Aqui, intactas significa que se reconhece a proteína não-digerida e não que o parátopo do receptor da célula B se ponha ao mesmo tempo em contacto com a estrutura completa da proteína; o parátopo permanecerá em contacto só com uma porção restringida do antígeno exposto na sua superfície.
- ↑ Existem muitos tipos de células sanguíneas. A forma mais comum de classificá-las é de acordo com a sua aparência vista ao microscópio óptico depois de serem tingidas com corantes químicos. No entanto, com o avanço da tecnologia apareceram novos métodos de classificação. Um deles emprega anticorpos monoclonais, que podem unir-se especificamente a cada tipo de célula. Além disso, o mesmo tipo de glóbulo branco expressa moléculas típicas suas na sua membrana plasmática em vários estádios do seu desenvolvimento. Os anticorpos monoclonais que podem ligar-se especificamente com uma determinada molécula da superfície celular são considerados um grupo ou cluster de diferenciação (CD). Qualquer anticorpo monoclonal ou grupo de anticorpos monoclonais que não reagem com moléculas da superfície dos linfócitos conhecidas, senão apenas com uma molécula da superfície ainda não reconhecida seria considerado um novo cluster de diferenciação e dar-se-lhe-ia um número. Cada cluster de diferenciação abrevia-se como CD seguido de um número (que geralmente indica a ordem da sua descoberta). Assim, uma célula que possua uma molécula de superfície (ligante) que se liga especificamente a um cluster de diferenciação 4 denominar-se-ia célula CD4+. Da mesma forma, uma célula CD8+ será aquela que possui o ligante CD8 e se ligue a anticorpos monoclonais CD8.
- ↑ As células plasmáticas segregam anticorpos que se ligam à mesma estrutura que estimulou a célula B em primeiro lugar, ao ligar-se ao seu receptor da célula B.
- ↑ Analogamente, se num lugar lotado, assumimos que devemos reconhecer uma determinada pessoa, é bom que saibamos tantas características físicas dessa pessoa quanto for possível. Se conhecemos a pessoa apenas para o corte de cabelo, existe a possibilidade de não reconhecermos essa pessoa caso esta altere o seu penteado. Entretanto, se para além do corte de cabelo, conhecemos os traços faciais e as roupas que vai levar num determinado dia, será muito mais fácil que ela não nos passe despercebida.
Referências
- ↑ a b c d e f g h Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). «Antigens (Chapter 3)». Immunology Fifth ed. Nova Iorque: W. H. Freeman and Company. pp. 57–75. ISBN 0716749475
- ↑ «Definition of Polyclonal from MedicineNet.com». Webster's New World Medical Dictionary. Consultado em 3 de maio de 2008
- ↑ a b Frank, Steven A. (2002). «Specificity and Cross-Reactivity (Chapter 4)». Immunology and Evolution of Infectious Disease. [S.l.]: Princeton University. pp. 33–56. ISBN 0691095957. Consultado em 23 de junho de 2008
- ↑ «Etymology of "clone"». Online etymology dictionary. Consultado em 26 de junho de 2008
- ↑ Bansal, R.K. (2005). «Reproductive Cloning-An Act Of Human Rights Violation» (PDF). Indian Association of Forensic Medicine. Journal of Indian Association of Forensic Medicine. 27 (3): 971–973. Consultado em 23 de junho de 2008. Arquivado do original (PDF) em 23 de março de 2017
- ↑ «Definition of inoculation» (em inglês). TheFreeDictionary.com (citing Dorland's Medical Dictionary for Health Consumers. © 2007 by Saunders, an imprint of Elsevier, Inc.). Consultado em 10 de junho de 2008
- ↑ a b c Pier, Gerald B. (2005) [1945]. «Molecular mechanisms of microbial pathogenesis (Capítulo 105)». In: Kasper, Braunwald, Fauci, Hauser, Longo, Jameson. Harrison's Principles of Internal Medicine (em inglês). 1 Sixteenth ed. [S.l.]: McGraw-Hill. 700 páginas. ISBN 0-07-123983-9
- ↑ a b c d e Goldsby. «Organization and Expression of Immunoglobulin Genes (Chapter 5)». Immunology Fifth ed. Nova Iorque: [s.n.] pp. 105–136. ISBN 0-7167-6764-3
- ↑ Nairn, Roderick (2004) [1954]. «Immunology (Capítulo 8)». In: Geo F. Brooks; Janet S. Butel; Stephen A. Morse. Jawetz, Melnick, & Adelberg's Medical Microbiology (em inglês) Twenty-Third Edition International ed. [S.l.]: Lange publications/McGraw-Hill. pp. 133–135, 138–139. ISBN 0-07-123983-9
- ↑ a b c Goldsby. «T-Cell Maturation, Activation and Differentiation (Chapter 10)». Immunology Fifth ed. [S.l.: s.n.] pp. 221–246. ISBN 0-7167-6764-3
- ↑ Nair, Deepak; Singh Kavita; Siddiqui Zaved; Nayak Bishnu; Rao Kanury; Salunke Dinakar (9 de janeiro de 2002). «Epitope Recognition by Diverse Antibodies Suggests Conformational Convergence in an Antibody Response» (PDF). The American Association of Immunologists. The Journal of Immunology (em inglês). 168 (5): 2371–2382. PMID 11859128. doi:10.4049/jimmunol.168.5.2371. Consultado em 3 de maio de 2008
- ↑ «Immunochemical Applications». Technical Tips. EMD biosciences. Consultado em 7 de maio de 2008. Arquivado do original em 11 de abril de 2008
- ↑ Davis, Cheryl. «Antigens». Biology course. Western Kentucky University. Consultado em 12 de maio de 2008. Arquivado do original em 29 de março de 2008
- ↑ Ceri, Howard. «Antigens». Immunology course (em inglês). University of Calgary. Consultado em 12 de maio de 2008. Arquivado do original em 5 de outubro de 2008
- ↑ Khudyakov, Yury; Howard A. Fields (2002). Artificial DNA: Methods and Applications (em inglês). Florida: CRC Press. 227 páginas. ISBN 0-8493-1426-7
- ↑ a b c d e f g Goldsby. «Overview of the Immune System (Capítulo 1)». Immunology Fifth ed. [S.l.: s.n.] pp. 1–23. ISBN 0-7167-6764-3
- ↑ Goldsby. «Antigen Processing and Presentation (Chapter 8)». Immunology Fifth ed. [S.l.: s.n.] pp. 188–194. ISBN 0-7167-6764-3
- ↑ a b Ojcius, DM; L Gapin; JM Kanellopoulos; P Kourilsky (Setembro de 1994). «Is antigen processing guided by major histocompatibility complex molecules?» (PDF). The FASEB Journal. 8 (5): 974–978. PMID 8088463. Consultado em 20 de junho de 2008
- ↑ Goldsby. «Cells and Organs of the Immune System (Chapter 2)». Immunology Fifth ed. [S.l.: s.n.] pp. 24–56. ISBN 0-7167-6764-3
- ↑ a b Myers, CD (1991). «Role of B cell antigen processing and presentation in the humoral immune response» (PDF). The FASEB Journal. 5 (11): 2547–2553. PMID 1907935. Consultado em 20 de junho de 2008
- ↑ a b c d e f g h i j k Goldsby. «B-Cell Generation, Activation and Differentiation (Chapter 11)». Immunology Fifth ed. Nova Iorque: [s.n.] pp. 247–275. ISBN 0-7167-6764-3
- ↑ McPhee, Stephen; Ganong, William (2006). Pathophysiology of Disease: An Introduction to Clinical Medicine. [S.l.]: Lange Medical Books/McGraw-Hill. 39 páginas. ISBN 0-07-144159-X
- ↑ Cziko, Gary (1995). «The Immune System: Selection by the Enemy». Without Miracles: Universal Selection Theory and the Second Darwinian Revolution Fifth ed. Massachusetts: MIT Press. pp. 39–48. ISBN 0-262-03232-5. Consultado em 12 de maio de 2008. Arquivado do original em 19 de abril de 2012
- ↑ Greener, Mark (14 de fevereiro de 2005). «Monoclonal antibodies (MAbs) turn 30». Philadelphia: SAGE Publications. The Scientist. 19 (3). 14 páginas. Consultado em 6 de junho de 2008. Arquivado do original em 31 de agosto de 2007
- ↑ Deem, Michael. «Michael W. Deem». Official Web Page. Rice University. Consultado em 8 de maio de 2008
- ↑ Granholm, Norman; Tito Cavallo (1992). «Autoimmunity, Polyclonal B-Cell Activation and Infection (abstract)». SAGE Publications. Lupus. 1 (2): 63–74. PMID 1301966. doi:10.1177/096120339200100203. Consultado em 4 de maio de 2008
- ↑ Montes CL, Acosta-Rodríguez EV, Merino MC, Bermejo DA, Gruppi A. «Polyclonal B cell activation in infections: infectious agents' devilry or defense mechanism of the host? (abstract)». Society for Leukocyte Biology. Journal of Leukocyte Biology (em inglês). 82 (5): 1027–1032. PMID 17615380. doi:10.1189/jlb.0407214. Consultado em 4 de maio de 2008. Arquivado do original em 13 de abril de 2009
- ↑ «Emil von Behring: The Founder of Serum Therapy». Nobel Prize in Medicine (em inglês). Consultado em 23 de junho de 2008. Arquivado do original em 12 de junho de 2008
- ↑ Mage, Rose G.; Ten Feizi. «Elvin A. Kabat». Biographical memoirs. Consultado em 23 de junho de 2008
- ↑ a b c d Greenberg, Steven. «A Concise History of Immunology» (PDF). Consultado em 23 de junho de 2008
- ↑ «MTC News» (PDF). Karolinska Institutet. Consultado em 23 de junho de 2008
- ↑ Turner, Stephen (Outubro de 2007). «One POWERFUL Idea» (PDF). Australasian Science. Consultado em 23 de junho de 2008. Arquivado do original (PDF) em 21 de julho de 2008
Bibliografia[editar | editar código-fonte]
- Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). Immunology (em inglês) Fifth ed. Nova Iorque: W. H. Freeman and Company. ISBN 0-7167-4947-5
- Kishiyama, Jeffery L. (2006) [1997]. «Disorders of the Immune system (Chapter 3)». In: Stephen J. McPhee; William F. Ganong. Pathophysiology of Disease: An Introduction to Clinical Medicine (em inglês) 5 ed. [S.l.]: Lange Medical Books/McGraw-Hill. pp. 32–58. ISBN 0-07-110523-9
- Nairn, Roderick (2004) [1954]. «Immunology (Chapter 8)». In: Geo F. Brooks; Janet S. Butel; Stephen A. Morse. Jawetz, Melnick, & Adelberg's Medical Microbiology (em inglês) Twenty-Third Edition International ed. [S.l.]: Lange publications/McGraw-Hill. pp. 133–135, 138–139. ISBN 0-07-123983-9
Ligações externas[editar | editar código-fonte]
- An Introduction to the Immune system (em inglês)


 French
French Deutsch
Deutsch