Бактериальные системы секреции — Википедия
Бактериа́льные систе́мы секре́ции (англ. Bacterial secretion systems) — белковые комплексы, расположенные в клеточной мембране бактерий и служащие для секреции различных белков. В частности, их используют патогенные бактерии для выделения факторов вирулентности. На основании состава, структуры и действия системы секреции делят на несколько типов. Наиболее фундаментальные различия наблюдаются между системами секреции грамположительных и грамотрицательных бактерий. Существует по меньшей мере шесть типов систем секреции, специфичных для грамотрицательных бактерий, четыре типа систем секреции уникальны для грамположительных бактерий, а два типа систем секреции имеются у обеих групп бактерий[1].
Общие системы секреции[править | править код]
Системы секреции типов Sec и Tat присущи грамположительным и грамотрицательным бактериям, а также археям и эукариотам. Хотя системы Sec и Tat имеют некоторые общие компоненты, механизмы их работы фундаментально различаются. Обе системы предназначены для секреции через клеточную мембрану. У грамотрицательных бактерий белки, доставленные системами Sec или Tat в мембрану клетки или периплазматическое пространство (периплазму), могут быть выделены из клетки другими системами секреции[1].
Sec[править | править код]
Через систему Sec переносятся преимущественно неуложенные белки. Особые белки-переносчики связываются в цитоплазме с белками-мишенями, имеющими соответствующий сигнал секреции на N-конце. Он состоит из 20 аминокислотных остатков и содержит три участка: положительно заряженный N-конец, гидрофобный коровый участок и полярный C-конец. Белки-переносчики доставляют мишени к моторным белкам, которые проталкивают секретируемые белки наружу через канал SecYEG. У некоторых грамположительных бактерий имеются дополнительные белки системы Sec. Система Sec используется для выделения факторов вирулентности такими грамотрицательными патогенными бактериями, как Vibrio cholerae, Klebsiella pneumoniae и Yersinia enterocolitica. Примером грамположительных бактерий, использующих систему Sec для выделения факторов вирулентности, могут служить Staphylococcus aureus и Listeria monocytogenes. Белки, предназначенные для выделения в периплазму или во внеклеточную среду, секретируются системой SecB. Белки, предназначенные для внутренней мембраны, выделяются системой SRP. Системы подтипов SecB и SRP распознают разные сигнальные последовательности[1].
SecB[править | править код]
Белки-мишени системы SecB имеют сигнальную последовательность, которая распознаётся белком SecB, плавающим в цитоплазме. Он функционирует как шаперон, препятствующий фолдингу белков-мишеней. SecB доставляет белки-мишени к белку SecA, который проталкивает их через канал SecYEG, используя для этого энергию гидролиза АТФ, который сам же и катализирует. Белки, которые должны выйти во внешнюю среду, выделяются наружу системами II или V типа[1].
SRP[править | править код]
Системы SRP доставляют белки-мишени в клеточную мембрану. Трансмембранные белки, которые и являются мишенями системы SRP, имеют гидрофобные участки и поэтому нестабильны в цитоплазме. Поэтому в пути SRP секреция белка происходит котрансляционно: синтезированный участок полипептидной цепи проталкивается в канал SecYEG, в то время как рибосома транслирует оставшуюся часть белка. Для этого механизма необходимы частицы распознавания сигнала (англ. signal recognition particle, SRP). SRP связываются с трансмембранным участком белка, как только он выходит из рибосомы. Далее SRP взаимодействует с белком FtsY, который доставляет комплекс мРНК, рибосомы и частично синтезированного полипептида к каналу SecYEG. Далее постепенная секреция белка и трансляция его оставшейся части идут одновременно, и, наконец, белок заякоривается в клеточной мембране своим трансмембранным доменом[1].
Tat[править | править код]
В отличие от пути Sec, по пути Tat секретируются преимущественно уложенные белки. Как правило, к ним относятся белки, для функционирования которых необходимы специфические посттрансляционные модификации, которые можно получить только в цитозоле. В систему Tat входят три белка: TatA, TatB и TatC, причём первые два у грамположительных бактерий объединены в единый белок. У Escherichia coli сигнальный пептид белков, предназначенных для секреции, распознают белки TatB и TatC, а TatA формирует мембранный канал. Сигнальный пептид, распознаваемый белками Tat, представлен последовательностью серин-аргинин-аргинин на N-конце белка. У грамположительных бактерий система Tat обеспечивает выход белков во внеклеточную среду, а у грамотрицательных белки, прошедшие через Tat, либо остаются в периплазматическом пространстве, либо выходят из клетки через системы секреции II типа. Система Tat необходима для полной вирулентности некоторым патогенным бактериям, в числе которых Pseudomonas aeruginosa, Yersinia pseudotuberculosis и E. coli O157:H7. У ряда патогенов, таких как P. aeruginosa, Legionella pneumophila и Mycobacterium tuberculosis, через систему Tat секретируется фосфолипаза C, которая разрушает фосфолипиды и задействована в подавлении активности иммунной системы[1].
Системы секреции грамотрицательных бактерий[править | править код]
У некоторых патогенных грамотрицательных бактерий существуют специальные системы секреции, которые выводят факторы вирулентности наружу, а иногда и в другие эукариотические или прокариотические клетки. Многие белки, которые переносятся через внешнюю мембрану грамотрицательных бактерий, попали в периплазму через пути Sec или Tat. Некоторые системы секреции представлены единым каналом, проходящим через две мембраны и периплазматическое пространство[1].
Системы секреции I типа[править | править код]

Система секреции I типа предполагает одношаговый перенос белка из цитозоля во внеклеточную среду посредством канала, проходящего через обе мембраны и периплазму. Каналы систем I типа очень близки к ABC-транспортерам, которые выводят из клеток разнообразные малые молекулы, такие как антибиотики и токсины. У некоторых бактерий одновременно имеется несколько систем I типа, каждая из которых предназначена для секреции одного или нескольких белков. Белки, секретируемые системами I типа, очень разнообразны: среди них есть разрушающие ферменты, такие как протеазы и липазы, молекулы адгезии, гем-связывающие белки. В большинстве случаев белки-мишени имеют C-концевой сигнальный пептид, который не удаляется при секреции[1].
В типичном случае система секреции I типа организована следующим образом. В клеточной мембране находится ABC-транспортер, расщепляющий АТФ и добывающий энергию для переноса белка. Он взаимодействует с белком MPF, который переходит через периплазму и взаимодействует с белком OMF во внешней мембране. N-конец MPF свешивается в цитозоль и, как предполагают, участвует в распознавании сигнала. OMF формирует пору во внешней мембране, через которую и проходит белок[1].
Системы секреции I типа необходимы для вирулентности ряда патогенных бактерий, например, Vibrio cholerae и Serratia marcescens. Кроме того, посредством этой системы E. coli выводит наружу колицин V, а её уропатогенные штаммы с помощью системы I типа выводят гемолизин, разрушающий мембраны эукариотических клеток[1].
Системы секреции II типа[править | править код]

Системы секреции II типа занимаются транспортом белков из периплазмы во внешнюю среду. Белки-мишени должны быть предварительно доставлены в периплазму системами Sec или Tat, кроме того, они должны нести подлежащие удалению N-концевые сигнальные пептиды, которые распознают системы Sec и Tat. Однако белки-мишени должны быть уложены в периплазме перед выведением через системы II типа. Системы II типа выводят из клетки белки с разными функциями, но большинство из них составляют ферменты: протеазы, липазы, фосфатазы, ферменты, действующие на углеводы. Система секреции II типа образована 15 белками. Комплекс во внешней мембране формирует мультимерный белок секретин. Его длинный N-конец взаимодействует с другими белками системы, локализованными в клеточной мембране. В клеточной мембране система секреции II типа представлена платформой из по меньшей мере 4 белков. В цитоплазме находится АТФаза, снабжающая систему энергией. Считается, что белки-субстраты проталкиваются через секретиновый комплекс особой белковой структурой — псевдопилем, который близок к пилям IV типа. Посредством системы секреции II типа V. cholerae выводит наружу холерный токсин, а P. aeruginosa — эндотоксин A. Ряд патогенов через системы II типа выводят наружу белки, помогающие им адаптироваться к окружающей среде. К таким патогенам относятся L. pneumophila, энтеротоксигенные и энтерогеморрагические штаммы E. coli (ETEC и EHEC), K. pneumoniae, Aeromonas hydrophila и Dickeya dadantii[1].
Системы секреции III типа[править | править код]

Системы секреции III типа изучены очень подробно[2]. Они обеспечивают секрецию разнообразных белков через обе мембраны и периплазму. В большинстве случаев системы секреции III типа доставляют субстраты прямо в эукариотическую клетку, то есть переносят белки сразу через три мембраны. Субстраты систем III типа называют эффекторными белками. Некоторые патогены, такие как Pseudomonas и Yersinia, выделяют всего несколько эффекторных белков, а Shigella — несколько десятков. Белки-субстраты имеют N-концевой сигнальный пептид, не подлежащий удалению. Многие эффекторные белки перед секрецией взаимодействуют с шаперонами и секретируются неуложенными с затратой энергии АТФ[1].
Система секреции III типа включает 9 коровых белков, причём восемь из них родственны флагеллину, из которого состоит бактериальный жгутик. Помимо 9 коровых белков, в состав системы III типа входят от 10 до 20 дополнительных белков, некоторые из которых критически важны для работы системы. Белки систем III типа кодируются несколькими оперонами, которые находятся или на плазмидах, или в островках патогенности на бактериальной хромосоме. Системы III типа передаются между бактериями посредством горизонтального переноса генов и потому часто выявляются у неродственных видов[1].
Структурно в системе III типа можно выделить базальный комплекс, игольчатый компонент и транслокон. Базальный комплекс проходит через клеточную мембрану, периплазматическое пространство и внешнюю мембрану, формируя розетковидную структуру. Чаще всего базальный комплекс образуют по меньшей мере 15 белков. Из розетки выходит палочковидный филамент, называемый иглой. Игла обращена во внеклеточное пространство, полая внутри и имеет достаточный диаметр, чтобы через неё мог пройти неуложенный белок. На конце иглы находится специальный комплекс, который определяет близость эукариотической клетки и регулирует секрецию эффекторных белков. Этот же комплекс отвечает за вставку транслокона в мембрану эукариотической клетки. Транслокон содержит пору, через которую бактериальный белок проникает в эукариотическую клетку[1].
Системы III типа используются многими патогенами, например, Yersinia, Salmonella и Shigella[1]. Посредством систем секреции этого типа выделяются компоненты жгутика. Родство флагеллина и белков системы III типа указывает на общность их происхождения[3][4].
Системы секреции IV типа[править | править код]

Эволюционно системы секреции IV типа близки к белковому аппарату конъюгации и осуществляют секрецию как одиночных белковых молекул, так и белковых комплексов и комплексов белков и ДНК. Белки-субстраты секретируются непосредственно в другую клетку — бактериальную (того же вида или другого вида) или эукариотическую. Так как системы IV типа могут переносить комплексы белков и ДНК, они могут быть задействованы в переносе ДНК при конъюгации, выделении ДНК или её поглощении, а также доставке эффекторных белков или комплексов белков с ДНК непосредственно в клетку-реципиента. С помощью системы IV типа Agrobacterium tumefaciens доставляет онкогенную T-ДНК в растительные клетки; эту систему называют VirB/D. Белки VirB6-10 формируют канал, проходящий через клеточную и внешнюю мембраны, причём VirB4, VirB11 и VirD4 расположены в клеточной мембране и, будучи АТФазами, снабжают транспорт энергией. Внеклеточный пиль образован белками VirB2 и VirB5. Считается, что VirD4 играет роль «ворот» и не даёт попасть в канал нецелевым белкам. Роль пиля также неясна. Согласно одной гипотезе, он предназначен только для связи с клеткой-реципиентом, согласно другой — он играет непосредственную роль в переносе белка в клетку-реципиента[1].
Системы IV типа используются разнообразными патогенами человека: Neisseria gonorrhoeae, L. pneumophila, Brucella suis и Helicobacter pylori[1].
Системы секреции V типа[править | править код]
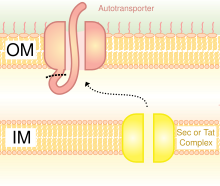
Компоненты системы секреции V типа уникальны тем, что они сами же и секретируются без участия вспомогательных белков-каналов. У них имеется структура типа β-бочонок, которая пронизывает внешнюю мембрану насквозь. Через неё наружу выходит остальная часть белка или другие белки. Белки системы V типа доставляются в периплазму системой Sec и потому несут соответствующий N-концевой сигнальный пептид, который удаляется в периплазме. Большинство субстратов систем V типа — факторы вирулентности. У N. gonorrhoeae таким образом транспортируется протеаза, разрушающая антитела; у Shigella flexneri — белок, играющий роль молекулы адгезии, а у Y. enterocolitica — белок, способствующий работе системы секреции III типа[1].
Системы секреции VI типа[править | править код]

Системы секреции VI типа транспортируют белки преимущественно в бактериальные клетки, но иногда и в эукариотические. Эти системы могут передавать белки от одной бактерии к другой, что может служить средством общения бактерий. Системы VI типа очень крупные, содержат до 21 белка, гены которых собраны в целый кластер. Тринадцать из них наиболее консервативны и, видимо, обеспечивают структуру аппарата секреции. Любопытно, что системы VI типа структурно гомологичны хвостам бактериофагов, поэтому было высказано предположение, что они произошли от перевёрнутых хвостов фагов, которые выделяют белки наружу, а не впрыскивают внутрь клетки. Вероятно, системы VI типа используются и патогенами: в лабораторных условиях они обнаруживались у патогенных P. aeruginosa, V. cholerae и S. marcescens, однако детали их функционирования неясны[1].
Системы секреции грамположительных бактерий[править | править код]
У грамположительных бактерий нет внешней мембраны, зато имеется существенно более толстый, чем у грамотрицательных бактерий, слой пептидогликана. Кроме того, у некоторых грамположительных бактерий, таких как Mycobacterium, клеточная стенка обогащена липидами, из-за чего её даже называют микомембраной. По этим причинам механизмы секреции белков у грамположительных бактерий значительно отличаются от таковых у грамотрицательных бактерий. Однако пути Sec и Tat есть и у грамположительных, и у грамотрицательных бактерий[1].

SecA2[править | править код]
У многих грамположительных бактерий вместо одного белка SecA системы Sec имеется два белка — SecA1 и SecA2. К числу таких бактерий относятся L. monocytogenes, Bacillus subtilis, Clostridium difficile, M. tuberculosis и Corynbacteria glutamicum. Белок SecA1 участвует в системе Sec и жизненно необходим, а SecA2 нужен только иногда и секретирует белки, связанные со стрессовым ответом, модификациями клеточной стенки, репарацией и метаболизмом. У некоторых бактерий он вносит вклад в вирулентность. Субстраты SecA2 выделяются SecYEG, хотя нельзя исключать возможность взаимодействия SecA2 с другими транспортными белками. У некоторых представителей родов Streptococcus и Staphylococcus имеется вторая система Sec, которую называют aSec или SecA2-SecY2. В состав этих систем не только входит SecA2, но и вспомогательные белки — SecY2, играющий роль канала, и по меньшей мере ещё три белка Sec. Через системы aSec обычно секретируются крупные, обильно гликозилированные белки, связанные с клеточной стенкой[1].
Сортазы[править | править код]
Сортазами называют ферменты, которые ковалентно пришивают белки к клеточной стенке после того, как они пройдут клеточную мембрану. Практически все грамположительные бактерии экспрессируют множество сортаз с различной специфичностью. Связывание белка с клеточной стенкой происходит в ходе реакции транспептидации, катализируемой сортазами. Белки-мишени сортаз переносятся через мембрану белками системы Sec[1].
Инжектосомы[править | править код]
Инжектосомы грамположительных бактерий функционально аналогичны системам секреции III и IV типов у грамотрицательных бактерий. Например, Streptococcus pyogenes впрыскивает по меньшей мере один фактор вирулентности, NAD+-гликогидролазу, в цитоплазму кератиноцитов именно по механизму работы этих систем. В эукариотической клетке NAD-гликогидролаза разрушает гликозидную связь в NAD+, в результате чего образуются никотинамид и АДФ-рибоза — важный вторичный посредник, который может нарушить сигнальные пути клетки. Формирование поры в мембране эукариотической клетки осуществляет белок SLO, который предварительно секретируется системой Sec[1].
Системы секреции VII типа[править | править код]
Системы секреции VII типа обнаруживаются у бактерий, клеточные стенки которых сильно обогащены липидами и называются микомембранами, — например, у видов родов Mycobacterium и Corynebacterium. Системы VII типа осуществляют транспорт белков через клеточную мембрану и микомембрану. Похожие системы были идентифицированы у ряда бактерий, не имеющих микомембран, например, S. aureus, Bacillus anthracis и L. monocytogenes. Первые системы VII типа были обнаружены у M. tuberculosis и получили название ESX-систем. Коровые компоненты системы — EccB, EccC, EccD, EccE и MycP — являются мембранными белками, они взаимодействуют с пептидогликаном и цитозольными белками, например, шаперонами. EccA, вероятно, снабжает систему энергией. Четыре белка Ecc, по-видимому, формируют канал в клеточной мембране. Механизмы транспорта белков через мембрану всё ещё неизвестны[1].

Взаимодействие систем секреции и иммунной системы[править | править код]
Врождённый иммунитет млекопитающих располагает рядом механизмов для распознавания бактериальных систем секреции и их субстратов. Например, близость бактериальных систем секреции можно установить по наличию в цитозоле веществ бактериального происхождения: пептидогликана, флагеллина, липополисахарида (LPS). Они распознаются клеточными рецепторами, которые и запускают иммунные реакции. Например, Nod-подобные рецепторы распознают флагеллин и LPS и запускают сигнальные каскады, которые в конце концов приводят к образованию воспалительных цитокинов. Иммунная система может даже отслеживать процесс транслокации бактериальных белков в эукариотическую клетку. Так, макрофаги могут улавливать воздействие эффекторного белка YopE системы III типа Yersinia на ГТФазы Rho и запускают иммунный ответ. Иммунные клетки могут обнаруживать внедрение порообразующих бактериальных белков в мембраны клеток организма-хозяина. Например, когда белок SLO S. pyogenes внедряется в мембрану, происходит активация Nod-подобного рецептора NLRP3. Кроме того, имеются сведения, что иммунная система умеет обнаруживать компоненты систем секреции, которые торчат на поверхности бактериальной клетки[1].
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Green E. R., Mecsas J. Bacterial Secretion Systems: An Overview. (англ.) // Microbiology Spectrum. — 2016. — February (vol. 4, no. 1). — doi:10.1128/microbiolspec.VMBF-0012-2015. — PMID 26999395.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 938.
- ↑ Gophna U., Ron E. Z., Graur D. Bacterial type III secretion systems are ancient and evolved by multiple horizontal-transfer events. (англ.) // Gene. — 2003. — 17 July (vol. 312). — P. 151—163. — PMID 12909351.
- ↑ Nguyen L., Paulsen I. T., Tchieu J., Hueck C. J., Saier Jr. M. H. Phylogenetic analyses of the constituents of Type III protein secretion systems. (англ.) // Journal Of Molecular Microbiology And Biotechnology. — 2000. — April (vol. 2, no. 2). — P. 125—144. — PMID 10939240.
Литература[править | править код]
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |


 French
French Deutsch
Deutsch