GLUT4 — Википедия
GLUT4 (ГЛЮТ-4, глюкозный транспортёр тип 4), также известный как SLC2A4 (сокр. от англ. solute carrier family 2, facilitated glucose transporter member 4) — инсулинзависимый белок-переносчик глюкозы, осуществляет перенос глюкозы, посредством облегчённой диффузии через клеточную мембрану под контролем инсулина. Содержится в отсутствии инсулина почти полностью в цитоплазме[1]. Впервые был обнаружен в клетках жировой ткани и мышечной ткани (скелетные мышцы и миокард). Свидетельство об открытии нового глюкозного транспортёра принадлежит цитологу Дэвиду Джеймсу, который предоставил его в 1988 году[2]. Ген, кодирующий GLUT4 был клонирован[3][4] и картирован в 1989[5]. Ген, кодирующий данный белок у человека — SLC2A4, расположен в 17 хромосоме.
GLUT4 — единственный инсулинзависимый глюкозный транспортёр.
На поверхности клеток GLUT4 обеспечивает облегчённую диффузию циркулирующей глюкозы, по её градиенту концентрации в мышечные и жировые клетки. Попадая в клетки, глюкоза быстро фосфорилируется глюкокиназой в печени и гексокиназой в других тканях с образованием глюкозо-6-фосфата, который затем вступает в гликолиз или полимеризуется в гликоген. Глюкозо-6-фосфат не может диффундировать обратно из клеток, что также служит для поддержания градиента концентрации глюкозы и пассивного транспорта в клетки[6].
Недавние сообщения показали наличие гена GLUT4 в некоторых участках центральной нервной системы, таких как гиппокамп. Кроме того, ухудшение в инсулинстимулированном обороте GLUT4 в гиппокампе, может привести к снижению метаболической активности и пластичности нейронов гиппокампа, проявляющихся в депрессивных, поведенческих и когнитивных дисфункциях[7][8][9].
Распределение по тканям
[править | править код]GLUT4 локализован и экспрессируется в следующих тканях:
- Скелетные мышцы
- Миокард
- Жировая ткань
Скелетные мышцы
[править | править код]
В клетках поперечно-полосатых мышц концентрация GLUT4 в плазматической мембране может увеличиваться в результате физической нагрузки или мышечного сокращения.
Во время тренировки организму необходимо преобразовывать глюкозу в АТФ для использования в качестве энергии. Когда концентрация G-6-P снижается, гексокиназа становится менее ингибированной, и гликолитический и окислительный пути, которые синтезируют АТФ, могут продолжать действовать. Это также означает, что мышечные клетки способны принимать больше глюкозы при снижении её внутриклеточной концентрации. Чтобы повысить уровень глюкозы в мышечной клетке, GLUT4 является основным транспортёром, используя механизм облегчённой диффузии[11].
Хотя мышечные сокращения функционируют сходным образом и также вызывают транслокацию GLUT4 в плазматическую мембрану, в двух скелетных мышцах образуются разные формы внутриклеточного GLUT4. Везикулы-переносчики GLUT4 являются либо трансферрин-положительными, либо трансферрин-негативными и рекрутируются под действием различных стимулов. Трансферрин-положительные везикулы GLUT4 задействуются во время мышечного сокращения, в то время как трансферрин-негативные везикулы активируются при стимуляции инсулином, а также при усиленном сокращении мышц, происходящих при физических нагрузках[12][13].
Сердечная мышца (миокард)
[править | править код]Миокард несколько отличается от скелетной мускулатуры. В состоянии покоя он предпочитают использовать жирные кислоты в качестве основного источника энергии. По мере увеличения активности и ускорения работы сердечная мышца начинает окислять глюкозу с большей скоростью[14].
Анализ уровней мРНК GLUT1 и GLUT4 в миокарде показал, что GLUT1 играет большую роль в сердечной мышце, чем в скелетных[15]. Однако GLUT4 по-прежнему считается основным транспортёром глюкозы[16].
Как и в других тканях, GLUT4 также реагирует на сигналы инсулина и перемещается в плазматическую мембрану, где путём облегчённой диффузии способствует движению глюкозы внутрь кардиомиоцита[17][18].
Жировая ткань
[править | править код]Жировая ткань, также известная как просто жир[19], является хранилищем энергии для сохранения метаболического гомеостаза. Когда организм получает энергию в виде глюкозы, часть её расходуется, а остальное депонируется в виде гликогена (в основном в печени, мышечных клетках) или в виде триацилглицеридов в жировой ткани[20].
Было доказано, что дисбаланс между потреблением глюкозы и расходом энергии приводит к гипертрофии и гиперплазии жировых клеток, что приводит к ожирению[21]. Кроме того, мутации в генах GLUT4 в адипоцитах могут приводить к повышенной экспрессии GLUT4 в них, что позволяет увеличить поглощение глюкозы и, следовательно, больше депонировать жира. Если GLUT4 экспрессируется чрезмерно, он может фактически изменить распределение питательных веществ и направить избыток глюкозы в жировую ткань, что приводит к увеличению массы жировой ткани[21].
Доменная структура
[править | править код]
GLUT4 представляет собой трансмембранный белок, состоящий из 509 аминокислотных остатков, а молекулярная масса составляет — 54787 Да[23]. Четвертичная структура включает в себя 12 трансмембранных доменов. N- и С-концевая части располагаются внутри цитоплазмы.
Как и у всех белков, уникальное расположение аминокислот в первичной последовательности GLUT4 позволяет ему переносить глюкозу через плазматическую мембрану. Считается, что помимо фенилаланина на N-конце, два остатка лейцина и кислые мотивы на COOH-конце играют ключевую роль в кинетике эндоцитоза и экзоцитоза[24].
Другие белки ГЛЮТ
[править | править код]Всего существует 14 белков GLUT, разделённых на 3 класса на основе сходства последовательностей. Класс 1 состоит из белков GLUT 1-4 и 14, класс 2 содержит белки GLUT 5, 7, 9 и 11, а класс 3 — белки GLUT 6, 8, 10, 12 и 13.
Хотя между всеми белками GLUT есть некоторые различия в последовательности, все они имеют некоторые основные структурные компоненты. Например, N- и C-концевые участки белков GLUT выходят в цитоплазму клетки, и все они имеют 12 трансмембранных сегментов[25].
Выполняемые функции
[править | править код]Перенос глюкозы во внутриклеточное пространство, посредством инсулинстимулированного сигнала.
Регуляция
[править | править код]Осуществляется непосредственно инсулином.

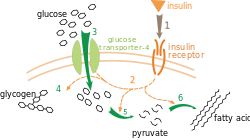
В условиях низкого инсулина в клетках жировой и мышечной ткани большинство молекул GLUT4 (более 90 %) отделены от цитоплазматической мембраны в виде внутриклеточных везикул, состоящих из белков, таких как инсулинзависимая аминопептидаза, везикулярного белка — синаптобревина (известный ещё как v-SNARE) и небольшого ГТФ-связывающего белка — Rab-4. При воздействии инсулина начинается процесс быстрой транслокации (перемещения) везикул ГЛЮТ-4 к цитоплазматической мембране, где они закрепляются, образуя комплексы, включающие трансмембранный белок синтаксин-4 (известный как t-SNARE) и синаптобревин. Происходит процесс сливания везикул с цитоплазматической мембраной, увеличивая количество молекул ГЛЮТ-4 в ней и тем самым увеличивается скорость процесса переноса глюкозы внутрь клетки. ГТФ-связывающий белок Rab-4 покидает везикулу и движется в цитоплазму в ответ на стимуляцию инсулином. Как только происходит устранение инсулинового сигнала ГЛЮТ-4 интернализуется (передвигается внутрь), отпочковываясь в виде везикул окаймлённых клатрином, от цитоплазматической мембраны. ГЛЮТ-4 сравнительно легко проникают внутрь эндосомы, где происходит их ресортировка во внутриклеточные ГЛЮТ-4 содержащие везикулы.
Инсулин связывается с инсулиновым рецептором, который представляет собой тирозиновую протеинкиназу, то есть протеинкиназу, которая фосфорилирует как внутриклеточные домены рецептора по гидроксильной ОН-группе остатков тирозина (происходит так называемое аутофосфорилирование субстрата инсулинового рецептора IRS-1), так и внутриклеточные белки. Аутофосфорилирование субстрата инсулинового рецептора IRS-1 ведёт к усилению первичного сигнала. Эти субстраты образуют комплексы например с фосфоинозитид-3-киназой (ФИ-3-киназа, КФ 2.7.1), точнее с одной из регуляторных субъединиц (p85α), посредством SH2-доменов. Затем субъединица p85α связывается с каталитической субъединицой p110. Активация ФИ-3-киназы является звеном сигнального пути, стимулирующего транслокацию ГЛЮТ-4 из цитоплазмы в плазматическую мембрану, а следовательно — и трансмембранный перенос глюкозы в мышечные и жировые клетки.
На поверхности клетки, GLUT4 позволяет глюкозе, посредством облегчённой диффузии по градиенту концентрации проникать в мышечные и жировые клетки. После того, как глюкоза окажется внутри клетки, она быстро фосфорилируется глюкокиназами в печени или гексокиназами в других тканях, с образованием глюкозо-6-фосфата, который затем участвует либо в процессе гликолиза либо полимеризуется в гликоген. Глюкозо-6-фосфат не может диффундировать обратно из клеток, что также служит для поддержания градиента концентрации по отношению к глюкозе, чтобы она смогла диффундировать внутрь клетки, посредством пассивного транспорта[26].
Нарушения
[править | править код]Существуют несколько видов нарушений. Это генетические, связанные с мутациями в гене SLC2A4 и, последующей его экспрессией мутантного белка, и функциональные, связанные с нарушениями выполняемых функций.
Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
- передача сигнала инсулина о перемещении этого транспортёра к мембране;
- перемещение транспортёра в цитоплазме;
- включение в состав мембраны;
- отшнуровывание от мембраны и другие.
Все они могут привести к развитию инсулиновой резистентности и, последующим развитием сахарного диабета 2 типа.
Взаимодействия с другими белками
[править | править код]Недавние исследования показали, что GLUT4 взаимодействует с так называемым Death-ассоциированным протеином 6 — DAXX[27].
Примечания
[править | править код]- ↑ Е.С. Северин. Биология. — М.: ГЭОТАР-МЕД, 2004. — 779 с. — ISBN 5-9231-0254-4.
- ↑ James D.E., Brown R., Navarro J., Pilch P.F. Insulin-regulatable tissues express a unique insulin-sensitive glucose transport protein (фр.) // Nature : magazine. — 1988. — Mai (vol. 333, no 6169). — P. 183—185. — doi:10.1038/333183a0. — PMID 3285221.
- ↑ James D.E., Strube M., Mueckler M. Molecular cloning and characterization of an insulin-regulatable glucose transporter (англ.) // Nature : journal. — 1989. — March (vol. 338, no. 6210). — P. 83—7. — doi:10.1038/338083a0. — PMID 2645527.
- ↑ Birnbaum M.J. Identification of a novel gene encoding an insulin-responsive glucose transporter protein (англ.) // Cell. — Cell Press, 1989. — April (vol. 57, no. 2). — P. 305—315. — doi:10.1016/0092-8674(89)90968-9. — PMID 2649253.
- ↑ Bell G.I., Murray J.C., Nakamura Y., Kayano T., Eddy R.L., Fan Y.S., Byers M.G., Shows T.B. Polymorphic human insulin-responsive glucose-transporter gene on chromosome 17p13 (англ.) // Diabetes : journal. — 1989. — August (vol. 38, no. 8). — P. 1072—1075. — doi:10.2337/diabetes.38.8.1072. — PMID 2568955.
- ↑ Watson RT, Kanzaki M, Pessin JE (April 2004). "Regulated membrane trafficking of the insulin-responsive glucose transporter 4 in adipocytes". Endocrine Reviews. 25 (2): 177—204. doi:10.1210/er.2003-0011. PMID 15082519.
- ↑ Patel S.S., Udayabanu M. Urtica dioica extract attenuates depressive like behavior and associative memory dysfunction in dexamethasone induced diabetic mice (англ.) // Metabolic Brain Disease[англ.] : journal. — 2014. — March (vol. 29, no. 1). — P. 121—130. — doi:10.1007/s11011-014-9480-0. — PMID 24435938. Архивировано 31 марта 2017 года.
- ↑ Piroli G.G., Grillo C.A., Reznikov L.R., Adams S., McEwen B.S., Charron M.J., Reagan L.P. Corticosterone impairs insulin-stimulated translocation of GLUT4 in the rat hippocampus (англ.) // Neuroendocrinology : journal. — 2007. — Vol. 85, no. 2. — P. 71—80. — doi:10.1159/000101694. — PMID 17426391.
- ↑ Huang C.C., Lee C.C., Hsu K.S. The role of insulin receptor signaling in synaptic plasticity and cognitive function (англ.) // Chang Gung Medical Journal : journal. — 2010. — Vol. 33, no. 2. — P. 115—125. — PMID 20438663.
- ↑ Lodish, Harvey. 16.1: Oxidation of Glucose and Fatty Acids to CO2 // Molecular Cell Biology / Harvey Lodish, Arnold Berk, S. Lawrence Zipursky … [и др.]. — 4th. — New York : W. H. Freeman, 2000. — ISBN 978-0-7167-3706-3.
- ↑ Richter EA, Hargreaves M (July 2013). "Exercise, GLUT4, and skeletal muscle glucose uptake". Physiological Reviews (англ.). 93 (3): 993—1017. doi:10.1152/physrev.00038.2012. PMID 23899560.
- ↑ Ploug T, van Deurs B, Ai H, Cushman SW, Ralston E (September 1998). "Analysis of GLUT4 distribution in whole skeletal muscle fibers: identification of distinct storage compartments that are recruited by insulin and muscle contractions". The Journal of Cell Biology (англ.). 142 (6): 1429—46. doi:10.1083/jcb.142.6.1429. PMC 2141761. PMID 9744875.
- ↑ Lauritzen HP (April 2013). "Insulin- and contraction-induced glucose transporter 4 traffic in muscle: insights from a novel imaging approach". Exercise and Sport Sciences Reviews. 41 (2): 77—86. doi:10.1097/JES.0b013e318275574c. PMC 3602324. PMID 23072821.
- ↑ Morgan HE, Henderson MJ, Regen DM, Park CR (September 1959). "Regulation of glucose uptake in heart muscle from normal and alloxan-diabetic rats: the effects of insulin, growth hormone, cortisone, and anoxia". Annals of the New York Academy of Sciences. 82 (2): 387—402. Bibcode:1959NYASA..82..387M. doi:10.1111/j.1749-6632.1959.tb44920.x. PMID 14424107. S2CID 32458568.
- ↑ Laybutt DR, Thompson AL, Cooney GJ, Kraegen EW (September 1997). "Selective chronic regulation of GLUT1 and GLUT4 content by insulin, glucose, and lipid in rat cardiac muscle in vivo". The American Journal of Physiology (англ.). 273 (3 Pt 2): H1309—16. doi:10.1152/ajpheart.1997.273.3.H1309. PMID 9321820.
- ↑ Rett K, Wicklmayr M, Dietze GJ, Häring HU (January 1996). "Insulin-induced glucose transporter (GLUT1 and GLUT4) translocation in cardiac muscle tissue is mimicked by bradykinin". Diabetes (англ.). 45 Suppl 1 (Supplement 1): S66—9. doi:10.2337/diab.45.1.S66. PMID 8529803. S2CID 7766813.
- ↑ Slot JW, Geuze HJ, Gigengack S, James DE, Lienhard GE (September 1991). "Translocation of the glucose transporter GLUT4 in cardiac myocytes of the rat". Proceedings of the National Academy of Sciences of the United States of America (англ.). 88 (17): 7815—9. Bibcode:1991PNAS...88.7815S. doi:10.1073/pnas.88.17.7815. PMC 52394. PMID 1881917.
- ↑ Luiken JJ, Glatz JF, Neumann D (August 2015). "Cardiac contraction-induced GLUT4 translocation requires dual signaling input" (PDF). Trends Endocrinol Metab. 26 (8): 404—10. doi:10.1016/j.tem.2015.06.002. PMID 26138758. S2CID 171571. Архивировано (PDF) 4 декабря 2022. Дата обращения: 13 декабря 2023.
- ↑ "Adipose tissue". ScienceDaily. Архивировано 6 апреля 2017. Дата обращения: 24 мая 2017.
- ↑ Favaretto F, Milan G, Collin GB, Marshall JD, Stasi F, Maffei P, Vettor R, Naggert JK (2014-10-09). "GLUT4 defects in adipose tissue are early signs of metabolic alterations in Alms1GT/GT, a mouse model for obesity and insulin resistance". PLOS ONE. 9 (10): e109540. Bibcode:2014PLoSO...9j9540F. doi:10.1371/journal.pone.0109540. PMC 4192353. PMID 25299671.
- ↑ 1 2 Shepherd PR, Gnudi L, Tozzo E, Yang H, Leach F, Kahn BB (October 1993). "Adipose cell hyperplasia and enhanced glucose disposal in transgenic mice overexpressing GLUT4 selectively in adipose tissue". The Journal of Biological Chemistry. 268 (30): 22243—6. doi:10.1016/S0021-9258(18)41516-5. PMID 8226728.
- ↑ Buchberger A, Howard MJ, Proctor M, Bycroft M (March 2001). "The UBX domain: a widespread ubiquitin-like module". Journal of Molecular Biology. 307 (1): 17—24. doi:10.1006/jmbi.2000.4462. PMID 11243799.
- ↑ UniProt, P14672 (англ.). Дата обращения: 13 декабря 2023. Архивировано 13 декабря 2023 года.
- ↑ Huang S, Czech MP (April 2007). "The GLUT4 glucose transporter". Cell Metabolism. 5 (4): 237—52. doi:10.1016/j.cmet.2007.03.006. PMID 17403369.
- ↑ Mueckler M, Thorens B (2013). "The SLC2 (GLUT) family of membrane transporters". Molecular Aspects of Medicine. 34 (2—3): 121—38. doi:10.1016/j.mam.2012.07.001. PMC 4104978. PMID 23506862.
- ↑ Watson R.T., Kanzaki M., Pessin J.E. Regulated membrane trafficking of the insulin-responsive glucose transporter 4 in adipocytes (англ.) // Endocrine Reviews[англ.] : journal. — Endocrine Society[англ.], 2004. — April (vol. 25, no. 2). — P. 177—204. — doi:10.1210/er.2003-0011. — PMID 15082519.
- ↑ Lalioti V.S., Vergarajauregui S., Pulido D., Sandoval I.V. The insulin-sensitive glucose transporter, GLUT4, interacts physically with Daxx. Two proteins with capacity to bind Ubc9 and conjugated to SUMO1 (англ.) // Journal of Biological Chemistry : journal. — 2002. — May (vol. 277, no. 22). — P. 19783—19791. — doi:10.1074/jbc.M110294200. — PMID 11842083.


 French
French Deutsch
Deutsch