Гидразоны — Википедия
Гидразоны — соединения общей формулы R1R2C=NNR3R4, где R2, R3 R4 — органический радикал или атом водорода. Гидразоны формально являются продуктами конденсации карбонильных соединений и гидразина[1].
Бис-гидразоны α-дикарбонильных соединений общей формулы RNHN=CR1CR2=NNHR называют озазонами[2].
Синтез[править | править код]
Стандартный метод синтеза гидразонов — взаимодействие моно- и асимметрично замещенных гидразинов с карбонильными соединениями:
α-гидроксикарбонильные соединения (в том числе и альдозы и 2-кетозы) при взаимодействии с арилгидразинами образуют озазоны — бис-гидразоны α-дикарбонильных соединений:
Озазоны также образуются и при взаимодействии α-дикарбонильных соединений с арилгидразинами.
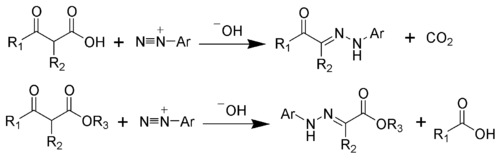
Специфическим методом синтеза гидразонов является взаимодействие солей диазония с соединениями, содержащими активированную метиленовую группу в присутствии оснований . Так, реакция незамещенных по метилену с 1,3-дикарбонильными соединениями ведет к образованию диацилгидразонов:
- (RCO)2CH2 + Ar-N2+ (RCO)2C=N-NHAr + H+
В реакцию вступают ароматические и алифатические (в том числе и циклические) 1,3-дикетоны, а также эфиры и амиды β-кетокислот.
Взаимодействие солей диазония с алкилзамещенными 1,3-дикарбонильными соединениями приводит к образованию арилгидразонов α-дикарбонильных соединений, взаимодействие сопровождается отщеплением электронакцапторного заместителя (Реакция Яппа - Клингеманна):
В реакцию вступают 1,3-дикетоны, замещенные эфиры ацетоуксусной, диацилуксусной кислоти циануксусной кислот, в случае циклических 1,3-дикарбонильных соединений идет раскрытие цикла:
Свойства и реакционная способность[править | править код]
Углеродный атом гидразонной группы, подобно карбонильному и иминному углероду, электрофилен — хотя и в меньшей степени, чем в карбонильных соединениях: алкилгидразоны гидролизуются в кислой среде с образованием солей гидразинов и исходных карбонильных соединений, при действии алкилгидразинов гидразоны вступают в реакцию перегидразинирования, подобную реакции переаминирования иминов:
реакция обратима, положение равновесия зависит от концентраций и свойств реагентов.
Аминный атом азота гидразонов нуклеофилен: так, незамещенные гидразоны могут вступать в реакцию с карбонильными соединениями, образуя азины:
Незамещенные гидразоны также ацилируются ацилгалогенидами условиях реакции Шоттен-Баумана:
Такие ацилгидразоны могут быть селективно восстановлены по азометиновой связи до соответствующих алкилгидразидов:
Незамещенные гидразоны кетонов при каталитическом гидрировании (в частности, катализ палладием на угле) восстанавливаются до алкилгидразинов:
При проведении восстановления в присутствии другого кетона, например, при использовании в качестве растворителя ацетона, in situ образуются N,N'-замещенные гидразоны[3]:
Окисление гидразонов кетонов ведет к образованию диазометанов, эта реакция используется как метод синтеза как арилзамещенных, так и алкиззамещенных диазометанов[4],[5]:
- R2C=NNH2 + [O] R2C=N2
Незамещенные гидразоны при нагревании в сильнощелочной среде отщепляют азот с образованием углеводородов, что является синтетическим методом восстановления карбонильной группы кетонов до метиленовой (реакция Кижнера—Вольфа, образование гидразона действием гидразина и его расщепления может проводиться in situ) (модификация Хуанг-Минлона):
Гидразоны алкилкетонов при действии йода в присутствии сильных ненуклеофильных оснований образуют винилйодиды[6], эта реакция используется как препаративный метод синтеза винилйодидов[7]:
Арилгидразоны в кислой среде или под действием кислот Льюиса претерпевают 3,4-диазаперегруппировку Коупа (3,3-сигматропный сдвиг) в индолы (реакция Фишера), эта реакция является одним из препаративных методов синтеза индолов:
Примечания[править | править код]
- ↑ hydrazones // IUPAC Gold Book. Дата обращения: 9 февраля 2011. Архивировано 20 октября 2012 года.
- ↑ Озазоны // Химическая энциклопедия. — М.: «Советская энциклопедия», 1988 год.
- ↑ Gore, Vinayak Govind; Shukla, Vinay Kumar; Bhandari, Sheryas; Hasbe, Suresh; Mekde, Sandeep; Limited, Generics [Uk]; Limited, Mylan India Private. Regioselective synthesis of letrozole (неопр.). — 2010. Архивировано 20 октября 2016 года.
- ↑ Muhammad I. Javed and Matthias Brewer. Diphenyldiazomethane. Org. Synth. 2008, 85, 189 Архивная копия от 2 июня 2018 на Wayback Machine DOI: 10.15227/orgsyn.085.0189
- ↑ [ S. D. Andrews et al. 2-Diazopropane. Org. Synth. 1970, 50, 27] DOI: 10.15227/orgsyn.050.0027
- ↑ A new reaction of hydrazones Barton, D. H. R., R. E. O'Brien and S. Sternhell Journal of the Chemical Society,1962, 470 - 476 doi:10.1039/JR9620000470 Abstract Архивная копия от 30 сентября 2007 на Wayback Machine
- ↑ Derek H. R. Barton et al. Preparation and reactions of 2-TERT-butyl-1,1,3,3-tetramethylguanidine: 2,2,6-trimethylcyclohexen-1-yl iodide. Org. Synth. 1997, 74, 101. Дата обращения: 26 февраля 2018. Архивировано 26 февраля 2018 года.
Литература[править | править код]
- Китаев Ю. П., Бузыкин Б. И. Гидразоны. — М.: Наука, 1974. — 415 с.
- Химия гидразонов / Отв. ред. Ю. П. Китаев. — М.: Наука, 1977. — 205 с.


 French
French Deutsch
Deutsch






![{\displaystyle {\mathsf {R_{2}C{\text{=}}NNHC(O)R^{2}+[H]\rightarrow R_{2}CHNHNHC(O)R^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dac999a2b3fb3d0f3e164dd7b2bf8e46c7f2504)
![{\displaystyle {\mathsf {R_{2}C{\text{=}}NNH_{2}+[H]\rightarrow R_{2}CHNHNH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cab2966fed2bb6c511004b9212250963f2d49626)
![{\displaystyle {\mathsf {R_{2}C{\text{=}}NNH_{2}+[H]+(CH_{3})_{2}CO\rightarrow R_{2}CHNHN{\text{=}}C(CH_{3})_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5336f312c6f751712a71f66eb99accccc3f82fd0)


