Межклеточные контакты — Википедия
Межкле́точные конта́кты — молекулярные комплексы, обеспечивающие соединения между смежными клетками или между клеткой и внеклеточным матриксом (ВКМ). Межклеточные контакты критически важны для жизнеспособности многоклеточных организмов. Среди контактов, опосредующих соединение двух клеток, выделяют плотные контакты, которые регулируют межклеточный транспорт и предотвращают диффузию мембранных белков; адгезивные контакты, которые связывают актиновый цитоскелет примыкающих друг к другу клеток; десмосомы, которые связывают промежуточные филаменты соседних клеток; щелевые контакты, обеспечивающие прямой перенос ионов и небольших молекул между соседними клетками. У беспозвоночных животных имеются септированные контакты, которые обладают такими же функциями, что и плотные контакты. У растений многие клетки соединены цитоплазматическими мостиками — плазмодесмами. К числу контактов, связывающих клетки и ВКМ, относят десмосомы и фокальные контакты.
Контакты между двумя клетками[править | править код]
Плотные контакты[править | править код]

Плотные контакты связывают клетки эпителия или эндотелия. Они регулируют транспорт частиц между клетками, а также выполняют роль «загородки», которая предотвращает диффузию мембранных белков между верхней (апикальной) и нижней (базальной) областями мембраны. В зоне плотных контактов обнаружено более 24 различных белков, которые подразделяют на 4 группы: трансмембранные, полярные, белки цитоскелета и сигнальные белки. Трансмембранные белки представлены тремя типами белков: клаудины, окклюдины и контактные адгезивные молекулы (англ. junctional adhesion molecule), которые выполняют «запирающую» функцию. Некоторые белки плотных контактов, например, ZO-1, взаимодействуют со многими сигнальными белками, а также актиновым цитоскелетом[1].
Септированные контакты[править | править код]
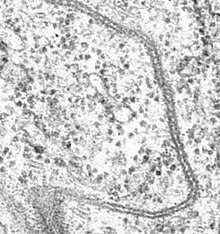
Септированные контакты обнаружены только у беспозвоночных. В электронный микроскоп септированные контакты выглядят как серия (стопка) прямых или изогнутых стенок (или септ, за что они и получили своё название), располагающихся параллельно друг другу. Септы соединяют промежуток шириной 15—20 нм между плазматическими мембранами соседних клеток. Иногда контакт имеет складчатый вид. Со стороны цитоплазмы с септированным контактом могут быть связаны актиновые филаменты[2].
Септированные и плотные контакты отличаются по белковому составу. Кроме того, плотные контакты находятся на латеральной мембране выше опоясывающих адгезивных контактов, а септированные контакты — ниже, вблизи основания клетки. Иногда одна клетка связана со своими соседями и плотными, и септированными контактами[2].
Как и плотные контакты, септированные контакты регулируют транспорт молекул через клеточный слой, ограничивая возможность диффузии, а также ограничивают поток фосфолипидов и мембранных белков между верхней (апикальной) и нижней (базальной) половинами клеточной мембраны. Однако у септированных контактов есть и функции, не свойственные плотным контактам. Например, у дрозофилы и нематоды Caenorhabditis elegans в отсутствие функциональных септированных контактов начинают развиваться опухоли, что указывает на роль этих структур в сдерживании опухолевого роста. Кроме того, септированные контакты играют важную роль в контроле формы клеток[2].
Адгезивные контакты[править | править код]

Чаще всего адгезивные контакты встречаются в эпителиальных тканях и в эндотелии, здесь они образуют вокруг каждой клетки адгезивный поясок, который также называют зоной прилипания (лат. zonula adherens). Такие зоны в эпителии позвоночных животных преимущественно размещаются базальнее участка плотных контактов (лат. zonula occludens) и апикальнее десмосом (лат. macula adherens)[3][4]. В электронный микроскоп адгезивные контакты выглядят как тёмные плотные полосы, располагающиеся в примыкающих областях мембран смежных клеток. Адгезивные контакты содержат трансмембранные белковые рецепторы — кадгерины. Кадгерины, расположенные на латеральной мембране одной клетки, взаимодействуют с такими же белками на латеральной мембране соседней клетки. Адгезивные контакты достаточно сильны и прочны, чтобы изменять форму ткани и противостоять силам сдвига. Например, в адгезивном пояске кадгерины взаимодействуют с актиновыми филаментами при участии белков группы катенинов. Актиновые филаменты присоединены к миозинам, которые обеспечивают возможность скольжения нитей актина. За счёт скольжения нити происходит изменение формы апикального полюса эпителиальных клеток. Это особенно важно для правильного развития нервной трубки[5].
Щелевые контакты[править | править код]

Щелевые контакты могут содержать от нескольких десятков до многих тысяч каналов, проходящих сквозь плазматические мембраны смежных клеток. Каждый канал и состоит из двух половин, которые известны как коннексоны, или полуканалы. Эти половины стыкуются в узкой щели шириной 2—3 нм, разделяющей соседние клетки. Каждый коннексон состоит из шести белковых субъединиц — коннексинов[6]. Известны ещё два семейства белков щелевых контактов. Иннексины обнаружены только у беспозвоночных животных, однако они не являются гомологами коннексинов. Тем не менее, они формируют межклеточные контакты, которые по строению и по функциям похожи на щелевые контакты позвоночных. Другое семейство представлено паннексинами, которые имеются как у позвоночных, так и у беспозвоночных. По структуре они отличаются и от коннексинов, и от иннексинов. Паннексины обнаруживаются почти исключительно в нейронах и, вероятно, играют важную роль в их функционировании и развитии даже у животных с примитивной нервной системой[7].
Щелевые контакты служат для перемещения ионов и малых молекул между соседними клетками. Через щелевой контакт могут проходить молекулы массой до 1,2 кДа, а молекулы с массой 2 кДа задерживаются. Клетки могут обмениваться такими молекулами, как сахара, нуклеотиды, вторичные посредники (цАМФ или цГМФ), небольшие пептиды и РНК. Щелевые контакты особенно важны, когда большому количеству клеток необходимо выдать быстрый, хорошо скоординированный ответ. Так, щелевые контакты составляют основу очень быстрых электрических синапсов, которые можно найти, например, в нейронах головного мозга и в клетках миокарда (кардиомиоцитах)[8]. Щелевые контакты также используются опухолевыми клетками для взаимной поддержки.[9]
Десмосомы[править | править код]

Десмосомы связывают клетки эпителиев, миокарда, печени, селезёнки и некоторые клетки нервной системы. В электронный микроскоп десмосома выглядит следующим образом. В области контакта на цитоплазматической стороне мембраны каждой из двух соседних клеток находится электронно-плотная бляшка, от цитоплазматической стороны которой отходит пучок промежуточных филаментов. Ширина щели между двумя соседними клетками составляет около 30 нм[10].
Десмосомы обеспечивают структурную целостность слоёв клеток за счёт связывания воедино их сетей промежуточных филаментов. Помимо белков промежуточных филаментов, в состав десмосом входит множество других белков с разнообразными функциями. Десмосомы особенно характерны для клеток, подвергающихся физическим нагрузкам, таким как клетки кожи и миокарда, где они играют важную структурную роль, обеспечивая «точечную сварку» клеток. Десмосомы также задействованы в передаче сигнала. Например, плакоглобин и плакофилины, входящие в состав десмосом, при активации сигнальных рецепторов на поверхности клетки перемещаются в ядро, где регулируют экспрессию многих генов, а плакоглобин, кроме того, непосредственно связывается с рецепторами факторов роста. Таким образом, десмосомы могут контролировать экспрессию многих генов[11].
Плазмодесмы[править | править код]

Плазмодесмы образуются в ходе последнего этапа деления растительных клеток — цитокинеза, когда дочерние клетки окончательно отделяются друг от друга. В новообразованных клеточных стенках остаются поры, соединяющие цитоплазмы соседних клеток. Плазмодесмы формируются, если при формировании клеточной пластинки в неё попадают трубочки эндоплазматического ретикулума (ЭПР). При этом мембраны соседних клеток и трубочки ЭПР не сливаются друг с другом. Вместо этого трубочка ЭПР оказывается разделённой на две части, которые находятся в соседних клетках и соединены узким перешейком. Перешеек же залегает в канале в клеточных стенках соседних клеток и окружён цитоплазмой; его также называют десмотубулой[12]. Плазмодесмы, сформированные при цитокинезе, называются первичными. Однако иногда плазмодесмы соединяют клетки, не являющиеся продуктом одного деления; такие плазмодесмы называются вторичными. Вторичные плазмодесмы образуются при локальном утоньшении стенки между двумя клетками, и в образующееся отверстие каким-то образом вставляется трубочка ЭПР[13].
Плазмодесмы объединяют растительные клетки в одну большую структуру, которая называется симпласт. В пределах симпласта через плазмодесмы проходят электрические сигналы, ионы и небольшие водорастворимые молекулы, включая аминокислоты, сахара, мРНК, малые интерферирующие РНК и белки (в том числе транскрипционные факторы). Ионы и молекулы проходят через плазмодесмы с помощью простой диффузии[14]. Диаметр пор плазмодесм может изменяться, обеспечивая возможность настройки избирательной проницаемости плазмодесм[15].
Многие патогены растений — вироиды и вирусы — переносятся между клетками посредством плазмодесм, несмотря на свои большие размеры. Дело в том, что вирусы экспрессируют белки, которые расширяют поры плазмодесм, делая возможным транспорт даже довольно крупных вирусных частиц. Механизм действия этих белков пока не известен[15].
Контакты между клетками и ВКМ[править | править код]
Полудесмосомы[править | править код]
Полудесмосомы располагаются на базальной стороне мембраны эпителиальной клетки и связывают её с внеклеточным матриксом. Точнее, полудесмосомы связывают сеть промежуточных филаментов эпителиальных клеток с внеклеточным матриксом при помощи трансмембранных рецепторов. Электронная микроскопия показала, что структуры десмосом и полудесмосом очень похожи (полудесмосома выглядит как половина десмосомы, за что эта структура и получила своё название), однако десмосомы связывают не клетку и внеклеточный матрикс, а две соседние клетки. Основная функция полудесмосом заключается в прикреплении слоёв эпителия к базальной мембране[16].
Полудесмосомы обеспечивают прикрепление многослойного эпителия к базальной мембране. Полудесмосомы и десмосомы в клетке ориентированы под прямым углом друг к другу, благодаря чему они обеспечивают защиту от разных видов механического стресса. Связанные с промежуточными филаментами, полудесмосомы и десмосомы образуют плотную сеть, обеспечивающую структурную поддержку слоёв эпителия[17].
Несмотря на важную архитектурную роль, десмосомы и полудесмосомы не являются статическими структурами. Так, при ранении кожи клетки эпителия отсоединяются от базальной мембраны и мигрируют в область раны. Там они делятся, восстанавливая популяцию клеток в зоне ранения, и затем снова прикрепляются к базальной мембране (с помощью полудесмосом) и друг к другу (с помощью десмосом). Таким образом, полудесмосомы и десмосомы способны к обратимой разборке[17].
Фокальные контакты[править | править код]

Фокальные контакты представляют собой скопление интегриновых рецепторов на клеточной мембране, которые связывают клетку с внеклеточным матриксом; со стороны цитоплазмы они взаимодействуют с актиновым цитоскелетом. Помимо интегринов, в состав фокальных контактов входят белки винкулин, талин, киназа фокальных контактов, паксиллин, зиксин, VASP, α-актинин и другие. Фокальные контакты выявляются только в тех участках клеточной мембраны, которые приближаются к внеклеточному матриксу на расстояние менее 15 нм[18][19].
Фокальные контакты обеспечивают сильное прикрепление клеток к внеклеточному матриксу и участвуют в передаче механического напряжения на мембране клетки. Они задействованы во многих сигнальных путях клетки, в частности, активирующихся в ответ на механический стресс[19].
Клиническое значение[править | править код]
Нарушения в работе межклеточных контактов разных типов приводят к разнообразным заболеваниям, чем подчёркивается их функциональная важность для многоклеточного организма. Например, мутации в генах клаудина-16 и клаудина-19, нарушающие работу плотных контактов, приводят к гипомагниемии вследствие чрезмерной потери магния с мочой. Мутации в генах клаудина-13 и трицеллюлина вызывают наследственную глухоту. Дисрегуляция некоторых белков плотных контактов связана с онкологическими заболеваниями (например, экспрессия ZO-1 и ZO-2 снижается во многих типах рака). Компоненты плотных контактов также могут быть мишенями для онкогенных вирусов[20].
Точечные мутации в генах, кодирующих белки щелевых контактов — коннексины, у человека приводят к очень специфическим дефектам, из чего можно заключить, что большая часть коннексинов экспрессируется лишь в нескольких тканях. Рецессивные мутации в гене коннексина-26 являются наиболее частой причиной наследственной глухоты. Коннексин-26 участвует в транспорте ионов калия в клетках эпителия, поддерживающего чувствительные волосковые клетки в ухе. Люди с мутациями в гене, кодирующем коннексин-32, могут страдать от разрушения миелиновой оболочки аксонов (X-связанный вариант болезни Шарко — Мари — Тута). Возможно, стабильность миелина может зависеть от щелевых контактов между клетками разных слоёв миелиновой оболочки, и нарушения в функционировании контактов приводят к её разрушению[21].
Нарушение функционирования десмосом также приводит к различным заболеваниям. Так, ладонно-подошвенная кератодерма развивается при мутациях в белках десмосом. Аутоиммунные буллёзные дерматозы — такие, как обыкновенная пузырчатка, наблюдаются, когда у пациентов образуются антитела к собственным белкам десмосом. Нарушения в функционировании межклеточных контактов, в частности, десмосом, могут приводит к летальному исходу[22]. Заболевания, связанные с дисфункцией полудесмосом, проявляются в образовании пузырей на коже. Такие заболевания известны под общим названием буллёзный эпидермолиз (БЭ). При БЭ кожа становится хрупкой, отслаивается и покрывается волдырями в ответ на малейший механический стресс. Иногда также происходит отслоение эпителия роговицы, трахеи, пищеварительного тракта, пищевода, а также имеет место мышечная дистрофия[23].
Примечания[править | править код]
- ↑ Кассимерис, Лингаппа, Плоппер, 2016.
- ↑ 1 2 3 Кассимерис, Лингаппа, Плоппер, 2016, с. 893.
- ↑ Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. — 5th. — Garland Science, 2007. — ISBN 978-0-8153-4105-5. Архивировано 22 июля 2011 года.
- ↑ Harvey Lodish et al. 22.1 Cell-Cell Adhesion and Communication // Molecular Cell Biology. — 4th. — W H Freeman, 2000. — ISBN 0-7167-3136-3.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 895—897.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 901.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 903.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 902—903.
- ↑ Pavel P. Nesmiyanov, Boris E. Tolkachev, Andrey V. Strygin. ZO-1 expression shows prognostic value in chronic B cell leukemia // Immunobiology. — 2016-01. — Т. 221, вып. 1. — С. 6–11. — ISSN 1878-3279. — doi:10.1016/j.imbio.2015.08.008. Архивировано 9 февраля 2022 года.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 897—898.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 898.
- ↑ Robards A W. Plasmodesmata (англ.) // Annual Review of Plant Physiology. — 1975. — June (vol. 26, no. 1). — P. 13—29. — ISSN 0066-4294. — doi:10.1146/annurev.pp.26.060175.000305.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 986—987.
- ↑ ROBERTS A. G., OPARKA K. J. Plasmodesmata and the control of symplastic transport (англ.) // Plant, Cell and Environment. — 2003. — January (vol. 26, no. 1). — P. 103—124. — ISSN 0140-7791. — doi:10.1046/j.1365-3040.2003.00950.x.
- ↑ 1 2 Кассимерис, Лингаппа, Плоппер, 2016, с. 987.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 899.
- ↑ 1 2 Кассимерис, Лингаппа, Плоппер, 2016, с. 900.
- ↑ Zaidel-Bar R., Cohen M., Addadi L., Geiger B. Hierarchical assembly of cell-matrix adhesion complexes. (англ.) // Biochemical Society Transactions. — 2004. — June (vol. 32, no. Pt3). — P. 416—420. — doi:10.1042/BST0320416. — PMID 15157150.
- ↑ 1 2 Burridge K. Focal adhesions: a personal perspective on a half century of progress. (англ.) // The FEBS Journal. — 2017. — October (vol. 284, no. 20). — P. 3355—3361. — doi:10.1111/febs.14195. — PMID 28796323.
- ↑ Balda M. S., Matter K. Tight junctions at a glance. (англ.) // Journal Of Cell Science. — 2008. — 15 November (vol. 121, no. Pt 22). — P. 3677—3682. — doi:10.1242/jcs.023887. — PMID 18987354.
- ↑ Pollard et al., 2017, p. 550.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 898—899.
- ↑ Walko G., Castañón M. J., Wiche G. Molecular architecture and function of the hemidesmosome. (англ.) // Cell And Tissue Research. — 2015. — May (vol. 360, no. 2). — P. 363—378. — doi:10.1007/s00441-014-2061-z. — PMID 25487405.
Литература[править | править код]
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
- Thomas D. Pollard, William C. Earnshaw, Jennifer Lippincott-Shwartz, Graham T. Jonson. Cell biology. — Elsevier, 2017. — ISBN 978-0-323-34126-4.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |


 French
French Deutsch
Deutsch