Уксусный ангидрид — Википедия
| Уксусный ангидрид[1][2][3][4] | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование | уксусный ангидрид | ||
| Сокращения | Ac2O | ||
| Традиционные названия | ангидрид уксусной кислоты, этановый ангидрид, ацетилацетат, ацетилоксид, ацетангидрид | ||
| Хим. формула | (CH3CO)2O | ||
| Рац. формула | C4H6O3 | ||
| Физические свойства | |||
| Состояние | бесцветная прозрачная жидкость с острым запахом | ||
| Молярная масса | 102,09 г/моль | ||
| Плотность | 1,0820 г/см³ | ||
| Поверхностное натяжение | 0,03265 Н/м | ||
| Динамическая вязкость | 901 Па·с | ||
| Энергия ионизации | 965 кДж/моль | ||
| Удельная проводимость | 4,8·10–7 См/м | ||
| Термические свойства | |||
| Температура | |||
| • плавления | –73,1 °C | ||
| • кипения | 139,6 °C | ||
| • вспышки | 52,5—53 °C | ||
| • самовоспламенения | 316 °C | ||
| Пределы взрываемости | 2,7—10,3 % | ||
| Критическая точка | |||
| • температура | 295,8 °C | ||
| • давление | 45,4 атм | ||
| Мол. теплоёмк. | 168,230 °C Дж/(моль·К) | ||
| Теплопроводность | 0,2209·10–3 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | –624,42ж, –576,1пар кДж/моль | ||
| • плавления | 10,5 кДж/моль | ||
| • кипения | 276,7[уточнить] | ||
| • сублимации | 48,3 кДж/моль | ||
| Давление пара | 0,420 °C, 1,740 °C, 5,260 °C, 13,380 °C, 28,7100 °C, 53,3120 °C атм | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 12 г в 100 г холодной воды | ||
| Диэлектрическая проницаемость | 20,5 | ||
| Оптические свойства | |||
| Показатель преломления | 1,3906 | ||
| Структура | |||
| Дипольный момент | 2,8 Д | ||
| Классификация | |||
| Рег. номер CAS | 108-24-7 | ||
| PubChem | 7918 | ||
| Рег. номер EINECS | 203-564-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | AK1925000 | ||
| ChEBI | 36610 | ||
| Номер ООН | 1715 | ||
| ChemSpider | 7630 | ||
| Безопасность | |||
| Предельная концентрация | 21 мг/м3 | ||
| ЛД50 | 1,78—5 мг/кг | ||
| Фразы риска (R) | R10, R20/22, R34 | ||
| Фразы безопасности (S) | S26, S36/37/39, S45 | ||
| Краткие характер. опасности (H) | H226, H302, H314, H332 | ||
| Меры предостор. (P) | P280, P305+P351+P338, P310 | ||
| Пиктограммы СГС | | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
У́ксусный ангидри́д (ангидри́д у́ксусной кислоты́), (CH3CO)2O, Ac2O — бесцветная жидкость с резким запахом, растворимая в бензоле, диэтиловом эфире и других органических растворителях. Находит весьма широкое применение в промышленности и органическом синтезе.
Промышленные методы получения[править | править код]
Устаревшие методы[править | править код]
Исторически первый метод синтеза уксусного ангидрида был основан на превращении ацетата натрия CH3COONa в ацетилхлорид CH3COCl под действием неорганического хлорида (обычно хлористого тионила SOCl2, хлористого сульфурила SO2Cl2 или хлористого фосфорила POCl3). На второй стадии образовавшийся ацетилхлорид реагировал с избытком ацетата натрия с образованием уксусного ангидрида[5].
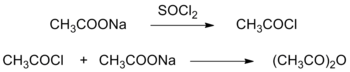
В другом подходе уксусную кислоту превращали в уксусный ангидрид под действием фосгена в присутствии хлорида алюминия[5].

Ранее применялись также другие методы, например, разложение этилидендиацетата на ацетальдегид и уксусный ангидрид в присутствии кислотных катализаторов, а также каталитическая реакция винилацетата с уксусной кислотой. В настоящее время эти процессы не используются в промышленности. Основными методами получения являются реакция кетена с уксусной кислотой, окисление уксусного альдегида и карбонилирование метилацетата[5].
Получение из кетена[править | править код]
Данный метод синтеза состоит из двух стадий: термического разложения уксусной кислоты до кетена и реакции кетена с уксусной кислотой. Первая стадия протекает в газовой фазе при температуре 700—750 °С в присутствии следовых количеств триэтилфосфата. В качестве реактора используются змеевики из тугоплавких стальных сплавов (Sicromal, 25 % Cr, 20 % Ni, 2 % Si). Также разработан метод получения кетена разложением ацетона, однако этот метод не имеет промышленного значения.
Затем полученный кетен поглощается ледяной уксусной кислотой, в результате чего получается сырой уксусный ангидрид, который подвергается фракционной перегонке. При перегонке собирают несколько фракций: предгон (1 %, состоит из уксусной кислот и более лёгких примесей, например, ацетона и метилацетата), фракцию I (~10 %, смесь уксусной кислоты и уксусного ангидрида) и чистый ангидрид. Чистота получаемого таким способом уксусного ангидрида не превышает 99 % (остальная доля приходится на уксусную кислоту), поскольку при перегонке происходит частичное разложение продукта.

Синтез уксусного ангидрида из кетена применяется многими компаниями. Для получения 100 кг уксусного ангидрида требуется 122 кг уксусной кислоты. Метод не создаёт серьёзных экологических проблем: побочно образующиеся газы сжигаются в печи и обеспечивают температуру, необходимую для первой стадии; проблема сточных вод отсутствует[6].
Окисление уксусного альдегида[править | править код]
Уксусный ангидрид может быть получен жидкофазным окислением ацетальдегида на воздухе, при этом на первой стадии происходит образование надуксусной кислоты, которая далее реагирует со второй молекулой ацетальдегида, образуя уксусный ангидрид.
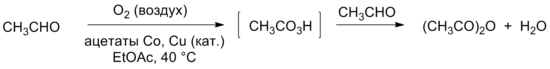
Существенными для данного процесса являются быстрое удаление воды из реакционной смеси и использование подходящего катализатора. В реакции всегда образуется смесь уксусного ангидрида и уксусной кислоты; последняя образуется в результате разложения водой целевого продукта. Поскольку гидролиз в значительной степени протекает при температуре выше 60 °С, процесс проводят между 40 °С и 60 °С. В качестве катализаторов используют ацетаты марганца, меди, кобальта, никеля или медные соли жирных кислот.
Реакция является экзотермической, поэтому требует эффективного охлаждения. Основным методом охлаждения является добавление в реакционную смесь низкокипящих растворителей, обычно метилацетата или этилацетата. Помимо функции отвода тепла, эти растворители позволяют удалять из смеси образующуюся воду, поскольку они кипят в виде азеотропной смеси с водой.
На практике используют смесь ацетальдегида и этилацетата (1:2), которую окисляют воздухом при добавлении 0,05—0,1 % ацетата кобальта и ацетата меди (1:2) при 40 °С. Соотношение уксусного ангидрида и уксусной кислоты в получаемом продукте составляет 56:44, тогда как при окислении в отсутствие этилацетата — лишь 20:80[7].
Карбонилирование метилацетата[править | править код]
Недостатком термического разложения уксусной кислоты до кетена является необходимость значительных затрат энергии. Кроме того, промышленно полезны процессы, основанные на использовании синтез-газа, который, в свою очередь, получают из метана. Примером может служить промышленное получение уксусной кислоты из метанола, разработанный компанией Монсанто.
В 1973 году компания Халкон (англ. Halcon) запатентовала метод карбонилирования метилацетата в присутствии родиевого катализатора для получения уксусного ангидрида. Процесс протекает в жидкой фазе при температуре 160—190 °С и парциальном давлении оксида углерода(II) CO, равном 2—5 МПа. В качестве сырья используется метилацетат, образующийся в качестве побочного продукта при получении уксусной кислоты из метанола и СО. Сырой продукт перегоняют, получая уксусный ангидрид 99%-ой чистоты. Первый завод, использующий этот процесс, заработал в 1983 году[8].

Лабораторные методы получения[править | править код]
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3)[1].
Очистка в лабораторных условиях[править | править код]
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке[9].
Физические свойства[править | править код]
Уксусный ангидрид представляет собой бесцветную прозрачную подвижную жидкость с резким запахом. Он растворим в бензоле, диэтиловом эфире, этаноле, хлороформе, уксусной кислоте, тетрагидрофуране, ограниченно — в холодной воде. При растворении в воде и спиртах происходит медленное разложение, которое ускоряется при нагревании[1][10].
Химические свойства[править | править код]
Уксусный ангидрид часто применяется в реакциях ацилирования (в данном случае, ацетилирования), в которые вступает широкий ряд различных соединений[11].
- В частности, в реакцию с уксусным ангидридом вступают спирты, при этом выделяется уксусная кислота, а катализаторами выступают основания (например, ацетат натрия) и сильные кислоты.
- В реакции ацилирования вступают также амины, причём для них эта реакция протекает быстрее, чем для спиртов. Анилины также можно ацетилировать: обычно такая реакция применяется для защиты аминогруппы, соединённой с ароматическим циклом от окисления.
- Уксусный ангидрид используется для ацилирования ароматических углеводородов по реакции Фриделя — Крафтса, например, при реакции бензола с уксусным ангидридом в присутствии катализатора образуется ацетофенон.
- Реакции ацетилирования подвергаются также неорганические кислоты. Так, при взаимодействии уксусного ангидрида с азотной кислотой образуется ацетилнитрат — нитрующий реагент, находящий применение в тонком органическом синтезе. Также смешанные эфиры с уксусным ангидридом дают серная кислота, сульфоновые кислоты и соляная кислота.
- Ацетилированию могут подвергаться также оксиды с образованием соответствующих ацетатов. С уксусным ангидридом реагируют также различные соли, ацетилениды, алкоголяты.
- Пероксиды под действием уксусного ангидрида образуют надуксусную кислоту (пероксид водорода) либо перекись ацетила (CH3CO)2O2.
Другим важным свойством уксусного ангидрида является его способность отнимать воду в химических реакциях. Данное свойство широко используется в органическом синтезе, а также химической промышленности. В частности, уксусный ангидрид используется как водоотнимающее средство при получении гексогена. Также под действием уксусного ангидрида оксимы теряют воду, превращаясь в нитрилы. Кроме того, уксусный ангидрид участвует во многих реакциях циклизации[12].
Уксусный ангидрид вступает в реакцию Перкина и другие реакции карбонильных соединений[5].
Спектральные данные[править | править код]
- Масс-спектрометрия. Масса молекулярного иона уксусного ангидрида равна 102, однако в результате его фрагментации образуются также пики с m/z, равным 43 и 15[13].
- ЯМР-спектроскопия. Протоны уксусного ангидрида имеют в 1H ЯМР-спектр химический сдвиг, равный 2,219 м. д. (растворитель CDCl3). В спектре 13C ЯМР наблюдается два сигнала: при 22,07 м. д. для атомов углерода метильной группы и при 166,63 м. д. для атомов углерода карбонильной группы[13].
- УФ-спектроскопия. Максимум поглощения уксусного ангидрида составляет 217 нм[10].
Использование[править | править код]
Промышленное использование[править | править код]
Примерно 80 % синтезируемого в промышленности уксусного ангидрида идёт на производство ацетата целлюлозы[14].
Использование в органическом синтезе[править | править код]
- Используется в органическом синтезе в качестве ацилирующего и водоотнимающего агента.
- Является прекурсором в производстве героина и других наркотиков опиоидной группы, в связи с чем оборот уксусного ангидрида в РФ, Белоруссии, Украине и в некоторых других государствах законодательно ограничен.
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 3 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М.: Большая Российская энциклопедия, 1992. — Т. 5. — С. 33. — ISBN 5-85270-039-8.
- ↑ Ullmann, 2000, p. 239—240.
- ↑ Dean J. A. Lange's Handbook of Chemistry. — McGraw-Hill, 1999. — ISBN 0-07-016384-7.
- ↑ Sigma-Aldrich. Acetic Anhydride, ReagentPlus, ≥ 99 %. Дата обращения: 2 мая 2013. Архивировано 10 мая 2013 года.
- ↑ 1 2 3 4 Ullmann, 2000, p. 244.
- ↑ Ullmann, 2000, p. 244—246.
- ↑ Ullmann, 2000, p. 247—248.
- ↑ Ullmann, 2000, p. 248—249.
- ↑ Amarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — Sixth ed. — Elsevier, 2009. — P. 90. — ISBN 978-1-85617-567-8.
- ↑ 1 2 Ullmann, 2000, p. 240.
- ↑ Ullmann, 2000, p. 241—242.
- ↑ Ullmann, 2000, p. 243.
- ↑ 1 2 Spectral Database for Organic Compounds SDBS. Дата обращения: 4 мая 2013. Архивировано 10 мая 2013 года.
- ↑ Speight J. G. Chemical Process and Design Handbook. — McGraw-Hill, 2002. — P. 2.15. — ISBN 0-07-137433-7.
Литература[править | править код]
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a01_065.
- Hoelz L. V. B. Synlett Spotlight 291. Acetic anhydride (Ac2O) // Synlett. — 2009. — № 15. — С. 2547—2548. — doi:10.1055/s-0029-1217816. Архивировано 4 марта 2016 года.
- Kim D. H. Acetic anhydride as a synthetic reagent (англ.) // J. Het. Chem. — 1976. — Vol. 13, no. 2. — P. 179—194. — doi:10.1002/jhet.5570130201.


 French
French Deutsch
Deutsch

