Епоксипропан — Вікіпедія
| Епоксипропан | |
|---|---|
 |  |
| Назва за IUPAC | Епоксипропан |
| Інші назви | Оксид пропілену, пропілен оксид, метилоксиран; 1,2-епоксипропан |
| Ідентифікатори | |
| Номер CAS | 75-56-9 |
| Номер EINECS | 200-879-2 |
| Номер EC | 200-879-2 |
| KEGG | C15508 |
| ChEBI | 38685 |
| RTECS | TZ2975000 |
| SMILES | CC1CO1 |
| InChI | InChI=1S/C3H6O/c1-3-2-4-3/h3H,2H2,1H3 |
| Номер Бельштейна | 79763 |
| Номер Гмеліна | 81761 |
| Властивості | |
| Молекулярна формула | CH3CHCH2O |
| Молярна маса | 58,08 г/моль |
| Молекулярна маса | 58 а. о. м. |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,8313 г/см³ |
| Тпл | −112,1 °C |
| Ткип | 34,2 °C |
| Розчинність (вода) | 40,5 % мас (при 20 оС) |
| Показник заломлення (nD) | 1,363 |
| В'язкість | 0,28 сП |
| Дипольний момент | 2,00 |
| Структура | |
| Дипольний момент | 2,00 |
| Термохімія | |
| Ст. ентальпія згоряння ΔcH 298 | 453,1 ккал/моль |
| Теплоємність, c p | 0,51 кал/(г·К) |
| Небезпеки | |
| ГДК (Україна) | 1 мг/м³ |
| ЛД50 | 580 мг/кг |
| NFPA 704 | |
| Температура спалаху | -44 °С |
| Температура самозаймання | 747 °С |
| Вибухові границі | 2,8—36,8% |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Епо́ксипропа́н (окси́д пропіле́ну, пропіле́нокси́д) — один із найпоширеніших оксидів алкенів. При кімнатних умовах — безбарвна прозора рідина з ефірним запахом, розчинна у більшості органічних розчинників.
За хімічними властивостями епоксипропан подібний до окисирану. Для нього характерні реакції приєднання, зумовлені відносною легкістю розмикання циклу. Найбільш розповсюдженою є реакція гідратації з утворенням пропіленгліколю. Саме у виробництві останнього полягає головне застосування епоксипропану. Крім цього він є вихідною сировиною для виробництва пропіленкарбонату, ізопропаноламінів, поліоксипропіленполіолів, поліпропіленоксиду, пропіленоксидних каучуків, пропіленсульфіду, деяких поверхнево-активних речовин.
Епоксипропан володіє цитотоксичною та мутагенною дією. Гранично допустима концентрація — 1мг/м3[1].
Відкриття[ред. | ред. код]
Епоксипропілен відкритий Йоганом Озером, коли він обробляв 1-хлоропропан-2-ол їдким калієм[2]:
Аналогічний результат отримав Костянтин Красуський при дії на 1-хлорпропан-2-ол оксиду свинцю і води[3].
Отримання[ред. | ред. код]
Отримання епоксипропілену через пропіленхлоргідрин[ред. | ред. код]
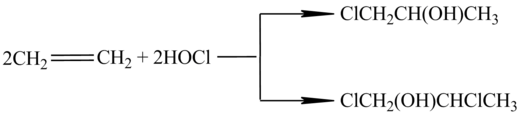
Метод отримання епоксипропілену шляхом приєднання гіпохлоритної кислоти до пропілену, вперше докладно описаний В. Марковніковим, досі є найпоширенішим[4]. Процеси, що протікають при цьому можна записати таким чином:
Мольне співвідношення α- і β-пропіленхлоргідринів становить 9:1.
У результаті впливу елементарного хлору на пропілен і хлоргідрин як побічні продукти утворюються дихлорпропан і дихлордиізопропіловий ефір:
Оскільки приєднання хлору відбувається значно швидше, ніж приєднання гіпохлоритної кислоти, потрібно за можливості пригнічувати реакцію хлору з пропіленом[5]. Для цього взаємодію хлору з водою слід проводити в окремій колоні. Власне хлоргідринування відбувається в наступній — другій колоні. Велике значення має хороший контакт між рідкою фазою і вуглеводнем. Доцільно вибрати двокамерну установку.
При промисловому одержанні процес найкраще йде в реакторі з подвійною камерою, який застосовується для перетворення етиленхлоргідрину[6]. При порівнянних робочих умовах вихід в такому реакторі становить 87,5% пропіленхлоргідрину з одночасним утворенням 11,0% пропілендихлориду і 1,5% дихлордиізопропілового ефіру. На противагу цьому реактор з однією камерою дає тільки 69,2% продукту і 21,6% прореагованого пропілену осаджується у вигляді пропілендихлориду, а 9,2% перетворюється в дихлордиізопропіловий ефір. Це свідчить про безсумнівну перевагу двокамерної системи для процесу перетворення пропілену в хлоргідрин. У першій камері такої установки хлор розчиняється разом із поданою свіжою водою в циркулюючому пропіленхлоргідрині, також попередньо розбавленому водою. Після введення хлор-суміш подається в другу камеру, де потрапляє в потік пропілену, і реакція закінчується.
При хлоруванні пропілену не можна уникнути утворення побічних продуктів, оскільки в розчині хлоргідрину поряд з вільною HOCl є ще вільні HCl і Cl2. Реагуючи з пропіленом, Cl2 викликає утворення 1,2-дихлоропропану, а в результаті реакції з пропіленхлоргідрином виходить дихлордиізопропіловий ефір. Для пригнічення побічних реакцій необхідно працювати при температурі нижче 50—60 °С.
Отримання епоксипропану прямим окисленням[ред. | ред. код]

Якщо отримання оксирану вже віддавна здійснюють прямим окисненням на срібних каталізаторах, то виробництво епоксипропану все ще базується на класичному методі хлоргідруванні. Вихід епоксипропану при прямому окисненні пропілену досі залишається незначним, хоча роботи з дослідження цього процесу почалися ще в 30-х роках 20-го століття. Досліди з дослідження прямого окиснення пропілену в епоксипропан з отриманням хорошого виходу тривають і в даний час.
Окиснення пропілену в рідкій фазі під тиском[ред. | ред. код]
Перші досліди з прямого окиснення пропілену в епоксипропан в рідкій фазі були описані в 1957 році в американському патенті[7]. Окисненню піддають або чистий пропілен при 21,1 кгс/см2 і 175–225 °С, або суміш пропілену і пропану (1:1) при 52,7 кгс/см2 і 160–180 °С у присутності пропіонату мангану, розчиненого в бензену. Щоб уникнути гідролізу епоксипропану в пропіленгліколь необхідно працювати з інертним розчинником. По відношенню до витраченого пропілену вихід процесу становить 40% епоксипропану і 20% пропіленгліколю поряд з кислотами, діоксидом вуглецю та метилформіатом. Добавка пропану підвищує вихід. Як розчинники використовують сполуки, які інертні до кисню та епоксипропану, не змішуються з водою і розчиняють великі кількості пропілену: бензен, ізооктан, неопентан, ізододекан і т. д. Можна проводити окиснення в толуені при підвищених температурах (210—230 °С) при введенні водного фосфатного буферу (pH = 6,5)[8].
Доброму окисненню пропілену в ароматичних вуглеводнях сприяє додавання до реакційної суміші Na2CO3[9] або К2CO3[10] для нейтралізації утворених кислот. За першим методом при конверсії 12,5% отримують 28,8 мол. % епоксипропану і 18 мол. % пропіленгліколю поряд з кислотами і ефірами. Для ініціювання реакції рекомендується вводити сполуки з карбонільними або карбоксильними групами, наприклад пропаналь або ацетальдегід. За другим методом, завдяки спеціальній конструкції реакційної камери, отримують високу конверсію (94,2%) і високий вихід на одиницю об'єму за одиницю часу: 100 г/год епоксипропану і 50 г/год пропіленгліколю[10].
Проведені дослідження рідкофазного окиснення пропілену показали, що при 145—220 °С і тиску 2—10 кгс/см2 нафтенат мангану є найкращим за селективністю каталізатором для утворення епоксипропану[11][12]. Індукційний період скорочують підвищенням парціального тиску кисню і концентрації пропілену, а також добавкою раніше отриманого оксидату. Збільшення температури реакції чинить аналогічну дію. Окиснення протікає за радикальним механізмом, обривають ланцюг перекисні сполуки типу СН2=СН-СН2O2.
Епоксипропан можна виділити шляхом екстрагування водою під тиском при 20 °С[13].
Окиснення без тиску при 200 °С можна проводити в багатьох розчинниках (диметилфталат, силіконове масло, флуорорвуглеводні, дибутилсебацінат та ін.), але конверсія становить лише 1,0—1,5% на годину, селективність — не вище 55—60%[14]. Для окиснення під тиском рекомендуються нітрили, наприклад ацетонітрил[15].
Окиснення пропілену в газовій фазі[ред. | ред. код]
За даними фірми Farbenfabriken Bayer в окиснювальний реактор, який складається з підігрівального пристрою, реакційної камери об'ємом 0,8 л і холодильника, при 9 кгс/см² подають щогодини 20 м— газової суміші з вмістом 45% об'ємних пропілену і 5% об'ємних кисню (решту становить переважно азот, монооксид і діоксид вуглецю)[16]. У підігрівачі підтримується температура 280—300 °С, в реакційній камері вона підвищується до 430–450 °С. У результаті реакції окиснення вміст кисню падає до 0,5—1% об'ємних. Реакційна суміш, що виходить з окисної печі, охолоджується і промивається водою під тиском.
З решти газоподібних фракцій, що містять поряд з пропіленом кисень, азот, монооксид і діоксид вуглецю, виділяють монооксид вуглецю і перетворюють його в діоксид, який потім видаляють промиванням лугом. До газів, що залишилися, додають відпрацьований пропілен з киснем, і суміш знову подають через компресор в окиснювальний реактор.
Хімічні властивості[ред. | ред. код]
Хімічні властивості епоксипропану подібні до властивостей оксирану. Він також реагує зі сполуками, що мають активні атоми Гідрогену, наприклад з водою дає пропіленгліколь. Гідратація епоксипропану легко йде при звичайній температурі у присутності щавлевої кислоти як каталізатора, яку згодом легко можна виділити у вигляді оксалату кальцію. Реакція проходить у кислому розчині майже у 5 разів швидше, ніж у випадку з оксираном.
При реакції епоксипропану з водним розчином аміаку утворюється переважно тільки ізомерний моноізопропаноламін і більші чи менші кількості ди- та триізонропаноламіну в залежності від співвідношення вихідних продуктів.
При каталітичному приєднанні спиртів і фенолу в результаті дії лугу майже завжди утворюється первинний моноефір пропіленгліколю:
Кислотна або некаталітична реакція дає крім того і вторинний ефір пропіленгліколю CH3CH(OR)CH2OH}.
Полімеризація епоксипропану приводить до утворення поліпропіленгліколю.
Ізомеризація епоксипропану в пропаналь (пропіоновий альдегід) легко проходить на таких каталізаторах, як Cr2O3—CdCl2—CdO, Cr2O3—WO3—Fe2O3 або Cr2O3 — WO3.
При використанні Li3PO4[17][18][19][20] або Li3AsO4[21] можна перегрупувати епоксипропан в аліловий спирт (2-пропен-1-ол).
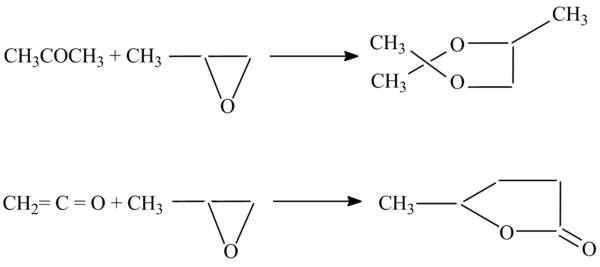
З альдегідами і кетонами епоксипропан утворює циклічні ацеталі, з кетенами γ-лактони, наприклад[1]:
Застосування[ред. | ред. код]
Основна кількість епоксипропану йде на виробництво поліуретанових пластмас та пропіленгліколю. Останній є вихідним продуктом для виробництва поліефірів.
Полілропіленгліколь (діапазон молекулярних мас від 400 до 2000), який отримують полімеризацією епоксипропану в лужному або кислому середовищі, є важливим проміжним продуктом для виробництва пінополіуретанів, алкідних смол, емульгаторів, деемульгаторів, мастильних засобів, гальмівних рідин[22]. Дипропіленгліколь окремо і разом з диетиленгліколем використовується при отриманні друкарських фарб і як гідравлічна рідина з низькою температурою затвердіння. Він володіє незначною токсичністю в порівнянні з етиленгліколем, що дозволяє застосовувати його при виготовленні фармацевтичних і косметичних засобів, а також харчових продуктів. Суміш поліетилену з поліпропіленгліколем є вихідною речовиною для одержання неіоногенних детергентів і спеціальних мастил.
Ізопропаноламіни, які отримують взаємодією епоксипропану з аміаком, є проміжним продуктами для синтезу барвників, фармацевтичних засобів і, за певних умов, поліефірних амідів.
Можливість ізомеризації епоксипропану за допомогою Li3PO4[17] або Li3AsO4[21] в аліловий спирт і в пропіоновий альдегід використана в промисловості фірмою Olin Mathieson Chemicals Ltd., яка розробила на основі цього методу процес синтезу гліцерину[23].
Співполімеризація епоксипропану з іншими ненасиченими епоксисполуками (епоксибутадієн, алілгліцидиловий ефір, оксид вінілциклогексену та ін.) в присутності каталізатора приводить до отримання каучукоподібних полімерів, сфера застосовуються яких є досить широкою[24][25].
Фізіологічний вплив[ред. | ред. код]
Загальний характер дії[ред. | ред. код]
Викликає гемодинамічні розлади, можливо внаслідок підвищення концентрації гістаміну та інших біологічних активних речовин. Епоксипропану властива цитотоксична, а також мутагенна дія.
Гостре отруєння[ред. | ред. код]
Тварини[ред. | ред. код]
Викликає загальне збудження, рухову активність, яка змінюються адинамією, почастішання дихання і пульсу, порушення координації, слинотечу, клонічні судоми. Наркотична дія виражена слабко, проте чітко проявляється подразнююча дія. При гострому отруєнні відбувається різке згущення крові і підвищення вмісту гістаміну в ній (одночасно зі зниженням в печінці та кишечнику). Для білих мишей при експозиції 2 год ЛК50 = 4,2; 4,5 і 6,2 м/л (за різними даними): для білих щурів 9,5—10 мг/л. При введенні в шлунок для мишей і щурів ЛД50 = 580 і 750 мг/кг відповідно[26][27]. Концентрація, яка змінює нервово-м'язову збудливість у щурів при одноразовому впливі, 0,02 мг/л. Після введення епоксипропану в шлунок у повітрі, що видихалося, та крові отруєних тварин виявлявся формальдегід. Терапевтичний ефект здійснював тіосульфат натрію. При його застосуванні виживали смертельно отруєні щурі та кролики. Гемодіаліз різко знижував концентрацію формальдегіду в крові. У загиблих тварин фіксувалося білкове і жирове переродження клітин печінки, застійне повнокров'я нирок, селезінки, бронхіти, пневмонія[28].
Людина[ред. | ред. код]
Поріг сприйняття запаху 0,36 мг/л. Описано гостре отруєння при аварії, коли потерпілий протягом 10—15 хв вдихав (без будь-якого захисту) епоксипропан концентрацією 1400–1500 мг/л. У цьому випадку людина відразу відчула стиснення в грудях, подразнення слизових оболонок, пізніше різкий головний біль, слабкість, пронос, непритомний стан, колапс. Після відповідної терапії залишилися загальмованість, сильна слабкість, пронос, блювота, блідість, ціаноз, слабкий пульс, жорстке дихання, судоми м'язів гомілки. При застосуванні антигістамінних препаратів і тіосульфату натрію настало швидке поліпшення. Через десять днів залишилася ще слабкість[27].
Хронічне отруєння[ред. | ред. код]
Повторні отруєння парами епоксипропану протягом 112—218 днів по 7 год в день 5 разів на тиждень у кроликів і мавп не викликали жодних симптомів, у білих щурів і морських свинок — подразнення слизових оболонок, незначне уповільнення росту, загибель тварин переважно внаслідок запалення легень. Вдихання 0,037—0,025 мг/л протягом 6 місяців по 4 год в день викликало у щурів фазні зміни біопотенціалів мозку і нервово-м'язової збудливості, зниження артеріального тиску, порушення антитоксичної функції печінки та білкового обміну. Відзначений лімфоцитоз з відповідною нейтропенією.
Невідкладна терапія[ред. | ред. код]
При інгаляційному отруєнні необхідно негайно забезпечити потерпілому доступ свіжого повітря, спокій, серцеві та інші засоби за показаннями, крапельне вливання глюкози, вітаміни, антигістамінні засоби (димедрол, піпольфен). Можливе швидке застосування тіосульфату натрію, яке сприяє, крім того, дегідратації тканин, збільшуючи масу циркулюючої крові). При важких отруєннях — обов'язкова госпіталізація.
Див. також[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Епоксипропан |
Примітки[ред. | ред. код]
- ↑ а б Химическая энциклопедия / Под. ред. Зефирова Н. С. — Москва: Большая российская энциклопедия, 1995. — Т. 4, с. 105 (рос.)
- ↑ Oser, Justus Liebigs Annalen der Chemie, 1, 255 (1861) (нім.).
- ↑ К. Красуский, Журнал Русского физико-химического общества, 34, 287–315 (1902) (рос.).
- ↑ W. Markownikow, Zeitschrift für anorganische und allgemeine Chemie, 423 (1870) (нім.).
- ↑ G. С. Israel, Journal of the Chemical Society (London), 1950, 1282–1286 (англ.).
- ↑ M. P. Ferrero et al., Ind. Chim. beige, 19, 133 (1954) (англ.).
- ↑ Патенти США 2780634, 2780635, 2784202, 1957 (англ.).
- ↑ Патент США 2824119, 1958 (англ.).
- ↑ Англійський патент 950669, 1964 (англ.).
- ↑ а б Французький патент 1334158, 1963 (фр.).
- ↑ J. Imamura et al., Tokyo Kogyo Shikensho Hokoku, 59, № 10, 447–457 (1964) (яп.).
- ↑ J. Imamura et al., Kogyo Kagaku Zasshi, 67, № 7, 1026–1031 (1964) (яп.).
- ↑ D. A. S. 1192171, 1965 (нім.).
- ↑ F. W. Meadow, K. U. Ingold. The Canadian Journal of Chemical Engineering, 42, № 2, 86—87 (1964) (англ.)
- ↑ Патент США 3210380, 1965 (англ.).
- ↑ Бельгійський патент 623552, 1963 (англ.).
- ↑ а б L. G. Lundstedt et al., Industrial & Engineering Chemistry, 43, 728–730 (1951) (англ.).
- ↑ П. Г. Сергеев и др. Химическая наука и промышленность, 2, 133 (1957) (рос.).
- ↑ Патент США 2986585, 1961 (англ.).
- ↑ Англійський патент 902953, 1962 (англ.).
- ↑ а б Патент США 3209037, 1965 (англ.).
- ↑ Kirk — Othmer, Encyclopedia of Chemical Technology, N. Y., v. 7, 1951, p. 261–262 (рос.).
- ↑ Патенти США 2426264, 1947; 2435460, 1948; 2521170, 1949 (англ.).
- ↑ Е. Е. Gruber et al., Industrial & engineering chemistry product research and development, 3,. 194–199 (1964) (англ.).
- ↑ L. Marker et al., Kautschuk, Gummi, Kunststoffe, 19, 337 (1966) (нім.).
- ↑ Пугаев В. П. и др. Гигиена труда, 1970, № 11, с. 55—58 (рос.).
- ↑ а б Беляев В. А. и др. Гигиена труда, 1971, № 2, с. 48—49 (рос.).
- ↑ Беляев В. А., Политыкии А. Я. Фармакология и токсикология, 1971, т. 34, № 3. с. 362–364 (рос.).
Джерела[ред. | ред. код]
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Химическая энциклопедия / Под. ред. Зефиров Н. С. — Москва : Большая российская энциклопедия, 1995. — Т. 4. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Изд. 7. — Ленинград : Химия, 1976. — Т. 1. — С. 478-479. — 49000 прим. (рос.)
Посилання[ред. | ред. код]
- National Institute of Standards and Technology (англ.) . Архів оригіналу за 23 вересня 2008.
- Вплив епоксипропану на навколишнє середовище (англ.) . Архів оригіналу за 11 січня 2013.
| ||||||||||||||||||||
| | Ця стаття належить до добрих статей української Вікіпедії. |


 French
French Deutsch
Deutsch










![{\displaystyle \mathrm {nCH_{3}CHCH_{2}O\longrightarrow HO[{-}CH_{2}{-}CH(CH_{3})O{-}]_{n}H} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e6c9c1a94b77254be2a6a02552b3975e88482f6)