Правило 18 електронів — Вікіпедія
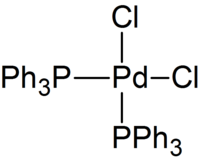
Пра́вило 18-ти електро́нів (англ. 18-Electron rule) — емпіричне правило для передбачення стабільних металоорганічних комплексів.
Загальний опис[ред. | ред. код]
Це правило базується на тому факті, що перехідний метал може мати у зовнішній (валентній) електронній оболонці 18 електронів у випадку повного її заповнення. В такому випадку метал набуває електронної конфігурації інертного газу. Заповнення орбіталі відбувається за рахунок як власних електронів металу, так і за рахунок електронів лігандів. Число 18 випливає з того, що потрібно заповнити одну s-орбіталь, п'ять d-орбіталей і три р-орбіталі, на кожній з яких згідно з принципом Паулі може бути по 2 електрони.
Це правило формальне і має лише дотичне відношення до реального розподілу електронів у комплексі. Так, при ковалентному способі підрахунку електронів доводиться визначитися з типом кожного зв'язку метал—ліганд.
Правило 18-ти електронів було запропоноване американським хіміком Ірвінгом Ленгмюром в 1921 році[1][2].
Підрахунок електронів[ред. | ред. код]
Для підрахунку кількості електронів у валентній оболонці можна використовувати два підходи: ковалентний підрахунок та іонний підрахунок.
Ковалентний підрахунок[ред. | ред. код]
При ковалентному (нейтральному) підрахунку вважається, що всі зв'язки лігандів з металом є ковалентними.
Для підрахунку кількості електронів просумовуються:
- кількість електронів на зовнішньому енергетичному рівні центрального атому (наприклад, 8 — для Феруму, 3 — для Бору);
- по 1 електрону для кожного аніонного ліганду (X), який зв'язаний з центральним атомом σ-зв'язком (наприклад, для кожного галогену пов'язаного з центральним атомом);
- по 2 електрони для кожного ліганду, який дає свою пару електронів центральному атому (ліганд типу L; наприклад, трифенілфосфін); сюди відносять основи Льюїса, алкени, алкіни;
- для багатоядерних комплексів: по 1 електрону для кожного зв'язку центрального атома М з атомом металу (зв'язок М—М');
- якщо комплекс заряджений, то додають ще по 1 електрону за кожну одиницю негативного заряду і віднімають за кожну одиницю позитивний.
Іонний підрахунок[ред. | ред. код]
При іонному підрахунку всі зв'язки вважаються іонними. При іонному також вираховується ступінь окиснення центрального атому металу, що може бути важливою інформацією. При ковалентного підрахунку ступінь окиснення не визначається.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ The Origin of the 18-Electron Rule William B. Jensen Journal of Chemical Education 2005 82 (1), 28 DOI:10.1021/ed082p28
- ↑ Langmuir, I. (1921). Types of Valence. Science. 54 (1386): 59—67. doi:10.1126/science.54.1386.59.
Література[ред. | ред. код]
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
| |||||||||||||||||||||||
 | Це незавершена стаття з хімії. Ви можете допомогти проєкту, виправивши або дописавши її. |


 French
French Deutsch
Deutsch