Коронавірусна хвороба 2019 — Вікіпедія
Коронаві́русна хвороба 2019[39][40] (англ. coronavirus disease 2019, абревіатура COVID-19 затверджена як офіційна скорочена назва[41]) — інфекційна хвороба, яка вперше виявлена у людини в грудні 2019 року в місті Ухань, Центральний Китай. Хвороба почалася як спалах, що розвинувся у пандемію. Причиною хвороби став коронавірус SARS-CoV-2[42], циркуляція якого в людській популяції до грудня 2019 року була невідомою.
Пандемію цієї хвороби Всесвітня організація охорони здоров'я (ВООЗ) визнала надзвичайною ситуацією в галузі міжнародної охорони здоров'я та внесла заходи з боротьби проти неї до тимчасових рекомендацій згідно з Міжнародними медико-санітарними правилами 2005 року[43]. Щоб уникнути стигматизації, пов'язаної з географічним регіоном, де виникли перші випадки захворювання, а також із расовою приналежністю чи певною етнічною групою, ВООЗ затвердила офіційну назву «коронавірусна хвороба 2019 (COVID-19)».
5 травня 2023 року ВОЗ оголосила що зараз коронавірусна хвороба 2019 є встановленою та постійною проблемою суспільної охорони здоров'я, яка більше не є надзвичайною ситуацією в галузі охорони здоров'я міжнародного значення.[44][45]. За час пандемії по світу захворіло 687,69 млн людей. Понад 6,8 млн померли. Одужали 660 млн[46].
Етіологія[ред. | ред. код]
Родина Coronaviridae (CoV, коронавіруси) включає дві підродини, 5 родів, 23 триби та приблизно 40 відомих видів. Багато з цих вірусів спричинюють захворювання у ссавців і птахів, можуть передаватися від тварин до людей. Коронавіруси людини (hCoV) були вперше описані в 1965 році. Відомі коронавіруси людини 229E, NL63, OC43, HKU1, й зоонозні за походженням MERS-CoV і SARS-CoV переважно належать до роду бетакоронавірусів. Наприкінці грудня 2019 року в Ухані (Китай) вперше виявлено новий патогенний бетакоронавірус людини, який отримав назву SARS-CoV-2. Він є третім коронавірусом людини, який імовірно прийшов за останні два десятиліття від тваринного джерела, став загалом сьомим із відомих людських коронавірусів.
Геномні дослідження[ред. | ред. код]
Порівнювання повнорозмірної послідовності геному SARS-CoV-2 та інших доступних геномів бетакоронавірусів показали, що у нього найтісніший зв'язок із кажанним штамом ВАРС BatCov RaTG13, гомологічність досягає 96 %, за іншими даними — 98 %. Із SARS-CoV (збудником тяжкого гострого респіраторного синдрому / SARS / ТГРС) гомологічність сягає 79 %, з вірусом MERS-CoV, причиною близькосхідного респіраторного синдрому — 50 %[47].
Існують заяви стосовно штучного походження цього збудника, але деякі науковці та дослідницькі організації це спростовують, стверджуючи, що він має безперечно тваринне походження[48]. ВООЗ заявила, що усі наявні докази свідчать про те, що SARS-CoV-2 має тваринне джерело. Багато дослідників змогли вивчити геномні особливості цього вірусу і виявити, що немає підтвердження того, що SARS-CoV-2 є лабораторною конструкцією. Побудований вірус демонстрував би поєднання відомих елементів у геномних послідовностях — а це не так[49]. Науковці Центрів з контролю та профілактики захворювань у США (CDC) проаналізували геном SARS-COV-2, отриманого від першого пацієнта в США, який захворів 24 січня 2020 року, зробивши висновок, що послідовність майже ідентична послідовностям, про які повідомляли китайські науковці[50].
Досліджено ступінь молекулярної дивергенції між SARS-CoV-2 та іншими коронавірусами. Хоча виявлено лише 4 % варіабельності геномних нуклеотидів між SARS-CoV-2 та SARS-CoV відносно кажанного RaTG13, різниця у нейтральних ділянках становила 17 %, що дозволяє припустити, що розбіжність між двома вірусами значно більша, ніж раніше оцінювалось. Усі коронавіруси мають специфічний спосіб проникнення в клітини хазяїна — за допомогою особливого білка на зовнішніх шипах. Відбулося утворення нових варіацій функціональних ділянок у рецептор-зв'язуючому домені (RBD) шипа, що спостерігається у SARS-CoV-2 та вірусу панголіну SARSr-CoV, геном якого на 90 % збігається з геномом SARS-CoV-2. Було зроблено висновок, що це, ймовірно, спричинено мутаціями та природним добором, проте не рекомбінацією. Вияснено, що структура шипів у вірусів панголіну і SARS-CoV-2 збігається на 99 %, а ось ступінь подібності зовнішніх шипів у кажанного і SARS-CoV-2 становить всього 77 %. Зроблено висновок, що після переходу SARS-CoV-2 від кажанів до людини приблизно вдесятеро збільшилася частка мутацій нуклеотидів РНК G в U.[51][52] Припускається, що кажанний і панголіновий віруси могли в організму якоїсь тварини на одній із тваринних ферм Китаю утворити SARS-CoV-2, який із цією або цими тваринами потрапив до ринку в Ухані. Також повідомляється про новий коронавірус, що виявлений у кажанів, який позначається як RmYN02. Він ідентифікований за допомогою метагеномічного аналізу зразків від 227 кажанів, зібраних у провінції Юньнань у Китаї в період із травня по жовтень 2019 року. Зокрема, RmYN02 має 93,3 % ідентичності нуклеотидів із SARS-CoV-2 за шкалою повного геному вірусу та 97,2 % ідентичності за геном 1ab, за яким він є найближчим родичем SARS-CoV-2 серед повідомлених на середину 2020 року. При цьому RmYN02 виявив низьку ідентичність послідовності (61,3 %) до SARS-CoV-2 в домені, що зв'язує рецептор (RBD), і не може зв'язуватися з ангіотензинперетворювальним ферментом 2 (ACE2). Аналогічно SARS-CoV-2, RmYN02 характеризувався введенням декількох амінокислот у місці стику S1 і S2 субодиниць білка шипа. Це дає вагомі докази того, що подібні події вставки можуть відбуватися природним шляхом у бетакоронавірусів тварин[53]. У вересні 2021 року у підковоносного кажана з печери у провінції В'єнтьян на заході Лаоса знайдено коронавірус, який є генетично ближчим до Sars-CoV-2, ніж вірус RaTG13, знайдений у Китаї в 2013 році, що вважався попередником SARS-CoV-2. Вірус названо Banal-52, і він має 96,8 % ідентичності нуклеотидів із SARS-CoV-2 за шкалою повного геному вірусу, тоді як RaTG13 — 96,1 %[54].
Першовідкривач ВІЛ Нобелівський лауреат, вірусолог Люк Монтаньє стверджував, що пандемія коронавірусу 2019 року була створена людиною в лабораторії і це може бути результатом спроби створити вакцину проти ВІЛ-інфекції. За його словами, «наявність елементів ВІЛ і малярійного плазмодія в геномі коронавірусу є дуже підозрілими, і такі характеристики вірусу не могли виникнути природним шляхом»[55].
Філогенетичні оцінки стверджують, що циркуляція SARS-CoV-2 серед людей і, відповідно, пандемія COVID-2 почалася приблизно в період 6 жовтня — 11 грудня 2019 року. 198 ділянок геному SARS-CoV-2 станом на липень 2020 року зазнали мутацій. Виявлені мутації можуть вказувати на постійну адаптацію SARS-CoV-2 до його людського хазяїна[56].
Головні мутаційні лінії SARS-CoV-2[ред. | ред. код]
SARS-CoV-2, як й інші віруси, в ході еволюції набуває мутації. Ті з них, які допомагають вірусам краще розмножуватися і поширюватися, зберігаються в геномі, інші ж еволюція відкидає. Таким чином з'являються нові варіанти SARS-CoV-2. Дослідження раніше показували, що у SARS-CoV-2 мутації з'являються приблизно раз у два тижні. У більшості випадків вірус передається або знищується до того, як встигає почати мутувати. Це означає, що ймовірність того, що SARS-CoV-2 буде мутувати в організмі пацієнта, не дуже велика. Проте проведені у 2021 році дослідження показали, що у фокус уваги авторів ранніх досліджень потрапляли тільки успішні мутації, а ті, що не дозволяли вірусу довго виживати в організмі пацієнта, просто не враховувалися. Якщо взяти до уваги такі мутації, то швидкість зміни геному SARS-CoV-2 може бути вище, ніж вважали раніше — на 49-67 %[57].
6 листопада 2020 року ВООЗ повідомила, що з червня 2020 року в Данії, регіон Північна Ютландія, виявлено 214 випадків захворювання людей коронавірусною хворобою 2019, що спричинили штами вірусу, з яких 12 є унікальними, пов'язаними з норками. Вісім із цих людських випадків чітко пов'язані з вирощуванням норок. Клінічні прояви, тяжкість і передача інфекції серед інфікованих аналогічні іншим штамам SARS-CoV-2, що циркулюють. Проте цей штам, названий варіантом «кластера 5», має комбінацію мутацій, що раніше не спостерігалися, і їхнє значення уточняється[58].
Чергова мутація SARS-CoV-2 виявлена у Великій Британії у вересні 2020 року. VOC-202012/01 / B.1.1.7 ідентифікований шляхом вірусного геномного секвенування. Цей варіант містить 23 нуклеотидні заміни і не є філогенетично пов'язаним із вірусною лінією SARS-CoV-2, що циркулювала у Сполученому Королівстві на момент виявлення цього мутаційного варіанту. Як і звідки виник SARS-CoV-2 VOC 202012/01, незрозуміло. Цей варіант визначається наявністю діапазону з 14 мутацій, що призводить до змін амінокислот і трьох делецій. Деякі з цих мутацій можуть впливати на передачу вірусу у людей. Ця нова вірусна лінія поширилася у 2020 році у країні й витіснила там інші мутаційні лінії. Наслідки цього вивчені, зрештою не виявлено збільшення летальності чи тяжкості хвороби, хоча не виключено підвищення рівня контагіозності від відомого до цього поширення пандемії 1:1,5 (від одного зараженого заражаються 1,5 людини) до 1:1,7. Загалом 1108 випадків зараження цим варіантом виявлено у країні станом на 13 грудня 2020 року. Більшість випадків хвороби, коли був ідентифікований цей варіант, мали місце у людей віком до 60 років. Новий варіант ідентифікований станом на 30 грудня ще у 31-й країні / території, включаючи Австралію, Данію, Італію, Ісландію та Нідерланди[59][60]. ЄвроCDC оцінила ймовірність поширення цього варіанту, що викликає занепокоєння, в Європейському Союзі як дуже високу через підвищену передачу, що призвело до збільшення кількості випадків захворювання. Це, в свою чергу, призвело до вищого рівня госпіталізації та летальності серед усіх вікових груп, але особливо для осіб старшого віку та тих, хто мають супутні захворювання[61]. Отримані результати порівняння кількості випадків смерті померлих не з категорій ризику від первинної лінії коронавірусу, що циркулювала з початку пандемії, і від B.1.1.7 показало розбіжність, що становило 1,64 (95 % довірчий інтервал 1,32-2,04). У цій порівняно низькій групі ризику це означає збільшення смертності з 2,5 до 4,1 на 1000 виявлених випадків[62].
18 грудня 2020 року влада ПАР оголосила про виявлення нового варіанту SARS-CoV-2, який швидко поширився в трьох провінціях Південної Африки. Там назвали цей варіант 501Y.V2 через мутацію N501Y. Хоча SARS-CoV-2 VOC 202012/01 із Великої Британії також має мутацію N501Y, філогенетичний аналіз показав, що 501Y.V2 з Південної Африки — це інша мутаційна лінія вірусу. Починаючи з 16 листопада 2020 року виявлено, що цей новий варіант SARS-CoV-2 значною мірою замінив інші вірусні лінії SARS-CoV-2, які циркулювали у провінціях Східного Капського мису, Західної Капської провінції та Квазулу-Натал. Хоча одержані дані геномного дослідження показали, що варіант 501.V2 швидко витіснив інші лінії коронавірусу, що циркулюють у Південній Африці, і попередні дослідження показали, що цей варіант пов'язаний із більшим вірусним навантаженням, підвищенням активності передачі. Загалом не знайдено чітких доказів того, що новий варіант пов'язаний з тяжчим клінічним перебігом захворювання або гіршими наслідками.
ВООЗ анонсувала нову систему назв для мутаційних ліній / штамів SARS-CoV-2. З 1 червня 2021 року ВООЗ використовує літери грецької абетки для тих штамів, які раніше називали британським, південноафриканським, індійським тощо. Для:
- британського (вересень 2020) GR/501Y.V1 / B.1.1.7 обрали літеру «Альфа» (грец. Ά),
- для південноафриканського (травень 2020) GH/501Y.V2 / B.1.351 — «Бета» (грец. Β),
- для пізнього бразильського (листопад 2020) GR/501Y.V3 / P.1 — «Гамма» (грец. Γ),
- для індійського (жовтень 2020) G/452R.V3 / B.1.617.2 — «Дельта» (грец. Δ),
- для раннього американського (березень 2020) GH/452R.V1 / B.1.427/B.1.429 — «Епсилон» (лат. Έ),
- для раннього бразильського (квітень 2020) GR / P.2 — «Зета» (грец. Ζ),
- для всесвітньо поширеного (грудень 2019) G/484K.V3 / B.1.525 — «Ета» (грец. Ή),
- для філіппінського (січень 2021) GR / P.3 — «Тета» (грец. Θ),
- для пізнього американського (листопад 2020) GH / B.1.526 — «Йота» (грец. Ί),
- для ще одного індійського (жовтень 2020) G/452R.V3 2 / B.1.617.1 — «Каппа» (грец. Κ),
- для перуанського (грудень 2020) GR/452Q.V1 / C.37 — «Лямбда» (грец. Λ),
- для колумбійського (січень 2021) GH / B.1.621 — «Мю» (грец. Μ),[63]
- для південноафриканського (листопад 2021) GR/484A / B.1.1.529. — «Омікрон» (грец. Ο)[64].
Це зроблено для того, щоб спростити найменування і подолати стигму довкола країн походження мутаційних ліній[65][66]. Також виявлений «безіменний варіант» (англ. Unnamed variant) B.1.617.3. У США запропонували його вважати таким, «що викликає інтерес», тоді як ВООЗ так не вважає. Вперше цей варіант був ідентифікований в Індії в жовтні 2020 року і має ту саму батьківську лінію, що і «Дельта». Останній випадок був зареєстрований у США в квітні 2020 року, і в усьому світі зараз він становить <0,5 % усіх випадків зараження. Може мати властивості, що дозволяють ухиляються від антитіл, як це є у варіантів «Ета» і «Каппа»[67].
На червень 2021 року «Дельта» класифікований CDC як варіант, який «представляє інтерес», тобто має генетичні маркери, пов'язані зі зниженням нейтралізації антитілами, створеними в результаті перенесеного захворювання або внаслідок вакцинації, зменшенням ефективності лікування, труднощами специфічної діагностики, збільшенням заразливості та тяжкості хвороби. Він виник наприкінці минулого року в Індії, загалом зареєстрований вже повсюдно. Абсолютно очевидно, що його заразливість вище, щонайменше ніж у «Альфа», бо на відміну від нього йде більша реплікація у структурах носа, через що у клінічній картині хвороби переважає нежить зі значним виділенням внаслідок цього коронавірусу у довкілля. Його вірусне навантаження в організмі людини в тисячі разів більше від такого при зараженні варіантами «Ета» і «Альфа». Пік захворюваності реєструється у молодих людей 12-20 років[68]. Велике британське національне дослідження виявило більший ризик госпіталізації та невідкладної інтенсивної допомоги для пацієнтів, інфікованих варіантом «Дельта», порівняно з «Альфа». Результати свідчать про те, що ураження варіантом «Дельта» у невакцинованих популяціях призводить до більшого навантаження на медичні служби, ніж при ураженні варіантом «Альфа»[69]. Станом на кінець 2021 року хвороба, яку продовжує спричиняти цей варіант, призводить до щоденної смерті в середньому до 1300 громадян США[70].
Продовжується спостереження за поширенням нового субваріанту «Дельта-плюс». Варіант «Дельта» наприкінці 2021 року був домінуючим варіантом у світі. Але зокрема у Великій Британії останні офіційні дані свідчать про те, що 6 % випадків зумовлено субваріантом «Дельта-плюс» (Y.4.2), що містить мутацію, яка може дати переваги виживанню вірусу. Ця мутація K417N впливає на білок-шип, необхідний вірусу для зараження клітин, і це є основною мішенню для мРНК та інших вакцин.
Є вже вагомі свідчення, що варіант «Омікрон» здатний заражати людей у 70 разів швидше, ніж попередні варіанти. Його коефіцієнт заразності досягає 3,5, тоді як у варіанту «Дельта» — 0,85. Проте масштаб його відтворення є удесятеро меншим, ніж у початкового варіанту SARS-CoV-2. Припускають, що «Омікрон» буде спричиняти менш тяжкий перебіг хвороби, проте цей дуже заразний варіант хоч і може бути менш хвороботворним, здатен інфікувати набагато більше людей і може спричинити більше випадків серйозного перебігу хвороби та летальних наслідків. З цієї причини і беручи до уваги попередні дослідження про здатність «Омікрону» частково обходити вакцинний імунітет та спричинити повторні випадки захворювання коронавірусною хворобою 2019, загальна загроза від нього, ймовірно, дуже значна[71]. Виявлено, що цей варіант має більше 30 мутацій у S-білку вірусу, 15 з яких знаходяться у рецепторзв'язувальному домені. Через це він позбавлений можливості ефективного зв'язування з рецепторами, уникає дії нейтралізуючих антитіл до інших варіантів SARS-CoV-2. Чимраз більше даних про те, що він поступається тяжкістю клінічного перебігу іншим варіантам, проте компенсує це полегшеною передачею, що веде до швидкого наростання захворюваності. Навіть удвічі менш вірулентний варіант може завдати набагато більших збитків, якщо він до того ж поширюється в кілька разів швидше. Три чверті перших випадків, спричинених варіантом «Омікрон» у США було зареєстровано серед вакцинованих або вже перехворілих. У Данії, де ведеться один із найкращих у світі епіднагляд за варіантами, частка таких випадків була такою ж. В інших регіонах світу цей показник становив 80 % або вище. Припускається, що саме ті, хто не захищений вакцинацією, будуть набувати імунітет від зустрічі з відносно менш небезпечним варіантом SARS-CoV-2. Його швидке зростання, ймовірно, відбувається за рахунок поширення серед уже захищених, вакцинованих людей. Проговорена думка, що цей варіант поширюється в популяції не замінивши повністю циркуляцію варіанту «Дельта», а отже йдуть паралельно 2 хвилі пандемії, чого не спостерігалось від початку її. Накопичені певні дані свідчать, що вакциновані та особливо щеплені люди виявляються досить добре захищеними від тяжкого перебігу коронавірусної хвороби 2019, спричиненого варіантом «Омікрон», але від зараження — ні. При двох дозах вакцини AstraZeneca захист від зараження дорівнює нулю. Для двох доз вакцини Pfizer — становить лише 30 %. Тому, як припускають епідеміологи, багато щеплених людей заражаються. Є припущення, що перехресний імунітет між варіантами «Омікрон» і «Дельта» дуже низкий через високий рівень дивергенції. Також припускається, що імунітет, отриманий внаслідок хвороби, яку спричинив варіант «Омікрон», не буде захищати від ураження, яке спричинює варіант «Дельта» тою ж мірою, як і ранні варіанти[70]. Виявлений субваріант «Омікрону» (якому дана неофіційна назва стеалс-Омікрон англ. stealth Omicron) BА.2 на відміну від того BА.1, що нині масово циркулює в світі, не просто поширюється швидше, а також може спричинити тяжчий клінічний перебіг і, схоже, здатний перешкодити деяким засобам, які є для лікування та профілактики, зокрема препаратам моноклональних антитіл, показують нові дослідження[72][73].
Чергова мутація виявлена французькими науковцями на чолі з Дідьє Раулем у пацієнтів із коронавірусною хворобою 2019 у госпіталі Форкальк'є, що в департаменті Альпи Верхнього Провансу. Ними виявлено 12 хворих, які заразилися від нульового пацієнта, що до цього приїхав із Камеруна. Цей варіант зареєстрований під назвою B.1.640.2 у мережі GISAID (Глобальна ініціатива щодо обміну даними про пташиний грип). Для того, щоб дізнатися, чи є він більш інфекційним чи спричинює тяжчий перебіг, необхідно провести ретельний епідеміологічний нагляд[74]. У варіанта виявлено 46 мутацій і 37 делецій, що привели до 30 амінокислотних замін. 14 із цих замін і 9 делецій розташовані в спайковому білку SARS-CoV-2 порівняно з первинним варіантом його. Це є, за думкою науковців, ще одним прикладом непередбачуваності появи варіантів SARS-CoV-2, а також їх впровадження в певну географічну зону з-за кордону[75]. Проте ВООЗ заявила, що з 22 листопада 2021 року спостерігає за цим варіантом, не відмічає його широкого поширення — досі його виявлено лише у зразках, взятих від 20 осіб і лише один із них виявлений у грудні 2021 року. ВООЗ надала йому найнижчий за загрозливістю статус «варіант під наглядом» (VUM)[76][77]
Повідомлено про виявлення на Кіпрі нового варіанту «Дельтакрон», який має походження від варіанту «Дельта» з деякими мутаціями, притаманному варіанту «Омікрон», продовжується його вивчення[78].
Варіант Omicron XE є рекомбінантним варіантом Omicron BA.1, оригінального варіанту Omicron та Omicron BA.2. Він має 3 мутації, яких немає у варіанту Omicron BA.1 або BA.2, є ще заразнішим та найпоширенішим у США та більшості країн. Отримані дані свідчать, що варіант Omicron XE за своєю здатністю до легкого поширення нагадує варіант BA.2 та не являє серйозної загрози виникнення швидких або масових спалахів. Рекомбінантні штами добре описані для багатьох інших вірусів і рідко бувають пов'язані з тяжчими випадками. Перші виявлені випадки хвороби, спричиненої Omicron ХЕ, зареєстровані у Великій Британії наприкінці січня 2022 року і в травні 2022 року на їх долю припадало менше 1 % від усіх випадків у цьому регіоні, основним залишався варіант Omicron BA.2 як у Сполученому Королівстві, так і в усьому світі. Виявляли цей варіант також в Таїланді та Індії. Дослідження вказують на ефективність вакцин проти цього варіанту вірусу. Оскільки варіанти Omicron BA.1 і BA.2 є стійкими до деяких моноклональних антитіл, ці препарати, ймовірно, будуть неефективними і проти Omicron XE. Паксловід та молнупіравір, за деякими даними, зберігають ефективність проти цього варіанту вірусу для амбулаторної терапії[79][80].
Ідентифіковано ще два субваріанти SARS-CoV-2 — «Омікрон» BA.3 і BA.4, але даних про їх клінічні особливості та можливість передачі від людини до людини поки що не прояснені. BA.3 має 13 мутацій у спайк протеїні та вперше був ідентифікований в Південній Африці наприкінці 2021 року. Варіанти BA.4 і BA.5 (або B.1.1.529), були підтверджені в Південній Африці та США. Вони мають потенціал для уникнення поствакцинального імунітету і захисту від попередньої інфекції, що є наслідком мутацій. Варіанти «Омікрону» BA.4 і BA.5 виявляються ще заразнішими, ніж BA.2 (Стелс). Випадки захворювання в Південній Африці збільшуються, незважаючи на те, що 90 % населення були вакциновані або хворіли раніше, що ще більше підтверджує прогноз, що цим варіантам не запобігають наявні антитіла.
Новий підваріант «Омікрону», який вперше ідентифікований в Індії в травні 2022 року, ВА.2.75 (Кентавр) виявлено також у США та ще декількох країнах. Його особливістю є ще більша здатність ухилятися від імунітету, ніж це роблять інші варіанти вірусу. Поки що його розглядають як варіант, який викликає інтерес, тому що його заразність, формування ступеню тяжкості клінічного перебігу захворювання і відхилення від імунітету ще вивчаються. Ряд експертів вважають, що наявні 9 додаткових мутацій Кентавра дозволять йому захищатися від природного та штучного імунітету.
Виявлено кілька рекомбінантних форм вірусу, які включають генетичний матеріал Дельта-Омікрон і BA.1-BA.2. Отримані дані свідчать про те, що вони не мають вищий рівень передачі та тяжчі наслідки, ніж вихідні штами.
Культуральні особливості[ред. | ред. код]
Виділення вірусу проводять за допомогою різних клітинних ліній, таких як епітеліальні клітини дихальних шляхів людини, Vero E6 і Huh-7. Цитопатичні ефекти спостерігаються через 96 годин після інокуляції.
Білки та ферменти вірусу[ред. | ред. код]
Як й інші коронавіруси, SARS-CoV-2 має чотири структурні білки, знані як S (шип), E (оболонка), M (мембрана) та N (нуклеокапсид). N білок утримує РНК, а білки S, E і M разом створюють вірусну оболонку.
Подібно до SARS-CoV і MERS-CoV, геном SARS-CoV-2 кодує неструктурні білки (такі як основна 3-хімотрипсин-подібна протеаза, папаїн-подібна протеаза, РНК-геліказа і РНК-залежна РНК-полімераза), структурні білки (глікопротеїни) і допоміжні. Чотири неструктурні білки є ключовими ферментами в життєвому циклі коронавірусу, а поверхневі глікопротеїни необхідні для здійснення зв'язування коронавірусу з рецепторами на поверхні чутливих клітин, внаслідок чого він проникає у клітину.
3-хімотрипсин-подібна протеаза (англ. coronavirus 3CL hydrolase enzyme) являє собою кристалічну структуру з високою роздільною здатністю. Вона необхідна вірусу для дозрівання. Вважається, що це багатообіцяюча мета для виявлення низькомолекулярних препаратів, які б гальмували розщеплення вірусного поліпротеїну та запобігали поширенню хвороби. Виявлено дуже високу ідентичність послідовності амінокислот (96 %) між основною протеазою SARS-CoV-2 і такою в SARS-CoV.
SARS-CoV-2 виробляє щонайменше три фактори вірулентності, які сприяють вивільненню нових віріонів із клітин-хазяїв та інгібують імунну відповідь[81].
Морфологічні особливості[ред. | ред. код]
SARS-CoV-2 має певну мінливість форми — від круглої до овальної. Кожен віріон SARS-CoV-2 має діаметр 50–200 нанометрів.
Детальніші відомості з цієї теми ви можете знайти в статті SARS-CoV-2.
Епідеміологічні особливості[ред. | ред. код]
Джерело та резервуар[ред. | ред. код]
Після роботи в лютому 2021 року місії ВООЗ до Китаю по вивченню можливого джерела появи SARS-CoV-2 у людській популяції, до якої входило 14 експертів із 10 країн, заявлено, що вислизання вірусу з біологічної лабораторії в Ухані є «надзвичайно малоймовірним», і найімовірніше, він скочив до людини від тваринного джерела, тому розглядається кілька теорій того, як хвороба вперше потрапила до людей. Повідомлено, що віруси, які зберігаються в уханській лабораторії та інших подібних лабораторіях в інших місцях, генетично занадто відрізняються від вірусу SARS-CoV-2, щоб бути його ймовірними родоначальниками. Експерти вважають, що інтродукція через посередника-хазяїна є найімовірнішим шляхом, який потребуватиме додаткових досліджень. Вважається, що цей коронавірус виник у кажанів, перш ніж передаватися людям через інші види диких тварин, таких, як панголіни чи бамбукові щури, що вважаються екзотичними делікатесами у Китаї. Команда ВООЗ не підтримала тверджень уряду Китаю, що вірус вперше з'явився в зовсім іншій країні, позиціонуючи Італію, Індію та США як можливих кандидатів, але не виключила того, що заморожені продукти могли допомогти поширенню цього коронавірусу в усьому світі, що потребує подальшого ґрунтовного вивчення. Американський уряд заявив, що не прийме висновки ВООЗ, не перевіривши їх самостійно[82]. Також існує думка, що цей коронавірус було створено штучно, а згодом спеціально піддано молекулярній обробці аби він виглядав так, ніби еволюціонував природно від кажанів[83]
Первинним джерелом і резервуаром інфекції підозрюються кажани, змії та ще невідомі тварини, від яких збудник потрапив поки що нез'ясованим шляхом до людей. Так є інформація про панголінів як можливе джерело. Вони вживаються в їжу в Китаї. Однак це припущення піддано дискусії[84][85][86]. За аналогією з іншими зоонозними коронавірусними хворобами, як то тяжкий гострий респіраторний синдром (SARS / ТГРС) чи близькосхідний коронавірусний респіраторний синдром (БКРС) припускається, що передача можлива від тварин до людини через безпосередній близький контакт із живою твариною або через певні продукти, зокрема верблюже молоко, як це дискутується при БКРС. Це відбулося ймовірно на ринку тварин і морепродуктів в Ухані, хоча деякі китайські науковці це спростовують. Дані свідчать про те, що людина, заражена SARS-CoV-2, може заразити інших ссавців, включаючи собак, котів і норок. Однак залишається невиясненим, чи будуть ці заражені ссавці джерелом для стійкої передачі людям[87]. Подальші дослідження показали, що норки часто інфікуються в результаті контакту з інфікованими людьми і можуть бути резервуаром SARS-CoV-2, передаючи вірус один одному і людині. Інфікована людина далі може передавати цей вірус у популяції. Данія, Нідерланди, Швеція, Іспанія, Італія та Сполучені Штати Америки повідомили ВООЗ про виявлення SARS-CoV-2 у вирощуваних норок[58]. Люди у перебігу пандемії є повноцінним джерелом і резервуаром коронавірусної хвороби 2019. У листопаді 2020 року було зареєстровано 349 випадків серед людей, пов'язаних із вирощуванням норок, що було більше порівняно з 200 випадками у жовтні 2020 року. З червня 2020 року загалом 644 людини, пов'язані з вирощуванням норок, дали позитивні результати в ПЛР. Крім того, зафіксовано щонайменше 338 випадків серед людей, які працювали із шкурками норок, на шести заводах і двох невеликих підприємствах, що свідчить про те, що існує підвищений ризик зараження у людей, які займаються землеробством, вибракуванням та обробкою норок. Станом на 1 грудня 2020 року постраждало 289 норкових ферм, що становить приблизно 20 % усіх норкових ферм Данії[88].
Спостереження 8 випадків спільного перебігу коронавірусної хвороби 2019 і близькосхідного коронавірусного респіраторного синдрому свідчить про відсутність конкуренції між збудниками цих хвороб і про спільність шляхів передачі цих захворювань[89].
Механізм і фактори передачі[ред. | ред. код]
Встановлено, що SARS-CoV-2 інтенсивно поширюється в людській популяції без залучення тваринного джерела практично виключно від людини до людини як антропоноз за допомогою повітряно-крапельного механізму передачі вірусу через аерозольні, переважно великодисперсні (› 5 мкм), виділення з дихальних шляхів, які швидко падають на землю через силу тяжіння, як правило, в межах 1-2 метрів від людини-джерела. Також існує думка, що передача можлива через дрібнодисперсні аерозолі (≤ 5 мкм), які швидко випаровуються у повітрі, залишаючи після себе ядра аерозолю, що є досить маленькими та легкими, щоб залишитися суспендованими у повітрі годинами (аналогічно пилу), що дає гіпотетично можливість зараження в приміщенні навіть вже за відсутності джерела інфекції, однак це дискутується. Потрібні подальші дослідження, щоб визначити, чи можна виявити життєздатний SARS-CoV-2 у зразках повітря з помешкань, де не виконуються ніякі медичні процедури, що генерують аерозолі та яку роль дрібнодисперсні аерозолі можуть грати в передачі SARS-CoV-2[87].
Показано, що реплікація SARS-CoV-2 у людини досить тривала, корелює з тяжкістю захворювання і навіть на 20-й день хвороби може бути активною. В аерозолізованій формі виживає понад 3 години в експериментальних умовах, але це механічне утворення аерозолів навряд чи імітує справжній клінічний сценарій[90]. Серії випадків, в яких були оцінені тісні контакти з пацієнтами з підтвердженим COVID-19, повідомляють, що зараження відбулося лише у близько 5 % контактів. Однак навіть ця низька швидкість не розподіляється рівномірно серед близьких контактів, а змінюється залежно від тривалості та інтенсивності контакту. Ризик найвищий серед членів домогосподарств, у яких швидкість передачі становить від 10 % до 40 %. Тісний, але менш стійкий контакт, наприклад, обмін їжею, дає близько 7 %, тоді як передача між людьми під час покупок у магазинах — 0,6 %. Люди, заражені SARS-CoV-2, можуть виробляти як великодисперсні аерозолі (краплі), так і дрібнодисперсні аерозолі, але більшість цих виділень не заражають інших людей. Ця закономірність здається стосується тільки тих респіраторних виділень, які швидше падають на землю у вузькому радіусі від зараженої людини, і не тих дрібнодисперсних аерозолів із вірусами, що залишаються суспендованими годинами у повітрі на рівні обличчя, де їх може вдихнути будь-хто. Винятком може стати тривале потрапляння інфікованої людини в погано провітрюване приміщення, що дозволяє інакше накопичувати незначну кількість аерозолів, що містять віруси. На користь дрібноаерозольної передачі начебто свідчать задокументовані випадки спалахів серед учасників хору, відвідувачів ресторанів та офісних працівників, які перебували в закритих приміщеннях. Однак, виходячи із загальновідомої передачі SARS-CoV-2, ці випадки є швидше винятком, ніж правилом. Крім того, важко визначити заднім числом усі потенційні взаємодії між людьми, які могли статися до, під час та безпосередньо після цих контактів. Не можна недооцінювати потенційну здатність коронавірусів широко та швидко поширюватися серед груп у закритих середовищах за допомогою декількох шляхів: на основі експериментів, що використовували мічені фаги, показано, що віруси можуть поширюватися від однієї забрудненої коронавірусами дверної ручки або від забруднених рук лише однієї зараженої людини до здорових людей і обладнання в усій офісній будівлі впродовж кількох годин.
Кількість людей, яких заражає одна хвора на коронавірусну хворобу 2019 людина, оцінюється від 2 до 3. Так само відбувається при грипі й це зовсім відрізняється від тих хвороб, де йде поширення через дрібнодисперсні аерозолі, зокрема як при кору, де кількість заражених близька до 18. Враховуючи, що більшість хворих із коронавірусною хворобою 2019 заразні близько 1 тижня, кількість заражень від 2 до 3 є досить невеликою, враховуючи велику кількість контактів, які більшість людей мають за звичайних обставин життя впродовж 7 днів. Або кількість SARS-CoV-2, необхідна для спричинення хвороби, значно більша, ніж при кору, або дрібнодисперсні аерозолі не є домінуючим шляхом передачі. Наявні нині[коли?] дані рандомізованих досліджень і мета-аналізів свідчать про те, що передача на основі дрібнодисперсних аерозолів все-таки не є переважним шляхом передачі SARS-CoV-2.[91].
Аерозолі, що утворюються при стисканні грудної клітки та спробах вентиляції у пацієнтів із зупинкою серця, можуть призвести до зараження збудниками повітряно-крапельних інфекцій, в тому числі й SARS-CoV-2. Відповідно, тимчасові міжнародні вказівки з реанімації обмежили базове забезпечення життєдіяльності рятувальниками непрофесіоналами лише стисненням грудної клітки та використанням автоматизованого зовнішнього дефібрилятора під час пандемії коронавірусної хвороби 2019[92]
Ступінь активності цього механізму визначається як в'ялий, не такий активний як під час грипу. Потужним джерелом інфекції стали діти, у яких переважає безсимптомна форма. Індекс контагіозності доходить до 50 %, тоді як при кору досягає 95 %. Для оцінки контагіозності епідеміологи використовують математичні формули з чіткими та прийнятними припущеннями для обчислення показника заразливості. З цією метою обчислюється «базовий показник відтворення» (R0), і він вказує на очікувану кількість випадків, які безпосередньо заражаються від одного джерела інфекції в популяції (при тому, що до цієї хвороби, як вважається, мають бути чутливі всі). При SARS / ТГРС та БКРС цей показник приблизно дорівнює 2, що вказує на те, що кожна заражена людина може ефективно заразити в середньому двох людей при близькому контакті. Різні дослідження показують коливання цього показника в широких межах — 1,95[93], 2,2[94], 3,28[95] аж до 6,47[96]. Така різниця обчисленого базового показника відтворювання пояснюється тим, що використовувалися різні методи обчислення та проводилися розрахунки в різний час пандемії[47]. Проведені дослідження показують, що активна передача коронавірусу майже в половині випадків обумовлена безсимптомними поширювачами[97]. З появою варіанту «Омікрон» індекс контагіозності збільшився, проте не досягає такого рівня як при кору[98]
Виявлені показники летальності — 1,0 % серед дорослих у віці 50–59 років, 3,5 % серед 60–69 років, 12,8 % серед 70–79 років і 20,2 % серед 80 років і старше. Серед тяжкохворих, як повідомляється, летальність досягає 50 % серед дорослих у віці 40–49 років і 87,5–100 % серед тих, хто старше 70 років. Точний рівень загальної летальності в світі невідомий — хоча деякі моделі, що містять легкі та безсимптомні випадки, оцінюють його у 0,5-1 %[90].
Не виключається можливість зараження через потрапляння аерозолів на кон'юнктиви[99], хоча ймовірним отут є зараження внаслідок торкання пальцями до повік, які забруднили виділення від хворого, або потирання їх, а потім несвідоме перенесення вірусу забрудненими пальцями до губ і надалі вдихання у дихальні шляхи.
Виявлено, що більші концентрації вірусу у підтверджених випадках виділяються з дихальних шляхів на ранніх стадіях захворювання, а з перебігом хвороби концентрація вірусу різко знижується. Передачі сприяє тривалий тісний контакт із хворим в одному приміщенні, відстань до 1-2 м. Факторами передачі можуть бути харчові продукти та предмети побуту, що контаміновані (забруднені) SARS-CoV-2. Наразі не виявлено доказів того, що SARS-CoV-2 може передаватися іншими механізмами передачі інфекції через сечу, кал, кров, грудне молоко[87]. Проте не виключається трансплацентарна передача вірусу від матері до плода через білок NRP1[100].
Сприйнятливість, фактори ризику[ред. | ред. код]
Поки що достеменно не визначено ступінь сприйнятливості. Досліджується питання того, чи захищають від коронавірусної хвороби 2019 антитіла до людських коронавірусів, які є у 80 % людей у світі. Виявлено, що Т-клітини перехресно-реактивної пам'яті, які з'являються у людей через захворювання протягом життя незоонозними коронавірусними інфекціями, здатні певною мірою захистити тих осіб, що контактували з хворими на підтверджену коронавірусну хворобу 2019[101]. Найуразливішим контингентом наразі вважаються курці[102], у них за результатами численних проведених метааналізів передбачається частий тяжкий перебіг[103]; особи чоловічої статі, люди азійської етногрупи, похилого віку[104] й особи з тяжкими фоновими хворобами (цукровий діабет, есенціальна артеріальна гіпертензія тощо) і значними зрушеннями в імунній системі, люди старші 60-65 років. Завданням профілактики є захист людей з цих категорії ризику, адже їх кількість досягає багатьох сотень мільйонів осіб на Землі[105]. Великий ризик мають медичні працівники, особливо лікарі, що безпосередньо і тривалий час контактують із хворими, в них він увосьмеро більший, ніж у звичайного населення. Виявлено часте внутрішньолікарняне інфікування як медичних працівників, так і пацієнтів, які перебували з іншими респіраторними захворюваннями в лікарні. Тривалість імунітету після перенесеної хвороби невідома. ВООЗ виступила із заявою, що хоча уряди деяких країн припускають, що виявлення антитіл до SARS-CoV-2 може послужити основою для «імунного паспорта» або «сертифіката відсутності ризику», наразі немає доказів того, що люди, які одужали від коронавірусної хвороби 2019 і мають антитіла до коронавірусу, захищені від повторної інфекції[106].
Розглядаються фактори, що можуть сприяти зараженню і тяжкості клінічного перебігу коронавірусної хвороби 2019. Зокрема досліджується вплив у різних країнах вакцинації людей БЦЖ на зменшення рівня захворюваності та летальності[107][108], різних факторів довкілля на летальність[109][110][111][112][113][114]. Зокрема проведене дослідження порівняння між картографічним рівнем забруднення повітря оксидом азоту (NO2) в тропосфері регіонів і рівнем летальності від коронавірусної хвороби 2019 там. Результати застосування просторового аналізу показали, що із 4443 випадків смертей 3487 (78 %) були у п'яти регіонах, розташованих на півночі Італії та центральній Іспанії. Крім того, в тих самих п'яти регіонах спостерігаються найвищі концентрації NO2 у поєднанні із сталими низхідними потоками повітря, що запобігає ефективному розпорошенню забруднення повітря. Отримані результати на думку автора свідчать про те, що тривалий вплив NO2 може бути одним із найважливіших факторів високого рівня смертей від COVID-19 у цих регіонах та, можливо, у всьому світі[115]. Дослідження, проведені в Китаї, не показали зв'язку температури довкілля з кількістю захворілих, робиться висновок, що немає жодних доказів того, що кількість випадків COVID-19 може знизитися, коли погода стане теплішою[109]. Дослідження іранських науковців виявило, що наростання випадків захворювання відбувається швидко в густонаселених районах при слабкому вітрі, високій вологості та низькому рівні сонячного опромінення[110]. Дослідження турецьких науковців також свідчать про роль вітру та температурних показників у збільшенні захворюваності в 9-ти містах Туреччини[111]. Підозрюється, що повсюдно поширений забруднювач повітря твердими частками, який називається PM2.5, може бути учасником природного відбору вірусу SARS-CoV-2 з подальшою появою його варіантів[116].
Метааналіз даних серед жінок репродуктивного віку виявив, що відносно грипу порівняно з коронавірусною хворобою 2019 вагітність пов'язана із семикратно більшим ризиком госпіталізації, проте меншим ризиком потрапляння до відділення інтенсивної терапії та меншим ризиком смерті[117]. Загальна кількість померлих вагітних від коронавірусної хвороби 2019 є малою[118]. Клінічні особливості перебігу коронавірусної хвороби у вагітних включають гарячку та кашель, проте значно рідше, ніж у хворих невагітних жінок. Ятрогенні передчасні пологи є основним несприятливим акушерським результатом. Поточні дані не свідчать про можливість вертикальної передачі коронавірусу в третьому триместрі вагітності[119].
Генетичне дослідження визначило кластер генів у хромосомі 3 людини як предиктор ризику дихальної недостатності при коронавірусній хворобі 2019. На основі проведеного нового дослідження, яке включало 3199 госпіталізованих пацієнтів виявило, що це основний генетичний фактор ризику тяжкої форми та госпіталізації. Було показано, що ризик несе геномний сегмент ~ 50 кб, який успадковано від неандертальців, і який мають у XXI столітті близько 50 % людей у Південній Азії та 16 % людей у Європі, тоді як серед жителів Центральної Африки і Східної Азії такого геномного сегмента майже немає[120][121].
Науковці британського Центру вірусних досліджень Університету Глазго провели дослідження і пояснили, чому частина населення планети може виявитися несприйнятливою до коронавірусної хвороби 2019. На їхню думку, за це відповідає мутація в гені OAS1. Внутрішньоклітинний противірусний захист може не тільки створювати природний імунітет до SARS-CoV-2, але і пригнічувати реплікацію вірусів, тобто знижувати тяжкість захворювання. На основі скринінгу експресії генів, стимульованих інтерфероном, виявлено, що OAS1 через РНКазу L сильно інгібує SARS-CoV-2. Йдеться про пренілірований ген, до білку якого приєднана одна молекула жиру. У госпіталізованих пацієнтів експресія пренілірованого OAS1 асоціювалася із захистом від тяжкого перебігу хвороби, що свідчить про те, що цей противірусний захист є основним компонентом захисної противірусної відповіді. Якщо ж OAS1 не є пренілірованим, то він фактично не реагує на SARS-CoV-2 і не може надіслати сигнали імунній системі[122].
Дослідження Техаської медичної асоціації США показали, що:
- найбільший ризик зараження звичайних людей (9 балів) виникає:
- під час відвідування бару;
- релігійної служби, в якій бере участь більше 500 людей;
- похід на спортивне змагання на стадіоні.
- Трохи менше вони оцінили ризик зараження (8 балів за їхньою градацією) для:
- відвідування велелюдного музикального концерту;
- парку розваг;
- обіду в їдальні чи ресторані всередині;
- тренування у спортзалі.
- У 7 балів оцінено ризик зараження під час:
- обіймів чи рукостискання;
- гри у футбол;
- гри у баскетбол;
- польоті в літаку;
- участі у поховальній церемонії;
- харчування в ресторані на зовнішньому майданчику,
- перебуванні у перукарні.
- У 6 балів ризику оцінено:
- відвідування родичів похилого віку в їхніх помешканнях;
- плавання у громадському басейні;
- тижнева праця в офісному приміщенні;
- контакт з дітьми в школі, дитячому таборі або щоденний догляд за ними.
- У 5 балів ризику оцінено:
- покупки на пошті;
- похід на пляж;
- відвідування місця, де готують барбекю;
- їда в чужому будинку.
- У 4 бали оцінено:
- перебування впродовж однієї години на дитячому майданчику;
- похід до ділового центру міста;
- відвідування бібліотек чи музеїв;
- очікування прийому у лікаря;
- перебування в готелі більше двох ночей.
- У 3 бали дослідники оцінили:
- гру в гольф;
- прогулянку, заняття бігом чи їзду на велосипеді;
- похід до продуктових магазинів і ринків.
- У 2 бали оцінено ризик:
- проживання в кемпінгу;
- гри в теніс;
- перекачування бензину;
- отримання їжі з ресторану на винос.
Найнижчий ризик при відкриванні поштового листа — 1 бал.[123][124]
Патогенез[ред. | ред. код]
Дослідження патогенезу коронавірусної хвороби 2019 широко проводяться у світі, але отримані результати часто суперечливі, мають попередній характер. Поки що не є зрозумілим, чому деякі пацієнти реагують на Sars-Cov-2 занадто слабо, а інші навпаки занадто сильно. Чи Т- і В-клітинна відповідь у периферичній крові показує міру імунних процесів у дихальній системі, куди потрапляє Sars-Cov-2. Не прояснено, чи є корисними або шкідливими імунні реакції при цій хворобі[125].
Патофізіологія індукованого гострого респіраторного дистрес-синдрому при цій хворобі: у пацієнтів спостерігається інтенсивна дисфункція ендотелію з тромбозапальним станом. Виявлено багато механізмів порушення регуляції легеневої перфузії: скасування гіпоксичної легеневої вазоконстрикції, надмірної легеневої вазоконстрикції; і мікротромбоз або макротромбоз, що призводить до збільшення мертвого (не дихаючого) простору легень. Легеневий мікротромбоз і пошкодження ендотелію, що призводить до невідповідності вентиляції перфузії, гіпоксемії та розширенню судин[126].
Взаємодія з рецепторами ангіотензин-перетворюючого ферменту II і ураження легень[ред. | ред. код]
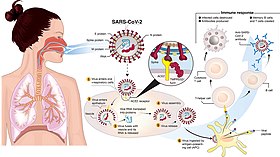
Дослідження показали, що SARS-CoV-2 використовує для потрапляння в клітини-мішені ті самі рецептори ангіотензин-перетворюючого ферменту II (АПФ) ACE2, що і збудник тяжкого гострого респіраторного синдрому SARS-Cov[127]. Ґрунтуючись на загальнодоступній базі даних, найсучаснішій одноклітинній RNA-секвенуючій техніці, проаналізовано профіль експресії РНК ACE2 у здорових легенях людини. Результат вказує на те, що рецептори вірусу сконцентровані в невеликій частці альвеолярних клітин типу II (АТ2), основна функція яких — синтез у пластинчатих тілах сурфактанта. Виявлено, що ця популяція АТ2 також сильно експресувала багато інших генів, які регулювали розмноження та передачу вірусів.
Існуюча артеріальна гіпертензія є відомим фактором ризику розвитку тяжкого перебігу коронавірусної хвороби 2019. Аномальна активація ангіотензинових рецепторів підвищує рівень ангіотензину II і сприяє тяжким проявам. Інгібітори рецепторів ангіотензину-ІІ є основою антигіпертензивної терапії, сучасна медична практика у 2021 році не рекомендує зменшувати їх прийом для захисту хворих на гіпертонічну хворобу. Навпаки, існують клінічні дані, що підтверджують сприятливий ефект їх у пацієнтів з артеріальною гіпертензією в розпал пандемії, хоча точний механізм цього неясний. Є припущення, що вони зменшують ступінь тяжкості коронавірусної хвороби 2019, сприяючи формуванню комплексу ACE2-AT1R на поверхні клітини, де AT1R опосередковує основні вазопресорні ефекти ангіотензину II. Припускається, що взаємодія між ACE2 та AT1R перешкоджає зв'язуванню SARS-CoV-2 з ACE2, тим самим дозволяючи ACE2 перетворювати ангіотензин II на корисніший ангіотензин I, який має судинорозширювальну та протизапальну активність[128].
Вагітність є фактором ризику сприйнятливості та несприятливих наслідків при грипі та тяжких формах ГРВІ, при цьому поточні дані суперечать тому, що інфекція SARS-CoV-2 під час вагітності є тяжчою, ніж у загальній популяції, з відносно низьким рівнем смертності матерів і плодів чи новонароджених. Вірусне навантаження може призвести до зменшення доступних рецепторів АПФ-2, посилюючи таким чином патологічне звуження судин (вазоконстрікцію), фіброз, запалення та тромботичні процеси. Припускається, що нормальний стан вагітності із сильно експресованими рецепторами АПФ-2 призводить до значного розширення судин (вазодилатації) та протизапальної реакції на інфекцію SARS-COV-2. Таким чином, така регуляція рецепторів АСЕ-2 під час вагітності насправді може бути захисною[129].
Сидячий спосіб життя збільшує ризик госпіталізації із приводу коронавірусної хвороби 2019 незалежно від інших чинників. Існує достатня кількість статистичних даних, які показують, що фізичні вправи запобігають тяжкому перебігу цієї хвороби. Стверджується, що інтенсивні фізичні навантаження через гіпоксію крові збільшують експресію трансмембранного ангіотензинперетворюючого ферменту 2 (tACE2) в ендотелії судин, збільшуючи ризик розвитку тяжкого перебігу, особливо у нетренованих осіб. З іншого боку, вправи помірної інтенсивності збільшують у крові концентрацію розчинного ангіотензинперетворюючого ферменту 2 (АПФ2), який чинить захист при зараженні SARS-CoV-2 і може запобігти ускладненням[130].
Цитокіни та інші фактори запалення[ред. | ред. код]
Певну роль у виникненні тяжких уражень у деяких хворих ймовірно відіграє збільшення рівня цитокінів. Вторинний гемофагоцитарний лімфогістіоцитоз (sHLH) є недостатньо розпізнаваним патофізіологічним синдромом надмірного запалення, що характеризується фульмінантною та фатальною гіперцитокінемією. Виникає поліорганний збій. У дорослих найчастіше це відбувається при вірусних інфекціях і у понад 40 % випадків сепсису. Профіль цитокінів, що корелює з тяжкістю захворювання на коронавірусну хворобу 2019, характеризується у 50 % випадків вкрай тяжкого клінічного перебігу цієї хвороби підвищенням рівнем інтерлейкінів IL-2, IL-7, гранулоцит-колоніального стимулюючого фактору, гамма-інтерферон індуцибельного протеїну 10, моноцитарного гемоатрактанту протеїну 1, макрофагального запального протеїну 1-α і фактору некрозу пухлини-α. Разом із тим виникає значна лейкопенія[131]. Постійно високий рівень трьох цитокінів (CXCL10, CCL7 та антагоніст рецепторів IL-1) був пов'язаний із збільшенням вірусного навантаження, порушенням функції легень, пошкодженням їх та смертю[132][133]. Виявлено кілька ознак, притаманних хворим із тяжким клінічним перебігом: високий рівень системних цитокінів чи хемокінів, як то IL-6, CXCL8, CXCL9 і CXCL10, зрушення індукції та синтезу інтерферону I-го типу. Все це здатне впливати на Т-клітинну відповідь[125].
Хоча основна маса цитокінів, вироблення яких стимулює SARS-CoV-2, є значущими у процесі посилення запалення, але, ймовірно, вони не мають важливого значення для виведення (кліренсу) вірусу. Ймовірно, вірусний кліренс переважно залежить від таких цитокінів, як IL-15, інтерферони типу I та гамма-інтерферону[134]. Виявлене значне підвищення рівня білка галектіна-9 у плазмі крові, кореляцію його концентрації та рівня прозапальних цитокінів[135].
Однак наразі є думки, що сучасних даних недостатньо для встановлення точної ролі та обсягу нерегульованих цитокінових відповідей у хворих на коронавірусну хворобу 2019. Видається, що порівняно з іншими причинами ГРДС, при коронавірусній хворобі 2019 клінічний перебіг характеризується нижчими рівнями цитокінових реакцій. Слабко визначений патофізіологічний суб'єкт як «цитокіновий шторм», який виникає через неадекватну реакцію макрофагів. Йому бракує чіткого біологічного підґрунтя, що може лише ще більше збільшити невизначеність щодо того, як найкраще сприйняти патогенез цієї хвороби і ускладнення ГРДС. Показово, що піковий рівень IL-6 у плазмі крові у пацієнтів, у яких розвинувся ГРДС після лікування Т-клітинами химерних антигенних рецепторів, становив приблизно 10000 пг / мл, що майже в 1000 разів вище, ніж при тяжкому клінічному перебігу коронавірусної хвороби 2019. Проявами підвищеного рівня медіаторів у передбачуваній бурі цитокінів, найімовірніше, є дисфункція ендотелію та системне запалення, що призводить до гарячки, тахікардії, тахіпное та артеріальної гіпотензії. Це сполучення симптомів вже давно входить до поняття «синдром системної запальної відповіді». Хоча термін «цитокінова буря» викликає драматичні образи і привертає увагу загальних і наукових засобів масової інформації, сучасні дані не дають змоги повноцінно його використовувати. Поки нові дані не встановлять інше, зв'язок цитокінової бурі з коронавірусною хворобою 2019 може бути не що інше, як «буря в стакані»[136].
За думкою Інституту здоров'я США у пацієнтів із коронавірусною хворобою 2019 може бути підвищений рівень прозапальних і протизапальних цитокінів, що раніше називалося «синдромом вивільнення цитокінів» або «цитокіновим штормом», хоча це неточні терміни. Зрештою вживання цих термінів при коронавірусній хворобі 2019 є помилковим, оскільки величина збільшення цитокінів у пацієнтів із цією хворобою є меншою порівняно з такою у хворих на багато інших тяжких захворювань, як от при сепсисі[137].
Пролактин[ред. | ред. код]
Зниження рівня пролактину в крові у пацієнтів з ожирінням та у дорослих чоловіків підвищує сприйнятливість і тяжкість коронавірусної хвороби 2019. Є думки, що курці сигарет, діти та вагітні через підвищення рівня пролактину мають низький ризик зараження SARS-CoV-2[138]. Проте різні дослідження показали, що секреція пролактину пригнічена у хронічних курців сигарет[139]. Хронічний вплив нікотину пригнічує секрецію пролактину шляхом активації нікотинових рецепторів нейронів дофаміну, вивільняючи його як фактор інгібітору пролактину. Виявлено, що нікотин може зменшити експресію гена пролактину в клітинних лініях гіпофіза пацюків[140]. Рівень пролактину нижчий у курців порівняно з некурцями. Крім того, виявлено значне зниження концентрації пролактину у жінок, які палять під час вагітності та годують груддю[141].
Однак деякі інші дослідження показали, що секреція пролактину збільшується після паління. Незважаючи на захисний ефект паління від SARS-CoV-2, він є значним фактором ризику бактеріальних і вірусних інфекцій. Повідомлялося, що курці удвічі більш схильні до розвитку пневмонії та 5 разів — до грипу. Показане, що куріння пов'язане з тяжчим перебігом коронавірусної хвороби 2019, більшим ризиком потрапляння в реанімацію та більшою летальністю. Курці частіше потребують госпіталізації порівняно з некурцями[142]. Деякі дослідження показали, що базальні концентрації пролактину подібні у людей з ожирінням і нормальною вагою, тоді як інші показали наявність високих рівнів або ж низьких у людей з ожирінням. Однак хронічне запалення, порушення імунної відповіді, зміна мікрофлори кишківника, висока експресія ACE2, резистентність до інсуліну, гіперглікемія, надлишок жиру, стійкість до лептину та зниження адипонектину роблять пацієнтів з ожирінням сприйнятливими до коронавірусної хвороби 2019[143]. Хоча вагітні мають високий рівень пролактину, вони сприйнятливіші до SARS-CoV-2 порівняно із загальною популяцією. Повідомлено, що вагітні та невагітні мають практично однакову сприйнятливість[144].
Запалення судин і коагулопатичні зрушення[ред. | ред. код]
Значну роль у патогенезі хвороби відіграють зміни коагулопатійного характеру, запалення ендотелію судин, що призводить часто до тромбоемболічних ускладнень. Наразі відомо, що SARS-CoV-2 використовує для проникнення в клітину рецептор ангіотензинперетворювального ферменту-2, що є на клітинах легеневих альвеол, обумовлюючи пошкодження легень. Цей рецептор є також на ендотеліоцитах, які вистилають кровоносні судини багатьох органів. Доведено, що SARS-CoV‑2 може безпосередньо інфікувати епітеліоцити кровоносних судин людини in vitro. Пряме ураження ендотеліоцитів SARS-CoV-2 чи їхнє опосередковане ушкодження імунними клітинами, цитокінами і вільними радикалами може призвести до вираженого порушення функції ендотелію. Ендотелій судин вважається активним паракринним, ендокринним та автокринним органом, що бере активну участь у регуляції тонусу кровоносних судин і підтримці їхнього гомеостазу. Ендотеліальна дисфункція, що розвивається при цій хворобі, спричинює порушення мікроциркуляції, вазоконстрикцію з подальшою ішемією органів, запаленням і набряком тканин, прокоагуляцію. Ендотеліїт може зумовити системні порушення мікроциркуляції в різних судинних руслах, їхні клінічні наслідки у хворих із коронавірусною хворобою 2019. Дисфункція ендотелію диктує необхідність використання відповідного лікування для нормалізації можливостей ендотелію під час боротьби з реплікацією збудника, особливо терапії протицитокіновими препаратами, інгібіторами АПФ і статинами. Таке стратегічне направлення особливо актуальне для захворілих, які мають вагомі фактори ризику дисфункції ендотелію (артеріальна гіпертензія, цукровий діабет, ожиріння та серцево-судинні захворювання, паління). Дисфункція ендотелію і хронічне запалення йдуть з гіперкоагуляцією, супроводжуються підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції, що й зумовлює зрештою утворення тромбів[145].
Не виключається, що частково в цій ситуації діє механізм системного розладу через відкладання в дрібних кровоносних судинах IgA і компонента системи комплементу, як це відбувається при геморагічному васкуліті[146]. Розтини померлих показали, що у легенях відбуваються тяжке ураження ендотелію, пов'язане з вірусом SARS-CoV-2 та порушенням мембран ендотеліальних клітин; поширений судинний тромбоз із мікроангіопатією та оклюзією альвеолярних капілярів; значне утворення нових судин через механізм, який називається інтуссептичним ангіогенезом, що в цілому робить хворобу тяжчою ніж грип. Розвивається часто атипова пневмонія[147][148], яка маніфестується при тяжкому перебігу наприкінці 1-го тижня хвороби, на 2-му тижні, але з переважанням циркуляції світі дельта варіанту SARS-CoV-2, іноді вже на 3-й добі хвороби.
Брадикінін[ред. | ред. код]
Висунута гіпотеза про можливу дію при коронавірусній хворобі 2019 на кровоносні судини великої кількості брадикініну, який активно виробляється під впливом SARS-CoV-2. Дослідники на основі розрахунків суперкомп'ютера в Oak Ridge National Lab у Тенессі зробили висновок, що SARS-CoV-2 запускає механізм активізації клітин, що експресують АСЕ2 навіть у тих структурах, де в нормі таких клітин мало і їхня активність мінімальна. Це призводить до викиду великої кількості брадикініну, що спричинює універсальне ураження кровоносних судин багатьох органів (легені, кишківник, серце тощо) з виходом у простір навколо судин рідини, що створює набряк. Брадикінін збільшує проникність гематоенцефалічного бар'єра, що на думку дослідників саме призводить до частих при цій хворобі порушень роботи головного мозку, психотичних розладів. Дослідники вважають, що зміни цитокінів не є головними при коронавірусній хворобі 2019, а в кращому випадку, вони є додатковим фактором до дії брадикінину.[149][150].
Триптофан і серотонін[ред. | ред. код]
Дефіцит серотоніну погіршує гіпоксемію та пригнічує гіпоксичне звуження судин легень, що призводить до посилення тяжкості захворювання. У хворих на коронавірусну хворобу 2019 виявлено дефіцит триптофану, через те, що АПФ2, який є ключовим фактором всмоктування триптофану з їжі, значно зменшується у пацієнтів, тому що SarS-CoV-2 використовує АСЕ2 як рецептор для входу в клітини-мішені. Дефіцит триптофану призводить до дефіциту серотоніну у таких пацієнтів, оскільки триптофан є попередником його синтезу. Крім того, у пацієнтів може знизитися рівень протизапального мелатоніну (синтезованого з серотоніну) та нікотинаміду аденіндінуклеотиду, що виробляється з ніацину, попередником якого є триптофан. Селективні інгібітори зворотного захоплення серотоніну можуть не дуже допомогти у виправленні дефіциту його під час хвороби, адже їхня ефективність значно знижується, коли в організмі недостатньо триптофану. Тому тільки збільшення його концентрації під час хвороби здатне покращити її перебіг[151].
Ураження органів та інших систем організму[ред. | ред. код]
Легені[ред. | ред. код]
Оксидативний стрес грає важливу роль у патогенезі коронавірусної хвороби 2019, збільшуючи наслідки цитокінових зрушень, посилюючи згортання крові та гіпоксію, що спричинює пошкодження тканин і органну недостатність. SARS-CoV‑2 здатний порушити рівновагу між ядерним фактором транскрипції NF‑κB, що задіяний в експресії цитокінів, і активацією Nrf2, що експресує антиоксидантні ферменти. Виникає перехресний зв'язок між цитокіновими зрушеннями і оксидативним стресом. Ці зміни здатні грати важливу роль у виразності симптомів у хворих. Таким чином модель патогенезу коронавірусної хвороби 2019 йде з первинним ураженням легень і пізньою гематологічною, тканинною гіпоксемією та мітохондріальною дисфункцією внаслідок оксидативного стресу.
Основними ланками патоморфології і патогенезу інтерстиціальної пневмонії при коронавірусній хворобі 2019 є дизрегуляторна активація системи моноцитарних фагоцитів, поява генералізованого тромбозу на рівні мікроциркуляторного русла, прогресуючий внутрішньоальвеолярний та інтерстиціальний легеневий фіброз.
У відповідь на проникнення SARS-CoV‑2 під час ексудації та проліферації превалює Т‑клітинний імунітет. При зміни їх на фіброз загальна кількість Т‑лімфоцитів різко знижується, тоді як клітини гуморального імунітету ще не з'являються. Переважання CD8+ Т‑лімфоцитів-супресорів над CD4+ Т‑лімфоцитами-хелперами, ймовірно, пов'язане з механізмами автоімунного пошкодження[145]. Лімфопенія у хворих може свідчити як про гіперактивацію і міграцію лімфоцитів до легень, так й про апоптоз і супресію Т-лімфоцитів. Аналіз РНК-послідовностей верхніх дихальних шляхів у них виявив, що в разі тяжкого клінічного перебігу хвороби рівень цитотоксичних Т-лімфоцитів значно знижується порівняно з таким у хворих із середньотяжким перебігом[125].
Пошкодження легень через безпосереднє ураження SARS-CoV‑2 і цитокінами ендотелію судин та клітин альвеол і міжальвеолярних перегородок призводить до появи рентгенологічного симптому «матового скла» формування інтерстиціальної пневмонії, активації фіброзоутворення, а також зниження функції легень[145].
Особливостями дифузного альвеолярного ураження є 3 фази патоморфогенезу інтерстиціальної пневмонії при коронавірусній хворобі 2019:
- фульмінантна (блискавична) — до 10 діб; відповідає ексудативній і проліферативній стадіям гострого респіраторного дистрес-синдрому, хоча є заперечення, що при цій хворобі формується цей синдром (принаймні спочатку), а йде особлива пневмонія[152][153][154][155];
- персистувальна — 11-20-та доба; відповідає проліферативній стадії гострого респіраторного дистрес-синдрому;
- фібротична — знайдена у хворих, які померли на 21-45-ту добу; відповідає стадії організації гострого респіраторного дистрес-синдрому[145].
Звичайними проявами в госпіталізованих хворих є дихальна недостатність, сухий кашель, задишка й зміни легень при комп'ютерній томографії у вигляді помутніння та / або ущільнення у вигляді «матового скла». Під час гострої фази переносимість фізичного навантаження не можна оцінювати за допомогою стандартних тестів, як тест із 6-хвилинною ходьбою[145].
Під час поширення дельта-варіанту Sars-Cov-2 пневмонія виникає й розвивається досить швидко на 3-4-й день у окремих хворих, які ймовірно отримали велику дозу збудника. У таких випадках пневмонія перебігає іноді без підвищення прозапальних маркерів, зокрема, СРБ. Зазвичай при такому клінічному перебігу характерна відразу висока температура тіла, виражений інтоксікаційний синдром. Це може призводити до падіння сатурації вже на 4-5-й день від початку хвороби[156].
Є спостереження, що поширеність хронічного обструктивного захворювання легень (ХОЗЛ) значно нижча, ніж інших супутніх хвороб серед пацієнтів із коронавірусною хворобою 2019. Таке ж спостерігалося і спостерігається з іншими коронавірусними хворобами, як то тяжкий гострий респіраторний синдром і близькосхідний коронавірусний респіраторний синдром, але не є при інших ГРВІ, як то грип та респіраторно-синцитіальна інфекція. Обговорюється, що однією із загальноприйнятих причин низького рівня ХОЗЛ серед пацієнтів із коронавірусною хворобою 2019 є використання інгаляційних кортикостероїдів або бронходилататорів, які можуть захистити від коронавірусу. Інша можлива причина — це те, що легені у такого хворого можуть не сприяти тяжкому перебігу коронавірусної хвороби 2019. ХОЗЛ спричинює закупорки слизом великих і дрібних дихальних шляхів, що може перешкоджати проникненню SARS-CoV-2 у глибші відділи легень — альвеоли. Таким чином, SARS-CoV-2 може локалізуватися лише у верхніх дихальних шляхах людей із ХОЗЛ, спричинюючи легкі або безсимптомні форми, що не потребують медичної допомоги. Навіть якщо SARS-CoV-2 досягне альвеол, клітини в них, ймовірно, піддаються тяжкому стресу ендоплазматичного ретикулуму і сильно пошкоджуються там, що не дає підтримувати ефективну реплікацію вірусу[157].
Серцево-судинна система[ред. | ред. код]
SARS-CoV‑2 здатний вплинути на серцево-судинну систему численними шляхами, він ускладнює вже наявні серцево-судинні хвороби або ж зумовлює розвиток нових. У таких пацієнтів описано багато випадків серцевих хвороб, їхніх ускладнень, включаючи серцеву недостатність, особливо у госпіталізованих хворих, і кардіоміопатію. Припускається, що вона розвивається внаслідок прямої дії вірусу та / чи токсичних ефектів цитокінів, що утворюються під час перебігу хвороби. У численних пацієнтів під час гострої фази захворювання розвивається тромботичний стан, який може призвести до тромбоемболії легеневої артерії, утворення тромбів у коронарних судинах і загострення ішемічної хвороби серця. Найбільшому ризику наражаються пацієнти із серцево-судинними факторами ризику, тобто чоловіки, хворі на цукровий діабет, артеріальну гіпертензію й ожиріння, ті, у яких є фонові серцево-судинні хвороби[145].
Нервова система[ред. | ред. код]
Значне системне запалення, пов'язане із вродженим імунітетом, що провокується зв'язуванням спайкового білка SARS-CoV‑2 S1 з експресувальними АПФ-2-клітинами, нейросудинною дисфункцією ендотелію, пошкодженням гематоенцефалічного бар'єра потенційно спричинює розвиток ускладнень центральної нервової системи[145].
Цитокіни здатні збільшувати проникність гематоенцефалічного бар'єру, забезпечуючи проникнення вірусу в мозок. Потрапляючи до ЦНС вірус може інфікувати астроцити й мікроглію, активуючи каскад нейрозапалення та нейродегенерації через вивільнення фактора некрозу пухлини, цитокінів та інших медіаторів запалення[145].
Є непрямі механізми залучення мозку, які включають:
- порушення регуляції цитокінів — доведено, що прозапальні, як то інтерлейкін-6 і фактор некрозу пухлин, пов'язані з розвитком енцефаліту на тлі цитокінового шторму;
- міграцію імунних клітин із периферії за механізмом «троянського коня», що спричинює запалення у нервових клітинах і вірус-індуковану невропатію;
- автоімунну агресію;
- гіпоксичну травму через безпосередній вплив SARS-CoV‑2 на дихальний і серцево-судинний центри довгастого мозку. Гіпоксія головного мозку спричинює активацію анаеробного метаболізму, через що й виникає набряк мозку, знижується мозковий кровоток, підвищується внутрішньочерепний тиск, розвиваються неврологічні та психіатричні прояви;
- тромботичну мікроангіопатію, що спричинює продукування антитіл проти кардіоліпіну, ушкодження мозку за участю антифосфоліпідних антитіл[145].
Є припущення, що розвиток агевзії пов'язаний з дією SARS-CoV-2 на відповідні центри у головному мозку. Цей коронавірус можливо спричинює ураження ядер деяких черепних нервів, з чим і, зокрема, пов'язують агевзію.
Також SARS-CoV‑2 може спричинити тяжкі ураження мозку (інсульти, енцефаліти тощо) у пацієнтів, які страждають неврологічними розладами, включаючи параною і галюцинації[158]. Спостерігаються й численні поведінкові відхилення, які свідчать про ураження головного мозку[159] За аналогією з іншими коронавірусними хворобами науковці прогнозують довгострокові наслідки запалення головного мозку у окремих хворих[160]. Магнітно-резонансна томографія виявила у низки пацієнтів високий ступінь ураження білої речовини головного мозку, проте питання чи це ураження, яке спричинює власне SARS-CoV-2, чи гіпоксія через пошкодження судин достеменно не вивчене[161]. Отримано підтвердження, що SARS-CoV‑2 може провокувати розвиток ще й енцефалопатії (незапального судинного ураження паренхіми мозку), менінгіту, гострого дисемінованого енцефаломієліту, судомних нападів, нейром'язових розладів як то синдром Гієна — Барре, полінейропатія, парези, атаксія. Частими неврологічними симптомами, які супроводжують коронавірусну хворобу 2019, є запаморочення, головний біль, порушення свідомості[145].
Ураження формених елементів крові[ред. | ред. код]
- «Еритроцитарна ланка»
Ураження SARS-CoV-2 асоціюється зі зниженням рівня кисню в крові навіть у пацієнтів без гіпоксії. Ця розбіжність ілюструє необхідність пояснення того, чи впливає вірус прямо чи опосередковано на еритропоез. Виявлено значно більшу кількість попередників еритроцитів — клітин CD71+ у циркуляції крові пацієнтів із коронавірусною хворобою 2019. Виявлено, що ці клітини мають виразні імунодепресивні властивості. Виявлено сильну негативну кореляцію між кількістю цих клітин зі співвідношеннями Т- і В-клітин у пацієнтів із коронавірусною хворобою 2019. Збільшення клітин CD71+ негативно корелювало з рівнем гемоглобіну. Субпопуляції еритроїдних клітин CD45+, CD71+ — клітин, що експресують ACE2, TMPRSS2, CD147 та CD26 можуть бути інфіковані SARS-CoV-2. У свою чергу, попередня обробка їх дексаметазоном суттєво зменшила експресію ACE2 / TMPRSS2 і згодом знизила їх зараженість SARS-CoV-2[162].
- «Тромбоцитарна ланка»
У пацієнтів із коронавірусною хворобою 2019 спостерігається вторинна імунна тромбоцитопенія, яка також називається імунною тромбоцитопенічною пурпурою або вторинним гемофагоцитарним лімфогістіоцитозом. Патогенез такої тромбоцитопенії при ураженні SARS-CoV-2 достеменно невідомий. Рідкісні випадки протромботичної імунної тромбоцитопенії, індукованої вакцинами на основі аденовірусів проти коронавірусної хвороби 2019 пов'язані з аутоантитілами, які націлені на фактор тромбоцитів 4 (PF4). Для пояснення етіології такої тромбоцитопенії у хворих вивчають потенційну участь гемофагоцитарних гістіоцитів, націлених на тромбоцити, атакованих аутоантитілами, що узгоджується зі спостережуваними аутоантитілами PF4 при вакцинальних реакціях[163].
Печінка[ред. | ред. код]
Виявлене у хворих із тяжким перебігом підвищення активності амінотрансфераз свідчить про розвиток щонайменше реактивного гепатиту. Загалом Sars-Cov-2 безпосередньо не чинить цитолітичної дії на гепатоцити, проте спричинений універсальний ендотеліїт ймовірно й породжує ураження паренхіми печінки. З'явилися припущення, що виявлені у березні -квітні 2022 року декілька 82 випадків у дітей гепатиту невиясненого походження з тяжким перебігом, що спостерігалися в Шотландії, Англії, Ірландії та Іспанії, де були виключені ураження відомими гепатотропними вірусами та печінковими отрутами, можуть бути спричинені спільною дією Sars-Cov-2 і аденовірусами[164].
Нирки[ред. | ред. код]
Ураження нирок наразі пов'язують з тим, що виникає індукований SARS-CoV-2 неадекватний імунний цитоліз через «бунт макрофагів», хоча це активно дискутується.
Обговорюється питання про те, що виникаюча поліорганна недостатність зумовлена не сепсисом, який нечасто приєднується при коронавірусній хворобі 2019, а універсальним ураженням судин в органах, яке спричинює SARS-CoV-2.

Шкіра[ред. | ред. код]
Летальність[ред. | ред. код]
На початку пандемії серед захворілих у Китаї згідно з даними Китайського Центру з контролю та запобігання хворобам (дослідження на більше ніж 70 тисяч уражених) у понад 80 % випадків хвороба перебігала без ускладнень, у 13,8 % випадків спостерігався тяжкий перебіг і лише 4,7 % випадків — критичний, загалом рівень летальності від Covid-19 становив 2,3 %. Найвищий рівень смертей серед пацієнтів із підтвердженим діагнозом — у людей, яким понад 80 років. Серед тих, хто помер, більше було чоловіків (2,8 %), ніж жінок (1,7 %)[166]. Однак подальший перебіг пандемії коронавірусної хвороби 2019 вніс коректив у гіпотезу про переважну ураженість осіб монголоїдної раси. Загалом під час подальшого поширення вірусу середня летальність сягнула 6,3 %[167].
Згідно з висновками ВООЗ, летальність при зараженні SARS CoV становила 10 %, а при MERS CoV досягає 36 %[168][169][170].
Упродовж останніх трьох місяців 2020 року, упродовж 2021 року спостерігається збільшення кількості померлих хворих із тяжким перебігом коронавірусної хвороби 2019 серед осіб молодших 60-ти років внаслідок циркуляції варіанту «Дельта». Нерідко вони не мають обтяжливого анамнезу.
Станом на 21 червня 2021 року летальність серед підтверджених випадків хвороби в світі дорівнює 1,89 %[171]. Згідно з подальшими спостереженнями з початком циркуляції варіанту «Омікрон» летальність не зростає[172]
Можливий зв'язок тяжкості уражень із групами крові[ред. | ред. код]
Не виключається можливість зв'язку тяжкості клінічного перебігу коронавірусної хвороби 2019 із групами крові людини. Ідентифіковано кластер генів 3p21.31 як локус генетичної чутливості у пацієнтів із дихальною недостатністю та підтверджено потенційне залучення до системи груп крові АВО. Генетичні дослідження свідчать, що наявність у людей групи крові O меншою мірою пов'язана з ризиком розвитку Covid-19, порівняно з людьми, у яких група крові A. Біологічні механізми, що лежать в основі цих знахідок, можуть мати відношення до групи АВО як такої, наприклад, через вироблення нейтралізуючих антитіл проти пов'язаних із білками N-гліканів або з іншими біологічними ефектами як то стабілізація фактора Віллебранда[173].
Формування імунітету[ред. | ред. код]
Розвиток імунітету до збудника через природно придбану інфекцію є багатоетапним процесом, який зазвичай відбувається впродовж 1-2 тижнів. Організм реагує на будь-яку вірусну інфекцію негайним неспецифічним процесом, в якому макрофаги, нейтрофіли та дендритні клітини сповільнюють прогресування вірусу і навіть можуть запобігти виникненню маніфестної хвороби. В організмі також утворюються Т-клітини, які розпізнають та усувають ті клітини, що заражені вірусом, створюючи клітинний імунітет. За думками деяких науковців існує ймовірність того, що такий неспецифічний захист від SARS-CoV-2 мають до 30-50 % людей[174]. Як показують лабораторні дослідження, нові мутаційні лінії SARS-CoV-2, ймовірно, не ухиляються від Т-клітин[175]. Ця неспецифічна відповідь супроводжується адаптивним вже специфічним процесом, коли організм виробляє антитіла (імуноглобуліни), які специфічно зв'язуються із SARS-CoV-2, створюється гуморальний імунітет. Ця комбінована адаптивна відповідь може видалити SARS-CoV-2 з організму, і якщо вона досить сильна, може запобігти прогресуванню до тяжкої форми або повторному зараженню тим же вірусом. Реагування Т-клітин пов'язують з адекватною роботою залози тимуса, яка з віком піддається інволюції, через що рівень клітинного імунітету падає. З цим пов'язується нездатність літніх людей адекватно реагувати на інфікування SARS-CoV-2, внаслідок чого він на ранньому етапі не знешкоджується, а далі прогресують запальні зміни з розвитком неадекватних реакцій у першу чергу в легенях. Ключове запитання поки ще не розв'язане і полягає в тому, чи може сформуватись захисна Т-клітинна пам'ять після інфекції SARS-CoV-2 або вакцинації. Специфічну протикоронавірусну імунну пам'ять було виявлено у CD4-T-лімфоцитів у 100 % осіб, що одужали, та CD8-T-лімфоцитів у 70 % таких осіб. Також виявлені реакції Т-клітинної пам'яті на більшість білків SARS-CoV-2, не тільки на білок шипа, а й на нуклеопротеїн і мембранний білок вірусу. Чи цього достатньо для захисного імунітету і скільки він триватиме, поки не вияснено. Розв'язати це питання можна вивчаючи не тільки клітинну, але й гуморальну імунну пам'ять у хворих, які одужали[125].
Вважається, що імунна гуморальна відповідь є вирішальною для елімінації цитопатичних вірусів з організму і є основною складовою імунної пам'яті, що перешкоджає повторному зараженню. Довгостроковий захист досягається за рахунок індукції плазматичних клітин і В-клітин пам'яті. SARS-CoV-2 спричинює стійку B-клітинну відповідь, що показує швидка універсальна поява вірусоспецифічних IgM-, IgG- і IgA-антитіл, нейтралізуючих антитіл класу IgG у перші 7-10 днів після зараження. Як правило виявляються антитіла, що зв'язують внутрішній протеїн N і зовнішній глікопротеїн S SARS-CoV-2. Більшість досліджень гуморальної ланки імунітету при коронавірусній хворобі 2019 показують, що люди, які одужали від хвороби, мають антитіла проти вірусу. Незважаючи на ознаки успішної нейтралізуючої дії противірусних антитіл, вищі їхні титри можуть асоціюватись із тяжчим клінічним перебігом хвороби, що підтверджується спостереженнями часів епідемії тяжкого гострого респіраторного синдрому, коли титри нейтралізуючих антитіл були значно вищими у померлих пацієнтів у порівнянні з тими, які одужали. Це провокує побоювання, що противірусні антитіла можуть сприяти погіршенню внаслідок антитілозалежного посилення інфекції, що може бути спричинено переносом вірусу в клітину через Fc-фрагмент імуноглобулінів[125]. Однак деякі з цих людей мають дуже низький рівень нейтралізуючих антитіл у крові, що свідчить про те, що клітинна ланка імунітету може бути у них вирішальною для видужання. Люди, заражені будь-яким з інших коронавірусів, можуть виробляти антитіла, що, як вважається, здатні перехресно реагувати з антитілами, що утворюються у відповідь на коронавірусну хворобу 2019[106]. Тривалість гуморальної відповіді після перенесеної хвороби наразі обговорюється. Є свідчення того, що рівень імуноглобулінів класу G швидко знижується особливо після перенесення хвороби з легким перебігом, тоді як є міркування, що у клітинах імунної пам'яті створюється пул, що швидко реагує виробленням антитіл надалі при новому зараженні[176].
З'явилися припущення, що імунітет після перенесеної хвороби, навіть в легкій формі, іноді може бути тривалим, навіть довічним[177][178]. Отримано результати досліджень у 52238 осіб, що свідчать про те, що вакцинація була пов'язана зі значно нижчим ризиком зараження SARS-CoV-2 серед тих, хто раніше не інфікувався і отримав вакцинацію, ніж серед тих, хто раніше хворів та отримав вакцинацію. Жоден з 1359 людей, які раніше хворіли та не вакцинувалися, не мали повторного захворювання протягом усього дослідження[179].
Було показано, що люди, які перехворіли на тяжкий гострий респіраторний синдром у 2003 році, мають через 17 років антитіла до SARS-CoV-1, збудника цієї хвороби, що є дуже близьким до SARS-CoV-2. У гострій фазі хвороби рівні антитіл швидко досягають піку, який створюється не тривало живучими плазматичними клітинами. А надалі вступають у дію тривало живучі клітини імунологічної пам'яті, що виробляють антитіла в тих, хто видужав від коронавірусної хвороби 2019, як наразі відомо й упродовж 6-11 місяців від зараження. Рівні цих антитіл знижуються через шість місяців, але залишаються більш-менш постійними на рівні приблизно від 10 до 20 відсотків від максимального значення реакції на гостру інфекцію або вакцинацію. Клітини імунологічної пам'яті забезпечують довгострокову продукцію цих антитіл на рівні 10-20 % від рівня гострої фази, що забезпечує стабільний захист. Такі клітини зберігаються протягом багатьох років, ймовірно, усе життя[180][181].
Клінічні прояви[ред. | ред. код]
Класифікація[ред. | ред. код]
Наразі виділяють наступні клінічні варіанти перебігу захворювання:
- неускладнені випадки з наявністю неспецифічних симптомів (легкий перебіг);
- пневмонія без дихальної недостатності (середньотяжкий перебіг);
- пневмонія з ознаками дихальної недостатності (тяжкий перебіг);
- критичне захворювання, яке включає появу:
- гострого респіраторного дистрес-синдрому (ГРДС);
- поліорганної недостатності;
- тромботичних проявів;
- сепсису;
- септичного шоку;
Легкий перебіг захворювання[ред. | ред. код]
Інкубаційний період триває від 2 до 14 днів, хоча є свідчення, що може досягати і 20 днів. Багато випадків зараження усіма варіантами не супроводжуються взагалі появою симптомів. Легка форма типово проявляється невисокою гарячкою до 38 °C, кашлем, ринітом та / або закладанням носу. Пацієнти з легким перебігом захворювання можуть також скаржитися на біль у горлі, головний біль, міалгії та нездужання, спотворення нюху (дизосмія), смаку (дизгевзія) та / або втрату нюху (аносмія), смаку (агевзія). У пацієнтів з легким перебігом відсутні ознаки зневоднення, сепсису, задишка або утруднене дихання з відчуттям стискання за грудниною, збільшення частоти дихальних рухів, наявність мокротиння або кровохаркання, нудота, блювання та / або діарея, немає змін психічного стану — сплутаності свідомості, млявості[182]. Літні та імуносупресивні пацієнти можуть мати атипові симптоми.
Аносмія є відносно частим симптомом, який виявляється у певної кількості пацієнтів[183], у низці досліджень до 82 % безсимптомних пацієнтів[184]. Нюхові проблеми зазвичай зустрічаються при у початковому періоді хвороби, у молодому віці, серед жінок, при легкому перебігу хвороби, хоча й іноді трапляються у хворих з тяжчими формами клінічного перебігу[185]. Ймовірною причиною втрати нюху є потрапляння вірусу до допоміжних клітин нюхового епітелію[en][183]. Разом із тим, це не є достатніми для пояснення зворотної аносмії та агевзії, які швидко усуваються. Крім того, залишається невідомою причина порушення хімічних відчуттів у деяких хворих. Є припущення, що пацієнти страждають від дефіциту триптофану, оскільки АПФ2, ключовий елемент у процесі всмоктування триптофану з їжі, значно зменшується у пацієнтів, оскільки SarS-CoV-2 використовує АСЕ2 як рецептор для входу в клітини-мішені. Дефіцит триптофану призводить до дефіциту серотоніну у таких пацієнтів, оскільки триптофан є попередником його синтезу. Такий дефіцит серотоніну може пояснити аносмію, агевзію, враховуючи той факт, що він є важливим нейромодулятором у нюхових нейронах, клітинах смакових рецепторів і транзиторних рецепторних потенційних каналах, які беруть участь у нюхальному та вкусовому процесі[151].
Зміна циркуляції в світі варіантів SarS-CoV-2 призвела до того, що переважаючий з літа 2021 року варіант «Дельта» спричинює захворювання з переважанням нежиттю, значної ринореї і зменшенням випадків аносмії та авгезії відносно того, як це спостерігалося до цього періоду. Хвороба, яку спричинює варіант «Омікрон», має короткий інкубаційний період до 5 днів, відсутність змін нюху та смаку, і переважання легкого перебігу.
Обстеження хворих з легким і середньотяжким ураженням класичним штамом SarS-CoV-2 показало наявність у них перламутрової везикулярної енантеми на піднебінні на відміну від уражень тими варіантами, що з'явились у циркуляції пізніше[186].
Середньотяжкий перебіг[ред. | ред. код]
Пацієнти з таким перебігом не мають ознак дихальної недостатності. Їх турбують такі ж скарги, як і в хворих із легким перебігом. Проте на 1-му тижні хвороби частим проявом, не властивим легкому перебігу, є гарячка з підвищенням температури тіла вище від 38 °C. Суб'єктивно міальгії та артралгії у цих хворих сприймаються значно виразніше і більше, ніж у хворих із легким перебігом. Кашель може бути з мокротинням, при аускультації вислуховуються вологі хрипи. З'являється утруднення та прискорення дихання. Головним у діагностиці є виявлення на комп'ютерній томографії вогнищ запалення в легенях, як правило, дрібних за розміром. Сатурація при такому перебігу не менше ніж 92 %[182].
Тяжкий перебіг (тяжка пневмонія)[ред. | ред. код]
Характерним є поява наприкінці 1-го тижня, протягом 2-го тижня пневмонії. Початок часто з високої за рівнем температури тіла гарячки та інтоксикації. При тяжкій пневмонії у підлітків або дорослих є гарячка або підозра на респіраторну інфекцію, плюс частота дихання до 30 вдихів / хвилину, виражена дихальна недостатність або <90 % на спонтанному диханні в приміщенні. Дитина з кашлем або утрудненням дихання плюс хоча б одне з наступних:
- центральний ціаноз або <90 %;
- виражена дихальна недостатність (наприклад, хрипи, напруження грудної клітки);
- ознаки пневмонії із загальними небезпечними проявами: відмова від грудного годування та пиття, млявість чи непритомність, судоми.
Можуть бути й інші ознаки пневмонії: участь допоміжних м'язів у диханні, часте дихання (кількість вдихів / хвилину): при віці <2 місяців — 60 і більше; 2–11 місяців — 50 і більше; 1–5 років — 40 і більше.
Домінування з початку літа 2021 року варіанту «Дельта» SARS-CoV-2 призвело до деяких змін клінічного перебігу. Зокрема відзначається нерідкий розвиток тяжкого перебігу з виразною інтоксикацією вже за 4-5 днів від початку хвороби з відповідним раннім формуванням пневмонії і швидким падінням сатурації.
Критичний перебіг хвороби[ред. | ред. код]
Проявляється появою нових симптомів або погіршенням респіраторних симптомів, що були до того, появою гострого респіраторного дистрес-синдрому (ГРДС) упродовж одного тижня від початку коронавірусної хвороби 2019.
Критеріями гострого респіраторного дистрес-синдрому (критичної форми при коронавірусній хворобі 2019) визнані[187]:
- задишка з частотою дихання більше 30 вдихів / хвилину;
- гіпоксемія (за результатами пульсоксиметрії);
- дані комп'ютерної томографії грудної клітки з наявністю мультичасткових інфільтратів або міжчасткової легеневої інфільтрації, не пояснена плевральним випотом, колапсом частки або легені або вогнищами, що прогресувала більше ніж на 50 % упродовж 24 — 48 годин. Дихальна недостатність у такій ситуації не повністю пояснюється серцевою недостатністю або можливим перевантаженням введеною рідиною.
Синдром поліорганної недостатності[ред. | ред. код]
Небезпечна для життя дисфункція органів, спричинена порушенням імунної відповіді пацієнта на підозрювану чи доказану інфекцію, що супроводжується поліорганною недостатністю (також мультисистемний запальний синдром). Розвивається при критичному перебігу коронавірусної хвороби 2019. Ознаки такої дисфункції органів:
- змінений психічний стан,
- утруднене або часте дихання,
- низьке насичення киснем,
- зниження діурезу,
- тахікардія,
- слабкий пульс,
- холодні кінцівки або артеріальна гіпотензія,
- зміна забарвлення шкіри,
- лабораторні докази коагулопатії, тромбоцитопенії, ацидозу, високий рівень лактату або гіпербілірубінемія.
Спостерігається при сепсисі, проте може зустрітися й при інших тяжких захворюваннях. Як припускається, виникає при коронавірусній хворобі 2019 через надмірний рівень імунного запалення, «бунт макрофагів».
Шок[ред. | ред. код]
У дорослих зберігається артеріальна гіпотензія, незважаючи на адекватність введення рідини, існує нагальна потреба у вазопресорах для підтримки середнього артеріального тиску ≥65 мм рт. ст. та рівня лактату в сироватці крові> 2 ммоль / літр. Наразі є думки, що такий шок не виникає тільки через сепсис із септичним шоком, а є результатом виникнення тяжкої поліорганної недостатності через надмірне вірусне й імунне запалення, внаслідок чого ефективність гемодинаміки як центральної, так і периферичної пропадає.
Післякоронавірусний (постCOVID-19) синдром[ред. | ред. код]
Цей синдром (англ. The post-COVID-19 syndrome / Long-haul syndrome) характеризується тривалим нездужанням, головним болем, генералізованою втомою, проблемами зі сном, випаданням волосся, розладом запаху, зниженням апетиту, тривалими артралгіями, задишкою, болем у грудях та когнітивною дисфункцією. До 80 % пацієнтів відчувають тривале нездужання після коронавірусної хвороби 2019, яке може зберігатися протягом місяців після гострої інфекції, і майже половина пацієнтів повідомляє про зниження якості свого життя. Ці довгострокові ефекти відбуваються в таких масштабах, що можуть перевищити існуючий потенціал охорони здоров'я, особливо в країнах із низьким і середнім рівнем доходу населення[188].
Пацієнти можуть страждати тривалими нейропсихологічними проявами у різних сферах пізнання. Загадковою особливістю синдрому є те, що він не прогнозується початковою тяжкістю захворювання. Він часто уражає тих, хто хворів легко та середньотяжко, молодих людей, які не потребували дихальної підтримки або інтенсивної терапії. Післякоронавірусний синдром, імовірно, є результатом різноманітних патогенетичних механізмів. Постійні респіраторні прояви пов'язані з незакінченою пневмонією. Неврологічні симптоми пов'язані з мікро- та / або макросудинною тромботичною хворобою. МРТ головного мозку через 3 місяці після зараження продемонструвала мікроструктурні зміни у 55 % пацієнтів. Крім того, особливості ураження головного мозку пов'язані з енцефалітом та аутоантитілами до тканини мозку, а також серйозною церебральною вазоконстрикцією. Мікроваскулярна тканина мозку експресує рецептори АПФ-2, а «псевдовіріони» SARS-CoV-2 можуть зв'язуватися з мікросудинним ендотелієм, спричиняючи церебральне мікросудинне запалення та згортання там крові. Особливості післякоронавірусного синдрому збігаються з особливостями міалгічного енцефаломієліту / синдрому хронічної втоми. Спостерігалася подібність між синдромом активації тучних клітин і післякоронавірусним синдромом, і багато хто з науковців вважає його варіантом синдрому активації тучних клітин. Ці клітини присутні в головному мозку, особливо в середній частині гіпоталамуса, де вони розташовані навколо судин поблизу нервових закінчень. Після стимуляції тучні клітини вивільняють прозапальні медіатори, як то гістамін, триптазу, хемокіни та цитокіни, що може призвести до нервово-судинного запалення. «Туман мозку», когнітивні порушення та загальна втома, про які повідомляється в перебігу післякоронавірусного синдрому, ймовірно пов'язані із запаленням нервової та судинної систем. Імовірно, у хворих, які отримували неадекватне і надмірне протизапальне лікування під час гострої фази коронавірусної хвороби 2019, набагато частіше розвивається післякоронавірусний синдром. Подібно до пацієнтів, які одужали від сепсису, тривале порушення імунітету з підвищеними про- та протизапальних цитокінів може сприяти розвитку післякоронавірусного синдрому. Невідома кількість хворих, які одужали від пневмонії при коронавірусній хворобі 2019, у яких розвинеться фіброз легень, що пов'язаний з обмеженням рухової активності під час хвороби. Цих пацієнтів слід направити до пульмонолога, який має досвід у лікуванні фіброзу легень. Антифібротична терапія може дати ефект у цих хворих. Є міркування, що блокатор серотонінових рецепторів ципрогептадин може зменшити ризик легеневого фіброзу[145][189][190].
Поки що немає чіткого узгодженого всіма науковцями визначення посткоронавірусного (постCOVID-19) синдрому. У клінічних настановах Національного інституту охорони здоров'я та вдосконалення медичної допомоги Великої Британії (NICE) «Лікування довгострокових наслідків COVID-19» (NG188) використовуються такі клінічні визначення для первинної хвороби та тривалої коронавірусної хвороби 2019 залежно від часу, коли вони виникли та впродовж якого зберігаються:
- гостра коронавірусна хвороба 2019 — ознаки та симптоми захворювання зберігаються до 4 тижнів;
- тривала коронавірусна хвороба 2019 із симптомами — ознаки та прояви зберігаються 4-12 тижнів;
- пост-COVID-синдром — ознаки та прояви розвиваються під час або після коронавірусної хвороби 2019, зберігаються понад 12 тижнів і не пояснюються альтернативними діагнозами[145].
Американське товариство з інфекційних захворювань (IDSA) вирізняє «тривалу коронавірусну хворобу 2019», «пост-COVID-синдром» і «пост-гострий COVID-синдром». Поняття «хронічного» або «тривалого» перебігу будь-якої інфекційної хвороби включає персистенцію збудника. Інші коронавіруси мають властивість тривалий час зберігатися в нервовій системі, ймовірно SARS-CoV-2 також схильний до цього. Якщо патологічні зміни після перенесеної хвороби зберігаються, але збудника при цьому вже не знаходять, то йдеться про наслідки хвороби, яке має називатися посткоронавірусним синдромом. Гарвардська вища медична школа створила поняття «далекобійник» (англ. post-COVID long-hauler), — будь-яка людина, з підтвердженою коронавірусною хворобою 2019, яка не повернулася до свого рівня здоров'я й функціонування через 6 місяців після перенесеного захворювання. За різними даними, «далекобійниками» стають від 10 до 50 % хворих, які перенесли коронавірусну хворобу 2019[145].
Розрізняють дві групи таких пацієнтів:
- ті, які мають незворотні ушкодження серця, легень, нирок чи головного мозку, що впливають на їх здатність жити повноцінним життям;
- ті, в кого тривають серйозні клінічні прояви, незважаючи на відсутність помітних ушкоджень цих органів.
Якою б не була природа змін, що пов'язані із тривалим збереженням клінічних проявів або появою нових після перенесеного гострої коронавірусної хвороби 2019, їхня наявність потребує реабілітаційних заходів[145].
Встановлено, що в осіб, які перенесли коронавірусну хворобу 2019, через 2 тижня після клінічного одужання концентрація цитокінів у сироватці крові, включаючи відповідні деякі інтерлейкіни, вища порівняно з групою контролю, що свідчить про подовження запалення[191][192].
Ендотеліїт (запалення ендотелію) є одним із головних патологічних процесів, що виникає під час коронавірусної хвороби 2019. Є докази прямого інфікування SARS-CoV‑2 ендотеліальних клітин і спричиненого цим дифузного ендотеліїту. Ураження ендотелію кровоносних судин через гіперімунну реакцію ушкодження цитокінами та вільними радикалами зумовлює розвиток системного «тліючого» запалення під час посткороновірусного синдрому[145].
Після перенесеної коронавірусної хвороби 2019 у хворих через ураження ендотелію судин на 25 % збільшується ризик тромбоемболій. Виявляється стійкий спазм кровоносних судин (вазоконстрикція). Через ураження міокарда часті аритмії і на 22 % збільшується ризик інфаркту міокарда. Спостерігаються порушення кровопостачання (перфузії) та ішемічні зміни в міокарді[145].
У багатьох хворих формується виразний астенічний синдром, який значною мірою знижує їхню якість життя й істотно зменшує працездатність. У таких пацієнтів тривалий час може йти запалення низької інтенсивності в головному мозку, знижується приток крові до нього, приєднується автоімунне ушкодження цього органу або відбувається поєднання цих аномалій. Накопичення прозапальних цитокінів, які проходять через гематоенцефалічний бар'єр, у ЦНС може сформувати дисрегуляцію центральних структур і породити вегетативну дисфункцію (гарячка, порушення циклу сну, когнітивні проблеми, швидка втомлюваність). Після перенесення гострої фази коронавірусної хвороби 2019 потрібен обов'язковий моніторинг дихальної функції, стану кардіальної, нервової системи і психічних функцій, а ще синдромально-патогенетичний підхід до реабілітації хворих, спрямований першочергово на знешкодження системного фонового запалення, покращення функції ендотелію та зниження астенічних проявів[145].
Виявлено відносно високу частоту когнітивних порушень через кілька місяців після того, як пацієнти заразилися SARS-CoV‑2. Серед них переважали порушення виконавчої діяльності, швидкості обробки інформації, вільного володіння категоріями, ураження пам'яті та запам'ятовування. Ця закономірність узгоджується з ранніми повідомленнями, що описують дисекзекутивний синдром після коронавірусної хвороби 2019, і має значні наслідки для професійних, психологічних і функціональних результатів. Відомо, що певні групи населення, як то люди похилого віку, можуть бути особливо сприйнятливі до когнітивних порушень після тяжкої хвороби. Проте й у відносно молодих людей виявлено часту когнітивну дисфункцію кілька місяців після одужання. Результати цього дослідження загалом збігаються з результатами досліджень стосовно інших вірусних хвороб, як то грипу[193].
Діагностика[ред. | ред. код]
Визначення випадку коронавірусної хвороби 2019 (COVID-19)[ред. | ред. код]
- Підозрілий випадок:
- 1. Пацієнти з тяжкою гострою респіраторною інфекцією (гарячкою, кашлем і стан яких потребує госпіталізації), та без будь-якого іншого етіологічного чинника, який би міг повністю пояснити клінічні прояви, і які за 14 днів до появи симптомів відповідали принаймні одному із наступних критеріїв:
- тісний контакт з підтвердженим або ймовірним випадком коронавірусної хвороби 2019;
- або
- перебували в районах із відомою суспільною передачею COVID-19.
- 2. Пацієнти з будь-яким гострим респіраторним захворюванням та наявністю хоча б одного з наступних критеріїв протягом попередніх 14 днів:
- перебував у контакті із підтвердженим або ймовірним випадком COVID-19;
- працював або відвідував заклад охорони здоров'я, де проходили лікування пацієнти з підтвердженою або ймовірною COVID-19.
- Епідеміологічно пов'язаний випадок — це такий підозрілий випадок, коли ще не проведено адекватного лабораторного обстеження, але який мав контакт з іншим лабораторно підтвердженим випадком COVID-19 за 14 днів до появи симптомів у себе.
- Ймовірний випадок: пацієнт із підозрою на коронавірусну хворобу 2019, результат лабораторного дослідження якого на SARS-CoV-2 є сумнівним або, що отримав позитивний результат на загальний для всіх бетакоронавірусів антиген (панкоронавірусний антиген), а також у нього відсутні лабораторні підтвердження наявності інших (некоронавірусних) респіраторних патогенів.
- Підтверджений випадок — людина з лабораторно підтвердженою коронавірусною хворобою 2019, незалежно від наявності або прояву клінічних ознак і симптомів.
Важливо зазначити, що визначення випадків різняться залежно від країн і регіонів територій, що постраждали від захворювання, і це, в свою чергу, вплинуло на реакцію на охорону здоров'я. При визначенні випадків важливо, щоб національні рекомендації враховували віковий розподіл населення та наявність супутніх захворювань, включаючи серцево-судинні захворювання, цукровий діабет і рак, що збільшує ризик розвитку тяжких та / або критичних захворювань та ризик смерті[90].
Визначення контакту[ред. | ред. код]
Контактний/а — це особа, яка відповідає будь-якому з наступних критеріїв:
- надання прямої медичної допомоги пацієнтам із коронавірусною хворобою 2019 — медичний працівник або інша особа, яка надавала медичну допомогу або проводила догляд за хворим на неї навіть за умови використання відповідних засобів індивідуального захисту;
- працівники лабораторій, які обробляють зразки з дихальних шляхів отримані від хворих на коронавірусну хворобу 2019 або працівники патологоанатомічних / судово-медичних бюро / відділень, які безпосередньо розтинали тіла і проводили процедури, які можуть призводити до утворення інфекційного аерозолю (застосування операційної кісткової пилки, центрифуги, аспіраційного обладнання тощо), в тому числі брали зразки для проведення лабораторного дослідження навіть за умови використання відповідних засобів індивідуального захисту;
- робота з медичними працівниками, зараженими SARS-CoV-2, відвідування пацієнтів або перебування в одному приміщенні з пацієнтом із коронавірусною хворобою 2019;
- особа, яка мала прямий фізичний контакт із хворим на COVID-19 (зокрема, через рукостискання);
- особа, яка мала незахищений контакт без використання засобів індивідуального захисту із слизовими виділеннями з дихальних шляхів хворого на COVID-19 (зокрема, перебування поблизу від такого пацієнта під час кашлю, чи доторкування руками до використаних серветок);
- особа, що контактувала із хворим або кількома на відстані до одного метру протягом 15 хвилин і більше, без використання відповідних засобів індивідуального захисту або при підозрі на їх неправильне використання (зокрема, при порушенні цілісності рукавичок);
- спільна робота або навчання в безпосередній близькості з пацієнтом із коронавірусною хворобою 2019;
- подорож разом із пацієнтом із коронавірусною хворобою 2019 у будь-якому транспорті, при контакті в літаку в межах двох сидінь (у будь-якому напрямку) з хворим, контактами вважаються супутники подорожі та члени екіпажу, які обслуговували в салоні літака, де знаходився хворий, якщо тяжкість симптомів (наприклад, частий кашель) або переміщення особи вказують на більшу зону ризику зараження, пасажири, які сидять у всій секції, або всі пасажири літака;
- проживання в одному домогосподарстві з хворим на коронавірусну хворобу 2019 упродовж 14 днів після виникнення симптомів у цього хворого.
Клінічна діагностика[ред. | ред. код]
Оцінка неспроможності органів (SOFA) коливається в межах від 0 до 24 і включає бали, пов'язані з 6 системами організму:
- дихальна (гіпоксемія, визначена низьким рівнем PaO2 / FiO2);
- згортання крові (низький рівень тромбоцитів);
- печінка (поява жовтяниці, високий рівень білірубіну);
- серцево-судинна (артеріальна гіпотензія);
- центральна нервова система (низький рівень свідомості, визначений за шкалою Глазго);
- ниркова (знижений діурез або високий вміст креатиніну).
Синдром визначається збільшенням послідовної оцінки SOFA на ≥2 бали.

Інструментальна діагностика[ред. | ред. код]
Для діагностики атипової пневмонії при коронавірусній хворобі 2019 проводиться рентгенографія легень та комп'ютерна томографія (КТ).
Рентгенографія є доступним методом, адже навіть у лежачого пацієнта її можна зробити за допомогою переносного рентгенівського апарату. Але вона часто не показує зміни у хворих із нетяжкою пневмонією. На рентгенологічних знімках у самих тяжких випадках відзначається двосторонні рентгенологічні затемнення в обох легенях, що демонструється появою світлого забарвлення на тлі притаманній рентгенологічній картині нормальній темній паренхіми легень.
КТ грудної клітки показує двостороннє ураження. Відзначаються вогнища ущільнення паренхіми типу «матового скла». Цей метод дає можливість визначення кількісного ураження паренхіми легень у відсотках. КТ-контроль у тих хворих, в яких було діагностовано пневмонію на початку хвороби, слід проводити не раніше ніж за 2-3 місяці. Навіть тоді у частини хворих спостерігаються зміни по типу «матового скла», характерні для гострої пневмонії. Через технічну складність проведення рентгенографії та КТ у хворих, що знаходяться на штучній вентиляції легень, рекомендується для контролю стану легень застосовувати ультразвукову діагностику (УЗД) за допомогою переносних апаратів, яка до цього в діагностиці ураження легень у рутинній клінічній практиці використовувалася нечасто через застосування рентгенографії та КТ. Наявність переважно підплевральних уражень дає перевагу використанню УЗД[194][195].
Загальнолабораторна діагностика[ред. | ред. код]
Перелік діагностичних обстежень при госпіталізації в Україні включає обов'язкову ЕКГ, клінічний аналіз крові, клінічний аналіз сечі, біохімічний аналіз крові, визначення рівня глюкози крові[196].
У госпіталізованих пацієнтів із пневмонією відмічено лейкопенію або лейкоцитоз, лімфопенію, тромбоцитопенію, підвищену активність аланінамінотрансферази (АЛТ) та аспартатамінотрансферази (АСТ). У пацієнтів, які перебували на лікуванні у відділенні інтенсивної терапії, додатково відзначалися відхилення в лабораторних показниках, які можуть бути обумовлені розвитком клітинного імунодефіциту, активацією коагуляції, пошкодженням міокарда, порушенням функції печінки і нирок. Виявлено статистично достовірне збільшення кількості нейтрофілів із прогресивною лімфопенією, підвищення рівня D-димеру як маркеру легеневих тромбозів, сечовини і креатиніну сироватки крові, прокальцитоніну (поліпептиду, який є неактивним попередником кальцитоніну)[197], С-реактивного білка, який є чітким маркером тяжкості перебігу коронавірусної хвороби 2019 (його рівні вище 100 мкг / мл при будь-якому захворюванні є ознакою фульмінантного запалення та пов'язані з поганим прогнозом захворювання),[198], і феритину, інтерлейкінів 6, 8 і 10[126]. Проте є дослідження, що припускають менше значення використання рівнів D-димеру для виключення легеневих тромбозів серед пацієнтів, госпіталізованих із коронавірусною хворобою 2019, чи їх обмежену клінічну користь[199].
Специфічна лабораторна діагностика[ред. | ред. код]

Полімеразна ланцюгова реакція і методи отримання матеріалу для неї[ред. | ред. код]
Відбираються зразки з верхніх і нижніх дихальних шляхів для тестування на SARS-CoV-2 за допомогою ПЛР (в режимі реального часу — rRT-PCR), яка є одним із видів тестів на ампліфікацію нуклеїнових кислот (Nucleic acid amplification tests або NAAT). За необхідності проводиться підтверджуюче секвенування нуклеїнової кислоти[200]. Матеріал для дослідження відбирають медичні працівники, одягнені в засоби індивідуального захисту. Виявлення РНК SARS-CoV-2 проводиться всім пацієнтам з підозрою на коронавірусну хворобу 2019, а також контактним особам. Для дослідження береться матеріал, отриманий при взятті мазка з носоглотки (щонайменше на глибину 3 см у носових ходах) і ротоглотки, промивні води бронхів, отримані при фібробронхоскопії (бронхоальвеолярний лаваж), ендотрахеальний, назофарингеальний аспірат, мокротиння. Від пацієнтів із механічною вентиляцією легень можна збирати тільки зразки виділень із нижніх дихальних шляхів[201]. При збиранні зразків матеріалу з верхніх дихальних шляхів використовуються вірусні тампони[202] та вірусні транспортні носії. Не слід під час взяття мазка торкатися ніздрів або мигдаликів. У пацієнта з підозрою на коронавірусну хворобу 2019, особливо з пневмонією або тяжкими респіраторними проявами, один зразок із верхніх дихальних шляхів є недостатнім, і рекомендується взяття додаткових зразків із верхніх дихальних і з нижніх дихальних шляхів, останнім надається перевага. Один позитивний тест підтверджується другим тестом ПЛР, який визначає інший ген SARS-CoV-2. Одиничний негативний тест на виявлення SARS-CoV-2 (особливо, якщо це зразок із верхніх дихальних шляхів) або позитивний результат дослідження щодо виявлення іншого респіраторного збудника не виключає коронавірусної хвороби 2019. Якщо існує обґрунтована підозра на інфікування, слід перевірити інший зразок за допомогою первинного та вторинного ПЛР. Виявлення РНК за допомогою ПЛР не обов'язково свідчить про те, що він зберігає здатність до реплікації чи спричинити надалі хворобу[87].

У госпіталізованих пацієнтів з підтвердженою коронавірусною хворобою 2019 необхідно повторно взяти зразки з верхніх та нижніх дихальних шляхів для визначення змін кількості коронавірусу — вірусного кліренсу. Забір зразків має проводитися щонайменше кожні 2 — 4 дні, поки у пацієнта, що клінічно одужав, не буде досягнуто інтервал не менше 24 годин між двома наступними один за одним негативними результатами (обидва зразки з верхніх дихальних шляхів і з нижніх дихальних шляхів, за умови, якщо обидва були зібрані). Всі зразки слід зберігати при температурі 2-8 °C до 48 годин після збору. Для обробки та доставки через 48 годин рекомендується зберігання зразків при температурі -70 °C. Дослідження слід проводити щонайменше у боксах біологічної безпеки II класу. Лабораторії проводять тестування на ПЛР стосовно SARS-CoV-2 самостійно та у співпраці зі спеціалізованими лабораторіями у випадках неоднозначних чи сумнівних результатів. Робити забір зразків крові, сечі та випорожнень для проведення обстеження хворого на SARS-CoV-2 методом ПЛР не рекомендується.
Повідомлено про створення швидкого тесту ампліфікації нуклеїнових кислот (Nucleic acid amplification tests або NAAT) за допомогою ПЛР, який дає результат через 5 хвилин від початку дослідження. Тест проводиться на основі приладної спеціальної швидкої ізотермічної системи для якісного виявлення інфекційних захворювань. Це дозволить клініцистам приймати клінічні рішення, засновані на доказах, безпосередньо під час візиту пацієнта[203][204].
З міркувань біологічної безпеки CDC не рекомендує проводити виділення SARS-CoV-2 на культурах клітин у звичайних лабораторіях. Це дослідження можливо проводити лише у боксах біологічної безпеки II класу.
Імунохроматографічні дослідження[ред. | ред. код]
Впроваджено швидкий імунохроматографічний тест для якісного виявлення антигенів (нуклеокапсидного білка) SARS-CoV-2 (CITO TEST COVID-19 Ag) у мазках з носоглотки осіб з підозрою на коронавірусну хворобу 2019 в гостру фазу хвороби впродовж 5-7 днів після появи перших симптомів[205]. Чутливість методу досягає 90 %, точність 97 %. Результати можуть бути отримані за 15-20 хвилин[206].
Розроблені експрес-тести на основі імунохемілюмінесцентного аналізу для виявлення антитіл класів IgM та IgG[207][208]. На основі імунохемілюмінесцентного іммуноаналізу бічного потоку можливе швидке якісне роздільне виявлення анти-SARS-CoV-2 IgG та IgM у зразках цільної крові людини, сироватки крові або плазми. Цей метод може бути застосований у польових (не лабораторних) умовах. Важливо зазначити, що на ранніх стадіях хвороби (3-7 день) ці антитіла можуть бути в концентрації нижче межі виявлення для цього тесту. Ці тести не підтверджують наявність коронавірусної хвороби 2019, а є орієнтовними. Американський інститут здоров'я не рекомендує використовувати цей тест для діагностики гострої фази коронавірусної хвороби 2019[209].
Імуноферментний аналіз[ред. | ред. код]
Також в Україні розроблені і впроваджені методи виявлення антитіл класів IgM та IgG у лабораторному режимі в імуноферментному аналізі (ІФА), вони є точнішими за експрес-тести, але також не є підтверджуючими наявність коронавірусної хвороби 2019[210]. Наявність у крові людини антитіл класу IgM свідчить про можливість гострої стадії коронавірусної хвороби 2019, тоді як IgG — про період видужання. Впроваджено й дослідження в крові антитіл класу IgA, наявність яких у підвищеній кількості відбувається в гострому періоді хвороби.
Специфічне обстеження супутніх хвороб і станів[ред. | ред. код]
Бажане обстеження для виявлення ко-інфекцій з іншими респіраторними вірусами, такими як збудники грипу A і B, пташиного грипу, респіраторно-синцитіальний вірус, віруси парагрипу, аденовіруси, ентеровіруси (зокрема, EVD68), метапневмовірус людини та ендемічний коронавірус людини БКРС / MERS (тобто ізоляти HKU1, OC43, NL63 та 229E). Зразки також слід перевірити на бактеріальні збудники, зокрема Legionella pneumophila (збудник легіонельозу), які спричинюють тяжкі респіраторні ураження. Для встановлення причини пневмонії також рекомендовано застосування класичної (звичайної) ПЛР, зі зворотною транскрипцією (ЗТ-ПЛР), мультиплексною ПЛР на 19 вірусних і 7 бактеріальних збудників, ПЛР із детекцією продукту ампліфікації в реальному часі. Це є перспективним для виявлення таких збудників, як M. pneumoniae і C. pneumoniae, а також респіраторних вірусів.
Через можливий розвиток сепсису та вторинної бактеріальної пневмонії в деяких випадках тяжкого перебігу COVID-19 збір зразків для лабораторної діагностики не повинен відкладати початок антимікробної терапії. Слід проводити бактеріологічний посів крові для виділення культури бактерій, а також посів мокротиння, в ідеалі перед початком антибактеріальної терапії.
Систематичний скринінг венозних тромбоемболій у хворих із коронавірусною хворобою 2019 не рекомендується, але має бути підвищений рівень обізнаності відносно можливого розвитку венозної тромбоемболії під час госпіталізації. Слід звернути увагу на такі клінічні ознаки, як пастозність (припухлість) нижньої кінцівки, гіпоксемію, різке погіршення дихання, гостру правошлуночкову недостатність чи розширення правого шлуночка за даними ехокардіоскопії, проблеми з катетером тощо, судоми у нижніх кінцівках особливо вночі, які можуть бути через тромбоз глибоких вен. Візуалізація повинна бути виконана у всіх випадках підозри на венозну тромбоемболію[211].
Лікування[ред. | ред. код]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Показання до госпіталізації[ред. | ред. код]
Госпіталізація показана хворим з підозрою або підтвердженою коронавірусною хворобою 2019 при:
- середньотяжкому (нетяжка пневмонія) і тяжкому перебігу, коли є аускультативні ознаки пневмонії та / чи дихальної недостатності (збільшення частоти дихальних рухів вище фізіологічної норми, кровохаркання, показник SpO2 при вимірюванні пульсоксиметром ≤ 92 %) за наявності рентгенологічно підтвердженої пневмонії;
- наявність клініко-інструментальних даних гострого респіраторного дистрес-синдрому;
- наявність клініко-лабораторних даних сепсису та / чи септичного шоку;
- наявність клініко-лабораторних даних іншої, окрім дихальної, органної / системної недостатності;
- пацієнти, незалежно від тяжкості стану, які належать до групи ризику розвитку ускладнень: тяжкий перебіг артеріальної гіпертензії, декомпенсований цукровий діабет, ниркова недостатність, тяжка хронічна патологія дихальної та серцево-судинної систем, тяжкі алергічні хвороби, цереброваскулярні захворювання в фазі декомпенсації, аутоімунні захворювання, онкологічні захворювання;
- хворі незалежно від тяжкості стану, в яких відзначається гарячка вище 38°С, що погано піддається корекції (короткочасне, не більше ніж на 1-1,5 години зниження температури тіла на тлі вживання жарознижувальних препаратів, з подальшим її підвищенням).
Особам, які звернулися за екстреною медичною допомогою телефоном, диспетчер цієї служби проводить опитування відповідно до алгоритму пошуку особи з підозрою на коронавірусну хворобу 2019. Якщо під час опитування відсутні показання до виїзду бригади, то пацієнту надаються відповідні рекомендації. Якщо вони наявні, то до такої особи виїжджає бригада у засобах індивідуального захисту, проводить обстеження, встановлює попередній діагноз та ступінь тяжкості захворювання і наявність показань до госпіталізації. Пацієнтам, які не мають таких, надаються поради по самоізоляції та наголошується на необхідності звернення до сімейного лікаря (а за відсутності сімейного лікаря — до регіональної чи національної гарячої лінії COVID-19). Пацієнти, у яких є показання до госпіталізації, транспортуються бригадою екстреної медичної допомоги у визначений для приймання таких хворих регіональний заклад охорони здоров'я.
Особливості оцінки лікування недоказаними лікарськими препаратами[ред. | ред. код]
Науковці застерігають від надмірного оцінювання деяких препаратів у лікуванні коронавірусної хвороби 2019. Вони відмічають, що подання інформації про те чи інше дослідження відбувається з недоліками через:
- зосередження уваги на результатах одного дослідження без зв'язку з іншими;
- відсутність визнання того, що окремі дослідження рідкісно призводять до остаточних висновків;
- надмірний акцент на якісь результати, без вказівки на певні обмеження;
- повідомлення, які засновані на неповних чи нерецензованих звітах[212].
Новини звітів про окремі дослідження мають бути фактичними та звітуючими про основні результати та абсолютні ризики, визначати сукупність пацієнтів і підкреслювати обмеження у валідності та узагальненості. Вони також повинні включати думки інших незалежних експертів у цій галузі, які не мають конфлікт інтересів. Висновки цих експертів повинні бути контекстними, включати порівняння з результатами інших досліджень, перевагу, яку слід надати (або не надати) поточним порівняно з іншими дослідженнями, і як зазвичай таке лікування вивчається для цього захворювання[212].
Обґрунтування пробного призначення ймовірних етіотропних і патогенетичних препаратів[ред. | ред. код]
У зв'язку з відсутністю доказового специфічного лікування пацієнтам із підозрою або підтвердженою COVID-19, яким ніщо інше (патогенетичні засоби, киснева неінвазивна підтримка) не допомогло і стан пацієнта наближається до критичного, можливе застосування неліцензованих методів лікування або препаратів поза прямих їх показань до застосування за фармакологічною інструкцією (out-of-treatment treatment або off lable drug use), за рішенням консиліуму та згоди самого пацієнта. Така можливість використовується й при ситуації з такими інфекційними хворобами, які мають тяжкі наслідки, несподіваний тяжкий ефект для пацієнта, часто відбуваються в рамках надзвичайної ситуації світового масштабу. Тоді ВООЗ може застосувати відповідний протокол. Етично запропонувати окремим пацієнтам експериментальні втручання в екстрених випадках поза клінічними випробуваннями («співчутливе використання»), за умови:
- що не існує доведеного ефективного лікування;
- неможливо негайно розпочати клінічні дослідження;
- пацієнт або його законний представник дав усвідомлену згоду;
- і невідкладне використання втручання контролюється, а результати документуються та своєчасно передаються широкій медичній та науковій спільноті.
Рішення запропонувати пацієнтові недоведене або експериментальне лікування приймається виключно лікарем і пацієнтом, але повинно відповідати національному законодавству. Там, де можливо і здійснено можливість лікування в рамках клінічного випробування, це слід робити, якщо пацієнт не відмовиться брати участь у дослідженні[213][214].
Через відсутність доказових схем лікування клінічний підрозділ ВООЗ продовжує збирати клініцистів в усьому світі двічі на тиждень у режимі телеконференції (COVID-19 Clinical Network) для обміну знаннями та досвідом лікарів, які лікують пацієнтів з COVID-19, і висвітлює оперативні виклики та технічні питання, що виникають.
Засоби і заходи, що використано під час пандемії[ред. | ред. код]
Наразі препарати з можливою етіотропною та патогенетичною дією, які використано при лікуванні коронавірусної хвороби 2019, скомпоновано у класифікацію видів лікування[214][215]:
- неспецифічні противірусні препарати — інтерферони, імуноглобулін, інтерлейкін-2;
- антивірусні препарати широкого спектра дії — фавіпіравір, рибавірин, тріазавірин, уміфеновір, софосбувір+даклатасвір, софосбувір+ледіпасвір, уміфеновір+рибавірин, сіяньпін, нітазоксанід, галідесивір;
- антиретровірусні препарати — ASC09, азвудін, данопревір, дарунавір, дарунавір+кобіцистат, лопінавір+ритонавір, ремдесивір, данопревір+ритонавір, ASC09+ритонавір, клевудин;
- інші противірусні препарати — балоксавіру марбоксил, озельтамівір, BLD-2660;
- антивірусні комбінації (коли йде поєднання противірусних препаратів різних фармакологічних груп) — інтерферон альфа+лопінавір, уміфеновір+інтерферон альфа, лопінавір+ритонавір+рибавірин+інтерферон бета1, ASC09F+озельтамівір, ритонавір+озельтамівір, лопінавір+ритонавір+сіяньпін, лопінавір+ритонавір+інтерферон бета1;
- протималярійні препарати — хлорохін, гідроксихлорохін, дигідроартемізинін, мефлохін, GNS561 (аналог хлорохіна)
- протималярійні + антибіотики — гідроксихлорохін + азитроміцин;
- антибіотики + протималярійні + моноклональні антитіла — азитроміцин+гідроксихлорохін+тоцилізумаб;
- антибіотики — канаміцин, цефтріаксон, левофлоксацин або моксифлоксацин, піперацилін+тазобактам, цефтароліна фозарміл, амоксицилін+потассіум клавунат, оритаванцин, стандартний курс макролідів, тейкопланін, далбаванцин, азитроміцин, мерафлоксацин[216];
- антипаразитарні — сураміна содіум, левамізол, сенікапок, ніклозамід, нітазоксанід, івермектин;
- протималярійні + антипаразитарні — гідроксихлорохін+івермектин;
- протигрибкові — ітраконазол;
- неспецифічні протизапальні препарати — метилпреднізолон, ціклозонід, дексаметазон, будесонід+формотерол, гідрокортизон, інші глюкокортикостероїди, преднізон;
- протизапальні — колхіцин, пікліденосон, ебселен, фенретинід, пікліденозон, буцілламін;
- імуносупрессанти — фінголімод, лефлуномід, талідомід;
- 10 % нормальний імуноглобулін людини;
- інгібітори тирозинкінази — джакотініба гідрохлорід, руксолітиніб, нінтеданіб езілат, іматиніб мезілат, акалабрутиніб, баріцитиніб, фостаматініб;
- неспецифічні протизапальні + імуносупресанти — метилпреднізолон+такролімус;
- інгібітори протеаз — камостата мезілат;
- моноклональні антитіла — адалімумаб, бевацизумаб, камрелізумаб, екулізумаб, маврілімумаб, меолізумаб, PD-1 mAb, сарілумаб, тоцилізумаб, меплазумаб, адамумаб+тозумаб, іксекізумаб, ніволумаб, IFX-1, леронлімаб (PRO 140), клазікізумаб, бамланівімаб разом з етесевімабом, сотровірімаб, касиривімаб разом з імдевімабом, регданвімаб, ланаделумаб;
- противірусні + моноклональні антитіла — фавіпіравір+тоцилізумаб;
- противірусні + протималярійні — дарунавір+кобіцистат+гідрооксихлорохін, фавіпіравір+хлорохіна фосфат;
- імуномодулятори — CD24, анакінра;
- інгібітори ангіотензинових рецепторів — лозартан, рекомбінантний людський ангіотензинконвертуючий фермент 2 (rhACE2), телмісартан, валсартан, каптоприл, Renin-Angiotensin-System-Blockade;
- протиаритмічні — аміодарон;
- альфа-адреноблокатори — празозин;
- блокатори кальцієвих каналів — верапаміл;
- вазоділятатори — ангіотензин 1-7;
- кардіопротектори — аспірін+клопідогрель+ривароксабан+аторвастатин+омепразол;
- антикоагулянти — еноксапарину содіум, ривароксабан, тинзапарин;
- антивірусні + антагістамінні препарати — ебастин+інтерферон альфа;
- ненаркотичні анальгетики (NSAID) — ібупрофен, напроксен;
- муколітики — ацетилцистеїн, бромгексину гідрохлорид;
- антидепресанти — флувоксамін;
- інші препарати — авіптаділ (вазоактивний інтестінальний пептид), бісмута потассіума цитрат (блокатор SARS-CoV1-гелікази), дипіридамол, пірфенідон (препарат, що застосовується при ідіопатичному фіброзі легень), поліінозинна-поліцитіділічна кислота (polyinosinic-polycytidylic acid), rhG-CSF, тимозин, траніласт, улінастатин, вітамін С, содіума аесцінат, тетранандрін, ліпоєва кислота ін'єкційна, PUL-042 розчин для інгаляцій, носкапін, Т89 (поліпшує сатурацію крові киснем), напроксен+лансопразол, нейрокінін-1 антагоніст, дефероксамін, рабепразол, з'єднання амінокислот, транексамова кислота, розчин, що виділяє оксид азоту, хлорид цинку, селінексор, розчин для ін'єкцій Т3, куркумін С3, берберин, піридостигмін, даларгін, фебуксостат, вазегепант, дапагліфлозин, абатацепт, апрепітант;
- вакцини — БЦЖ, рекомбінантна нова коронавірусна вакцина аденовірусного вектора (Recombinant Novel Coronavirus (2019-nCOV) Vaccine (Adenovirus Vector), bacTRL-Spike vaccine, ChAdOx1 nCoV-19 vaccine, CIGB 2020 vaccine);
- не ліки:
- розширена терапія медичними продуктами (Advanced Therapy Medicinal Products) — аерозоль vMIP (вірусний макрофагальний запальний білок), анкілозавр (Ankylosaurus — M1 макрофагальна ціль), інактивована анти-2019-nCoV плазма реконвалесцентів / тих, хто видужав[217], інактивована анти-2019-nCoV-2 плазма реконвалесцентів, лікувальна плазма, мезенхімальні стовбурові клітини крові, стовбурові клітини людської менструальної крові, імуноглобулін від пацієнтів, що вилікувалися, інактивована вакцина проти мікобактерій, мезенхімальні стовбурові клітини, атомізовані екзосоми мезенхімальних стовбурових клітин, мРНК-1273, NK-клітини (природні кілери), ін'єкція білка рекомбінантного цитокіну, регулювання кишкової мікрофлори, антитіла від хворих, що видужали від коронавірусної пневмонії, мононуклеарні[218] клітини пуповинної крові, мезенхімальні стовбурові клітини пуповинної крові (hucMSC), мезенхімальні стовбурові клітини Вортона Джеллі, стовбурові клітини зубної пульпи людини, сарграмостім (Rhu GM-CSF), рекомбінантний суперскладений інтерферон (rSIFN-co), алогенна мезенхімальна терапія стовбуровими клітинами (HBadMSC), мезенхімальні стовбурові клітини кісткового мозку;
- перегрупована метаболомічна[219] група — з'єднана амінокислота;
- захисні пристрої — під час гастрофіброскопії саморобна «гастроскопічна маска», медична маска, респіратор N95;
- засоби інфекційного контролю — пропофоловий наркоз, поширена екстубація та післяопераційна стратегія «кровообіг — індуковане дихання», анестезія севофлураном;
- реабілітація — легенева реабілітація за допомогою затіненого екрана телевізора, тренування з реабілітації легень, реабілітація з дистанційним моніторингом, освіта пацієнтів;
- інгаляції газу — вдихання оксиду азоту, застосування концентратору кисню, застосування водно-кисневого небулайзеру, вдихання водню, використання постійного позитивного тиску в дихальних шляхах;
- респіраторна підтримка — високопотокова киснева терапія за допомогою носових канюль (HFNC), з зубцями, для дорослих і дітей; киснева маска з оксигенацією (SMO), високопотокова киснева (безканюльна) носова оксигенація, мішок і клапан, висококонцентрований, для дорослих, нестерильний, одноразовий; маска Вентурі, із замком O2 і насосно-компресорними трубами для дітей і дорослих; постуральне позиціювання (на животі);
- життєва підтримка — ниркова замісна терапія (гемодіаліз), штучна печінкова терапія, озонована аутогемотерапія, екстракорпоральна мембранна оксигенація (ECMO), цитосорб-терапія, одноразовий гемоперфузійний картридж HA330;
- мікробіотичне[en] (мікрофлорове) втручання — пробіотики, комбіновані порошкові пробіотики бета-глютену Newgen, промиті трансплантаційні мікробіоти, регулювання кишкової мікрофлори;
- медичні прилади — ультра короткохвильова електротерапія, інспіраторні тренування, експіраторні тренувальні апарати;
- промивання ротової порожнини — повідон-йодин, перекис водню, Німа екстракт (Azadirachta indica);
- навчання — навчання носінню маски.
Етіотропна терапія[ред. | ред. код]
Етіотропних препаратів із достовірною доказовою дією на SARS-CoV-2 не створено. У травні 2021 року група науковців з Інституту Гріффіта штату Квінсленд (Австралія) повідомили, що вони створили перший етіотропний препарат проти SARS-COV-2 зі 100 % ефективністю, проте дослідження були проведені тільки на мишах, а отже потребують перевірки ефективності на людях[220].
ВООЗ вважає, що етично запропонувати окремим пацієнтам експериментальні втручання в екстрених випадках поза клінічними випробуваннями, за умови, що не існує перевіреного ефективного лікування; неможливо негайно розпочати клінічні дослідження; пацієнт або його законний представник дав усвідомлену згоду; і невідкладне використання втручання контролюється, а результати документуються та своєчасно передаються широкій медичній і науковій спільноті[221].
У зв'язку із тим, що варіант «Дельта» Sars-CoV-2, певний час домінував у світі, спричинючи виражений із самого початку інтоксикаційний синдром із високою гарячкою через вірусемію, іноді — раптове і раннє зниження сатурації, триваліший перебіг хвороби, наразі рекомендується раннє призначення деяких противірусних препаратів[156]. Ймовірна етіотропна противірусна терапія має бути призначена якнайшвидше після встановлення діагнозу, особливо групам ризику, через що бажано їх одразу госпіталізувати.
Лопінавір / Ритонавір
Детальніші відомості з цієї теми ви можете знайти в статті Лопінавір/Ритонавір.
Ремдесивір
Через зміни в клінічному перебігу хвороби, пов'язані з широким поширенням дельта-варіанту Sars-CoV-2, вважається потрібним раннє призначення ремдесівіра, що призводить до зниження вірусного навантаження, яке від початку є дуже високим. Призначення препарату полегшує перебіг хвороби. Ремдесівір залишається найкращим препаратом наразі для цілей зменшення вірусного навантаження в хворого[156][222].
Детальніші відомості з цієї теми ви можете знайти в статті Ремдесивір.
Галідесивір
Детальніші відомості з цієї теми ви можете знайти в статті Галідесивір.
Фавіпіравір
Детальніші відомості з цієї теми ви можете знайти в статті Фавіпіравір.
Ринтатолімод
Детальніші відомості з цієї теми ви можете знайти в статті Ринтатолімод.
Хлорохін і гідроксихлорохін
Детальніші відомості з цієї теми ви можете знайти в статті Хлорохін.
Детальніші відомості з цієї теми ви можете знайти в статті Гідроксихлорохін.
Баріцитиніб
Детальніші відомості з цієї теми ви можете знайти в статті Баріцитиніб.
ВООЗ 14 січня 2022 року заявили, що препарат «настійно рекомендовано для пацієнтів із тяжким або критичним перебігом коронавірусної хвороби 2019»[223].
Азвудин
Детальніші відомості з цієї теми ви можете знайти в статті Азвудин.
Препарат азвудин закінчує III фазу клінічних випробувань у Китаї як пероральний засіб для лікування коронавірусної хвороби 2019. Частина випробувань цієї фази проходить в Бразилії та Російській Федерації. Дослідницька група університету Хенаню повідомила, що вони готові випустити його на внутрішній ринок вже у грудні 2021 року. Це препарат проти ВІЛ, який діє як інгібітор зворотної транскриптази. Він показав хорошу противірусну активність на клітинному та тваринному рівні[224].
Данопревір
Детальніші відомості з цієї теми ви можете знайти в статті Данопревір.
Арбідол
Детальніші відомості з цієї теми ви можете знайти в статті Арбідол.
Івермектин
Дослідження показали, що препарат, який було створено для лікування деяких гельмінтозів і шкірних паразитарних хвороб, зменшує у клітинних культурах розмноження SARS-CoV-2 у 5000 разів. Через це його було застосовано в лікуванні різних клінічних форм коронавірусної хвороби 2019 і введено в ряд протоколів лікування[225].
Івермектин діє шляхом інгібування ядерних транспортних білків альфа / бета-1 клітин організму, які є частиною ключового внутрішньоклітинного транспортного процесу, що використовують віруси для свого укорінення і поширення, пригнічуючи противірусну реакцію організму. Ймовірно, основа його активності в широкому спектрі дії, встановлену in vitro проти вірусів, що спричинюють гарячку денге, хворобу Зіка, ВІЛ-інфекцію та жовту гарячку[226]. Але ВООЗ рекомендувала застосування івермектину при коронавірусній хворобі 2019 тільки в межах клінічних досліджень тому, що фармакокінетичні та фармакодинамічні досліди свідчать, що досягнення плазмової концентрації, необхідної для противірусної ефективності, виявленої in vitro, потребує введення доз, що в 100 разів перевищують дози, дозволені для використання у людей. Разом з тим показано в дослідженні, що летальність була нижчою серед тих пацієнтів, які отримували івермектин, ніж серед пацієнтів групи звичайного догляду (АБО 0,27; Р = 0,03). Визначається, що користь від івермектину виявлена для пацієнтів з тяжким перебігом захворювання. Не було виявлено різниці для груп середньої тривалості перебування в лікарні або пацієнтів з механічною вентиляцією, яких успішно екстубували (36 % у групі івермектину проти 15 % у групі звичайного догляду; P = 0,07)[227].
Разом з тим було проведене подвійне сліпе, плацебо-контрольоване дослідження ескалації дози івермектину. Воно показало, що івермектин, як правило, добре переноситься при вищих за звичайні дози та частому призначенні під час лікування коронавірусної хвороби 2019[228]. В іншому дослідженні було також показано, що івермектин асоціювався з нижчою летальністю під час лікування COVID-19, особливо у пацієнтів, які потребували вищого вмісту кисню при вентиляційній підтримці[229].
Сучасні метааналізи досліджень івермектину з усього світу показують переконливу тенденцію до потужних переваг препарату проти SARS-CoV-2. Івермектин, розроблений у 1975 році, призвів до викорінення «пандемії» паразитарних хвороб на багатьох континентах і його першовідкривачі, Вільям Кемпбелл і Ōмура Сатоші здобули Нобелівську премію з фізіології або медицини у 2015 році[230]. Проте Агентство з контролю за харчовими продуктами та ліками США (Food and Drug Administration, FDA) та американське медичне товариство FLCCC (Front Line Covid-19 Critical Care Alliance) рекомендують продовжувати його використання лише у межах клінічних досліджень, адже самовільне його вживання пацієнтами у вигляді ветеринарних препаратів призвело у деяких випадках до небажаних наслідків. Його препарати для тварин сильно відрізняються від препаратів для людей. Ліки для тварин часто мають високу концентрацію і такі надмірні дози можуть бути дуже токсичними для людини[231].
Британська група по розробці рекомендацій щодо івермектину нещодавно провела ґрунтовну розробку рекомендацій по лікуванню ним з використанням стандартних керівних принципів, яких дотримується ВООЗ. Була створена технічна робоча група, яка зробила систематичний огляд і метааналіз. Вона прийшла до висновку, що достовірні докази впливу івермектину на виживання є переконливими, і рекомендувала беззастережно прийняти його для використання в профілактиці та лікуванні коронавірусної хвороби 2019[232].
Нітазоксанід
Саліциланіліди
Дослідження показали, що один з саліциналідів[233] під номером 11 показав у дослідженнях на мишах як високу протикоронавірусну активність, яка проявляється всередині вірусу, що здатне реалізуватися проти усіх варіантів SARS-CoV-2. так і протизапальні властивості, знижуючи рівень інтерлейкіну-6[234].
Плітідепсин
Повідомлено, що препарат плітідепсин (аплідин), який має обмежене клінічне схвалення, володіє противірусною активністю (IC90 = 0,88 нМ) у 27,5 разів потужнішим, ніж ремдесивір проти SARS-CoV-2 in vitro, з обмеженою токсичністю в культурі клітин. Він є представником класу сполук, відомим як дидемніни. Противірусна активність плітидепсину щодо SARS-CoV-2 опосередковується через інгібування відомого цільового eEF1A, що є ключовим для розмноження та поширення коронавірусу. Продемонстровано ефективність лікування плітідепсином in vivo на двох моделях мишей з інфекцією SARS-CoV-2 із зменшенням реплікації коронавірусу в легенях на два порядки за допомогою цього профілактичного лікування. Результати вказують на те, що плітідепсин є перспективним терапевтичним кандидатом для противірусної терапії коронавірусної хвороби 2019[235]
Молнупіравір
Головний медичний радник Білого дому, доктор Ентоні Фаучі заявив, що Управління з питань харчових продуктів та медикаментів США якомога швидко перегляне дані про новий препарат проти коронавірусної хвороби 2019 компанії «Merck and Ridgeback Biotherapeutics» для видачі можливого дозволу на екстрене використання. Компанія заявили, що їх пероральний противірусний препарат молнупіравір (MK-4482, EIDD-2801, торгова назва Лагевріо[236]) зменшив ризик госпіталізації або смерті невакцинованих пацієнтів із легким або помірним клінічним перебігом хвороби приблизно на 50 %. У третій фазі клінічного дослідження MOVe-OUT, в якому брали участь 775 учасників, які приймали або молнупіравір або плацебо, вісім осіб, які отримували плацебо, померли протягом 29 днів. Ніхто з учасників, які приймали молнупіравір, не помер. Ці дані були оприлюднені у пресрелізі компанії і поки що не підтверджені незалежними рецензіями. США погодилися придбати 1,7 млн курсів препарату. Заявлено, що уряд США має можливість придбати ще більші дози, якщо препарат буде схвалений[237]. Молнупіравір показав зниження ризику госпіталізації та/або смерті в усіх ключових підгрупах; на ефективність не впливали терміни появи симптомів або основний фактор ризику. Крім того, виходячи з доступних даних секвенування вірусів (приблизно у 40 % учасників), препарат продемонстрував постійну ефективність щодо варіантів SARS-CoV-2 «Гамма», «Дельта» та «Мю». «Merck and Ridgeback Biotherapeutics» очікує виготовити 10 мільйонів курсів лікування до кінця 2021 року, а більше доз очікується в 2022 році.[238]. Велика Британія першою у світі схвалила цей препарат для лікування коронавірусної хвороби 2019. Клінічні випробування довели, що він приблизно вдвічі знижує ризик госпіталізації та смерті при цій хворобі. Ліки схвалило британське Агентство з контролю за лікарськими засобами та виробами медичного призначення (MHRA). Уряд країни вже замовив 480 тис. курсів препарату, які мають надійти до кінця 2021 року.[239]. «Merck» підписала угоду, що дозволить виробляти та продавати молнупіравір у вигляді дженериків[240].
Паксловід
Американська компанія «Pfizer» заявила, що створений її фахівцями препарат паксловід, якій діє проти SARS-CoV-2, при коронавірусній хворобі 2019 знижує на 89 % ризик смерті й госпіталізації серед дорослих пацієнтів із категорій ризику. Він діє як інгібітор протеази 3CL, що блокує фермент, необхідний цьому коронавірусу для розмноження. Представник «Pfizer» заявив, що компанія достроково припинила клінічні випробування препарату, оскільки початкові результати вже були дуже позитивні. Заявлено, що компанія подає результати проміжних випробувань свого препарату до регуляторного органу з питань лікарських засобів у США Агентства з контролю за харчовими продуктами та ліками (Food and Drug Administration, FDA) задля отримання дозволу на екстрене використання. Уряд Великої Британії замовив 230 тисяч доз цього препарату[241]. Паксловід (PF-07321332; ritonavir) на основі проміжного аналізу фази 2/3 EPIC-HR (оцінка інгібування протеази для коронавірусної хвороби 2019 у пацієнтів високого ризику) рандомізованого подвійного сліпого дослідження негоспіталізованих дорослих пацієнтів, які мають високий ризик переходу хвороби у тяжку форму, показав гарний результат — до 28 дня не було зареєстровано жодної смерті у групі пацієнтів, які отримували PAXLOVID™, порівняно з 10 смертями у групі пацієнтів, які отримували плацебо. Статистична значущість цих результатів була високою (p<0,0001). Одночасне застосування з низькою дозою ритонавіру допомагає уповільнити метаболізм або розпад PF-07321332 (ці 2 компоненти й складають препарат PAXLOVID™), щоб він залишався активним в організмі упродовж тривалішого періоду часу у вищих концентраціях, щоб допомогти боротися з вірусом[242]. «Pfizer» підписала угоду, що дозволить виробляти та продавати цей свій препарат у 95 бідніших країнах, куди ввійде й Україна, як держава із нижчими за середній світовий рівень доходами[240].
Етіотропне лікування супутніх станів і коінфекцій
Рекомендовано призначення впродовж першої години після надходження пацієнта за наявності ознак сепсису емпіричного лікування проти ймовірних збудників, що могли стати причиною розвитку його. Також за підозри на зараження вірусом грипу, ця емпірична терапія повинна включати інгібітори нейрамінідази, що мають активність проти вірусу грипу: озельтамівіру фосфат, занамівір, перамівір і балоксавіру марбоксил.
Патогенетична терапія[ред. | ред. код]
Протизапальна терапія при настанні імунопатологічної фази коронавірусної хвороби 2019 має призначатися поступово, проте в разі відсутності ефекту або ж погіршення стану у тяжких хворих роздуми про корекцію лікування не мають тривати більше 24-48 годин.
За наявності помірної гарячки доцільно її не зменшувати через нестійкість коронавірусу до підвищеної температури тіла. У разі поганої переносимості гарячки або її надмірності (збільшення температури тіла вище 40 °C, погане індивідуальне самопочуття навіть при нижчих цифрах) бажано у помірних дозах вживати жарознижувальні засоби (щоб температура тіла не падала нижче 38 °C) перевагу надаючи парацетамолу. Його слід приймати не більше 1 г на прийом і не більше 3 г на добу. Слід уникати використання високих доз ібупрофену (≥2,4 г на добу) у хворих з неконтрольованою артеріальною гіпертензією, застійною серцевою недостатністю, ішемічною хворобою серця, захворюванням периферичних артерій та / чи судинними захворюваннями центральної нервової системи.
Інгібітори інтерлейкіну-6 (IL-6) можуть полегшити тяжке ураження легеневої тканини, яке спричинює вивільнення цитокінів у пацієнтів з тяжкими проявами коронавірусної хвороби 2019. 6 липня 2021 року видано рекомендації ВООЗ про застосовування антагоністів інтерлейкіну-6 пацієнтам із тяжким чи критичним перебігом коронавірусної хвороби 2019 разом із кортикостероїдами. Дослідження, скоординовані ВООЗ в партнерстві з Королівським і Університетським коледжами Лондона, Брістольською університетом і Фондом охорони здоров'я Гая і Сент-Томаса, показало, що введення інгібіторів інтерлейкіну-6, а також кортикостероїдів знижує ризик смерті на 17 % в порівнянні з використанням тільки кортикостероїдів, а ризик штучної вентиляції легень (ШВЛ) знижується на 21 %[243][244].
Сарілумаб
Детальніші відомості з цієї теми ви можете знайти в статті Сарілумаб.
Тоцилізумаб
Детальніші відомості з цієї теми ви можете знайти в статті Тоцилізумаб.
Сотровірімаб / Сотровімаб
Детальніші відомості з цієї теми ви можете знайти в статті Сотровірімаб.
14 січня 2022 року ВООЗ заявило, що цей препарат «умовно рекомендований для лікування легкого або середнього ступеня тяжкості коронавірусної хвороби 2019 у пацієнтів, які мають високий ризик госпіталізації»[223].
Маврілімумаб
Детальніші відомості з цієї теми ви можете знайти в статті Маврілімумаб.
Екулізумаб
Детальніші відомості з цієї теми ви можете знайти в статті Екулізумаб.
Регданвімаб
Детальніші відомості з цієї теми ви можете знайти в статті Регданвімаб.
Інші препарати та комбінації моноклональних антитіл
- Бамланівімаб і етесевімаб. У лютому 2021 року Агентство з контролю за харчовими продуктами та ліками США (Food and Drug Administration, FDA) видало дозвіл на екстрене застосування комбінації моноклональних антитіл — бамланівімаба і етесевімаба для лікування дорослих і дітей з легким і середньотяжким клінічним перебігом коронавірусної хвороби 2019, підтвердженої позитивним результатом ПЛР і ризиком тяжкого перебігу захворювання. Комбінація може вводитися лише в тих медичних закладах, в яких можливе лікування тяжкої інфузійної реакції, як то анафілаксії, за необхідності. У клінічних дослідженнях одноразова внутрішньовенна інфузія бамланівімаба і етесевімаба значно знизила кількість госпіталізацій і смертей упродовж 29 днів спостереження, в порівнянні з плацебо. Безпека і ефективність цієї експериментальної терапії для лікування коронавірусної хвороби продовжує оцінюватися. Бамланівімаб і етесевімаб зв'язуються з різними сайтами S — білка збудника. Моноклональні антитіла не дозволені для пацієнтів, які потребують кисневої підтримки, через те, що вони можуть бути пов'язані з гіршими клінічними результатами[245][246]. 25 червня 2021 року Управління з продовольства і медикаментів (FDA) відізвало рекомендацію застосування цих препаратів для лікування коронавірусної хвороби 2019 в США. До цього їх було дозволено для лікування хворих із середньотяжким перебігом, у яких прогнозувалось погіршення стану. У США наразі циркулюють варіанти Sars-Cov-2, що викликають занепокоєння, а ці препарати, що вводяться разом, не дозволені до застосування у штатах і на територіях, що підлягають юрисдикції США, і в яких останнім часом виявлена стійкість до цих ліків, що перевищує 5 %. Про що і йдеться у рекомендаціях з лікування коронавірусної хвороби 2019, виданих Управлінням з продовольства і медикаментів[247]. Хоча 25 червня 2021 року розповсюдження бамланівімабу плюс етесевімабу в США було призупинено через збільшення загальної частоти двох варіантів SARS-CoV-2, що викликають занепокоєння та циркулюють по всій країні: гамма і бета-варіанти. В останні місяці дельта-варіант став переважним, що циркулює у всіх штатах. Оскільки комбінація бамланівімабу плюс етесевімабу зберігає активність проти дельта-варіанта, який має мутації L452R та T478K. Продемонстровано, що сприйнятливість до бамланівімабу плюс етесевімабу зберігається в лабораторних дослідженнях. Тому станом на 2 вересня 2021 року використання та розповсюдження цих моноклональних антитіл проти SARS-CoV-2 було відновлено у всіх штатах і територіях юрисдикції США. У лабораторних дослідженнях цей варіант також виявився сприйнятливим до касирівімабу разом з імдевімабом і до сотровімабу, тому ці моноклональні антитіла продовжують також рекомендуватися для лікування хворих із середньотяжким перебігом, у яких прогнозується погіршення стану. Оскільки циркулюючі резистентні варіанти SARS-CoV-2 швидко змінюються, використання та розповсюдження бамланівімабу плюс етесевімабу або інших моноклональних антитіл може бути обмежене в районах із підвищеною частотою циркуляції варіантів, що помітно знизили сприйнятливість in vitro до цього режиму[248].
- Касиривімаб та імдевімаб. У лютому 2021 року Агентство з контролю за харчовими продуктами та ліками США (Food and Drug Administration, FDA) видало дозвіл на екстрене застосування комбінації моноклональних антитіл — касиривімаба та імдевімаба для лікування дорослих і дітей з легким і середньотяжким клінічним перебігом коронавірусної хвороби 2019, підтвердженої позитивним результатом ПЛР і ризиком тяжкого перебігу захворювання. Комбінація може вводитися лише в тих медичних закладах, в яких можливе лікування тяжкої інфузійної реакції, як то анафілаксії, за необхідності. Дозування для дорослих та педіатричних пацієнтів (віком від 12 років і старше, вагою не менше 40 кг) становить 1200 мг касиривімабу та 1200 мг імдевімабу. Їх вводять разом по одному внутрішньовенно впродовж щонайменше 60 хвилин. Їх слід вводити разом одразу після отримання позитивних результатів безпосереднього вірусного тестування та впродовж 10 днів після появи клінічних проявів. Безпека касиривімабу та імдевімабу заснована на аналізі спостереження 799 амбулаторних хворих у R10933-10987-COV-2067, рандомізованому, подвійному сліпому, плацебо-контрольоване клінічному дослідженні серед амбулаторних дорослих пацієнтів з легкими та середньотяжкими проявами коронавірусної хвороби 2019. Показано, що у клітинах культури Vero E6, препарати нейтралізували SARS-CoV-2 (ізолят USA-WA1 / 2020) зі значеннями 0,006 мкг / мл і 0,005 мкг / мл відповідно. Антитілозалежна клітинно-опосередкована цитотоксичність та антитілозалежний клітинний фагоцитоз оцінювалися за допомогою клітин-мішеней Jurkat, що експресують білок SARS-CoV-2. Комбінація касиривімабу та імдевімабу опосередковувала цитотоксичність з ефекторними клітинами природних кілерів людини[249].
- Продовжується дослідження інших моноклональних антитіл. Виявлено, що моноклональне антитіло SARS2-38 націлене на ту частину S-білка коронавірусу, яка мало змінюється внаслідок мутацій, і на яку не діють інші антитіла. Тому воно може працювати проти найпоширеніших сьогодні варіантів SARS-CoV-2[250].
3 вересня 2021 року Колегія з рекомендацій щодо лікування коронавірусної хвороби 2019 рекомендувала використовувати моноклональні антитіла проти SARS-CoV-2 для лікування легкого та середньотяжкого клінічного перебігу хвороби та для постконтактної профілактики інфекції SARS-CoV-2 у осіб, які мають високий ризик прогресування до тяжкого перебігу. Колегія запропонувала надання пріоритету лікуванню хвороби над постконтактною профілактикою. Пріоритет перед вакцинованими особами, які, як очікується, мають адекватну імунну відповідь має належати невакцинованим або частково вакцинованим особам, які мають високий ризик розвитку тяжкого перебігу хвороби; вакцинованим особам, від яких не очікується адекватної імунної відповіді (як то особи з ослабленим імунітетом)[251].
Показано у проведеному дослідженні, що введення в домашніх умовах громадськими інтегрованими парамедиками препаратів моноклональних антитіл створило важливу основу пацієнтам з високим ризиком прогресування коронавірусної хвороби 2019 для запобігання від звернення до департаменту невідкладної допомоги та потреби госпіталізації[252].
Очищення крові від надмірної кількості цитокінів та інших медіаторів запалення[ред. | ред. код]
Агентство з контролю за харчовими продуктами та ліками США (Food and Drug Administration, FDA) видало дозвіл на екстрене використання пристрою очищення крові для лікування пацієнтів віком 18 років або старше з підтвердженою коронавірусною хворобою 2019, які прийняті до реанімаційного відділення з підтвердженою або неминучою дихальною недостатністю. Дозволений пристрій працює за рахунок зменшення кількості цитокінів та інших медіаторів запалення, які контролюють імунну відповідь, шляхом фільтрації крові та повернення відфільтрованої крові пацієнту[253].
Аскорбінова кислота (вітамін C)[ред. | ред. код]
Детальніші відомості з цієї теми ви можете знайти в статті Вітамін C.
Кверцетин[ред. | ред. код]
Детальніші відомості з цієї теми ви можете знайти в статті Кверцетин.
Оксид азоту[ред. | ред. код]
Детальніші відомості з цієї теми ви можете знайти в статті Оксид азоту.
Колхіцин[ред. | ред. код]
Детальніші відомості з цієї теми ви можете знайти в статті Колхіцин.
Внутрішньовенна дезінтоксикаційна терапія[ред. | ред. код]
Проводиться з обережністю у пацієнтів з тяжкою пневмонією без ознак шоку, тому що агресивне внутрішньовенне введення розчинів може погіршити оксигенацію, особливо в умовах обмеженої можливості проведення штучної вентиляції легень.
Ставлення до глюкокортикостероїдів[ред. | ред. код]
Глюкокортикостероїди збільшують тривалість перебування вірусів в організмі, таким чином затримуючи терміни запалення. Їхня здатність пригнічувати імунітет призводить до зниження захисних властивостей та поширення вірусів по органах в організмі. Дослідження застосування глюкокортикостероїдів у лікуванні грипу, респіраторно-синцитіальної інфекції, близькосхідного коронавірусного респіраторного і тяжкого гострого респіраторного синдрому показали підвищення ризиків смерті серед осіб, які їх отримували, збільшення тривалості перебування у відділенні інтенсивної терапії, а також ризиків виникнення вторинних бактеріальних чи грибкових інфекцій. Виявлено маніфестацію цукрового діабету та аваскулярного некрозу як ускладнень терапії глюкокортикостероїдами[254].

Проте 16 червня 2020 року представник проведених у Великій Британії рандомізованих досліджень у хворих на коронавірусну хворобу 2019 поінформував у пресрелізі, що отримано попередні результати, які свідчать, що препарат дексаметазон може врятувати життя пацієнтам, які критично хворіють. Для пацієнтів, що під'єднані до ШВЛ, таке лікування зменшило летальність приблизно на третину, а для пацієнтів, які потребують лише неінвазивної кисневої підтримки, летальність була скорочена приблизно на одну п'яту. Користь спостерігалася лише у пацієнтів, які тяжко хворіли на COVID-19, і не спостерігалася у пацієнтів із легшими клінічними формами. ВООЗ привітала результати клінічних випробувань і чекатиме повного аналізу даних, в тому числі, отримання позитивних рецензій на це дослідження[255].
Дослідження американських науковців з Нью-Йорка стосовно дії глюкокортикостероїдів при коронавірусній хворобі 2019 показало, що їх результати корелюють з британським дослідженням RECOVERY, і свідчать про те, що для оптимального застосування цих препаратів потрібний відбір хворих за певними клінічними і лабораторними показниками. Зокрема показано, що терапія ними в перші 7 днів хвороби неефективна у всіх групах хворих і не призводить до якого-небудь позитивного ефекту, бо вони здатні придушити власний захист організму в період активного розмноження SARS-CoV-2 і нанести, тим самим, шкоди в перший тиждень хвороби. Якщо в дебюті захворювання їх призначати, це надає вірусу можливості необмеженої реплікації, а при Дельта і Омікрон варіантах вірусне навантаження в сотні разів вище за таке у попередніх варіантів. Усі подальші ураження є індукованими великою кількістю SARS-CoV-2.
Отримані дані, що тест на С-реактивний білок може допомогти лікарям ухвалити рішення про призначення глюкокортикоїдних гормонів. Якщо у пацієнта цей білок підвищувався до ≥200 мг / л, то застосування цих гормонів (як то метилпреднізолон, преднізолон, дексаметазон) показало зменшення на 77 % ризику потрапляння на ШВЛ чи смерті. Тоді як рівень С-реактивного білку сягав ≤100 мг / л, то ризик потрапити на ШВЛ чи померти збільшувався майже втричі при застосуванні цих гормонів. Зроблено також висновок, що небажано використовувати глюкокортикоїди в ранній фазі хвороби, тому що це може привести до несподіваних результатів: затримки коронавірусу в організмі, бактеріальної чи грибкової суперінфекції[256]. Дослідження RECOVERY проводиться з березня 2020 року, 6 липня припинено набір хворих, оскільки кількість залучених склало близько 6000 осіб, дані вивчені у 94 % пацієнтів у 175 лікувальних закладах. Воно показало, що всі пацієнти на будь-якій респіраторній підтримці потребують призначення дексаметазону, і він істотно знижує ризик смерті. Але у пацієнтів без респіраторної підтримки це дослідження не показало ніяких переваг застосування дексаметазону. Виявлено, що призначення дексаметазону краще допомагає чоловікам і особам віком менше 70 років. Найбільший ефект отримано у пацієнтів, в яких або не було цукрового діабету або був, але з невисокими рівнями глюкози крові ≤7,8 ммоль / л. Альтернативним предиктором призначення дексаметазону може служити рівень D-димеру >3 мкг / мл чи тропонінів >0,1 нг / мл[257]. Рандомізоване дослідження показало, що найкращою дозою є 6 мг дексаметазону на добу, у порівнянні з цією дозою призначення 12 мг дексаметазону статистично не зменшило кількість днів життя без надання життєвої підтримки упродовж 28 днів[258].
Станом на 2021 рік вважається, що «це реагуюча на глюкокортикостероїди хвороба. При цьому час призначення є критичним. Занадто рано не можна, проте й не занадто пізно»[189].
Інгібітори ангіотензин-перетворюючого ферменту і блокатори ангіотензинових рецепторів 1-го типу[ред. | ред. код]
Наразі не виявлено передумов для збільшення ураження легенів SARS-CoV-2 на тлі вживання препаратів для лікування серцево-судинних захворювань — інгібіторів ангіотензин-перетворюючого ферменту і блокаторів ангіотензинових рецепторів 1-го типу. Від застосування цих препаратів для лікування есенціальної гіпертензії в передбаченні гіпотетичного зараження SARS-CoV-2 не слід відмовлятися, як і непотрібно починати їх приймати без наявності показань з боку серцево-судинної системи задля можливої, але непідтвердженої, профілактичної дії для розвитку тяжких уражень легень під час коронавірусної хвороби 2019[259]. Застосування блокаторів ангіотензинових рецепторів 1-го типу (сартанів) і, меншою мірою, інгібіторів ангіотензин-перетворюючого ферменту збільшує вміст ангіотензину 2 в крові, і він починає зв'язуватися з більшою кількістю АТ-2 рецепторів. Як наслідок, доступність цих рецепторів для SARS-CoV-2 теоретично може зменшуватися[260]. Одночасно сартани можуть блокувати надмірну активацію АТ-1 рецепторів, яка, ймовірно, відбувається в умовах хвороби і є шкідливою для організму. Блокатори ангіотензинових рецепторів 1-го типу збільшують кількість ангіотензин-перетворюючого ферменту 2-го типу, що розщеплює ангіотензин-2 з утворенням ангіотензину 1-7. Останній здатен розширювати й легеневі судини. Оскільки одним із механізмів гострого ушкодження легень є зв'язування SARS-CoV-2 з ангіотензин-перетворюючим ферментом 2-го типу зі зменшенням утворення ангіотензину 1-7, терапія


 French
French Deutsch
Deutsch