ICAM2 , a enciclopedia libre
A molécula de adhesión intercelular 2 (ICAM-2), tamén coñecida como CD102 (Cluster de Diferenciación 102), é unha proteína codificada no xene humano do cromosoma 17 ICAM2.
| ICAM2 | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Símbolos | ICAM2 (HGNC: 5345) ICAM2, CD102 | ||
| Identificadores externos | |||
| Locus | Cr. 17 q23.2 | ||
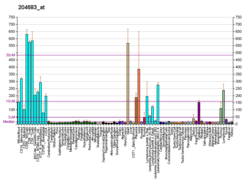
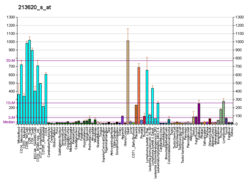
| Padrón de expresión de ARNm | |||
 | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
Estrutura das proteínas
editarA proteína codificada polo xene ICAM2 é membro da familia da molécula de adhesión intercelular (ICAM). Todas as proteínas ICAM son glicoproteínas transmembrana tipo I, conteñen 2–9 dominios similares a inmunoglobulina de tipo C2, e únense á proteína de adhesión de leucocito LFA-1.
Funcións das proteínas
editarAs moléculas ICAM2 regulan a adhesión das espermátidas ás células de Sertoli no lado apical da barreira hematotesticular (cara ao lume), e exercen un papel importante na espermatoxénese.[1]
Esta proteína pode tamén xogar un papel na recirculación de linfocitos ao bloquear a adhesión celular dependente de LFA-1. É mediadora en interaccións adhesivas importantes para a resposta inmunitaria específica de antíxeno, eliminación mediada por célula NK, recirculación de linfocitos e outras interaccións celulares importantes para a resposta inmunitaria e a vixilancia.[2]
Interaccións
editarICAM2 interacciona coa EZR.[3] Tamén se une a P9 (Uniprot: B2UM07), unha proteína segregada pola bacteria do intestino humano Akkermansia muciniphila.[4]
Notas
editar- ↑ Xiao X, Mruk DD, Cheng CY (2013). "Intercellular adhesion molecules (ICAMs) and spermatogenesis". Human Reproduction Update 19 (2): 167–86. PMC 3576004. PMID 23287428. doi:10.1093/humupd/dms049.
- ↑ "Entrez Gene: ICAM2 intercellular adhesion molecule 2".
- ↑ Heiska L, Alfthan K, Grönholm M, Vilja P, Vaheri A, Carpén O (agosto de 1998). "Association of ezrin with intercellular adhesion molecule-1 and -2 (ICAM-1 and ICAM-2). Regulation by phosphatidylinositol 4, 5-bisphosphate". The Journal of Biological Chemistry 273 (34): 21893–900. PMID 9705328. doi:10.1074/jbc.273.34.21893.
- ↑ Yoon HS, Cho CH, Yun MS, Jang SJ, You HJ, Kim JH, Han D, Cha KH, Moon SH, Lee K, Kim YJ, Lee SJ, Nam TW, Ko G (maio de 2021). "Akkermansia muciniphila secretes a glucagon-like peptide-1-inducing protein that improves glucose homeostasis and ameliorates metabolic disease in mice". Nature Microbiology 6 (5): 563–573. PMID 33820962. doi:10.1038/s41564-021-00880-5.
Véxase tamén
editarOutros artigos
editarBibliografía
editar- Simmons DL (1995). "The role of ICAM expression in immunity and disease". Cancer Surveys 24: 141–55. PMID 7553659.
- Hayflick JS, Kilgannon P, Gallatin WM (1998). "The intercellular adhesion molecule (ICAM) family of proteins. New members and novel functions". Immunologic Research 17 (3): 313–27. PMID 9638475. doi:10.1007/BF02786454.
- Lalor PF, Shields P, Grant A, Adams DH (febreiro de 2002). "Recruitment of lymphocytes to the human liver". Immunology and Cell Biology 80 (1): 52–64. PMID 11869363. doi:10.1046/j.1440-1711.2002.01062.x.
- Yonekawa K, Harlan JM (febreiro de 2005). "Targeting leukocyte integrins in human diseases". Journal of Leukocyte Biology 77 (2): 129–40. PMID 15548573. doi:10.1189/jlb.0804460.
- de Fougerolles AR, Stacker SA, Schwarting R, Springer TA (xullo de 1991). "Characterization of ICAM-2 and evidence for a third counter-receptor for LFA-1". The Journal of Experimental Medicine 174 (1): 253–67. PMC 2118873. PMID 1676048. doi:10.1084/jem.174.1.253.
- Sansom D, Borrow J, Solomon E, Trowsdale J (outubro de 1991). "The human ICAM2 gene maps to 17q23-25". Genomics 11 (2): 462–4. PMID 1769660. doi:10.1016/0888-7543(91)90157-A.
- Staunton DE, Dustin ML, Springer TA (maio de 1989). "Functional cloning of ICAM-2, a cell adhesion ligand for LFA-1 homologous to ICAM-1". Nature 339 (6219): 61–4. Bibcode:1989Natur.339...61S. PMID 2497351. doi:10.1038/339061a0.
- Bujía J, Holly A, Kim C, Scanady N, Kastenbauer E (1994). "Expression of human intercellular adhesion molecules in middle ear cholesteatoma". American Journal of Otolaryngology 15 (4): 271–5. PMID 7526720. doi:10.1016/0196-0709(94)90094-9.
- de Fougerolles AR, Qin X, Springer TA (febreiro de 1994). "Characterization of the function of intercellular adhesion molecule (ICAM)-3 and comparison with ICAM-1 and ICAM-2 in immune responses". The Journal of Experimental Medicine 179 (2): 619–29. PMC 2191386. PMID 7905020. doi:10.1084/jem.179.2.619.
- Butini L, De Fougerolles AR, Vaccarezza M, Graziosi C, Cohen DI, Montroni M, Springer TA, Pantaleo G, Fauci AS (setembro de 1994). "Intercellular adhesion molecules (ICAM)-1 ICAM-2 and ICAM-3 function as counter-receptors for lymphocyte function-associated molecule 1 in human immunodeficiency virus-mediated syncytia formation". European Journal of Immunology 24 (9): 2191–5. PMID 7916296. doi:10.1002/eji.1830240939.
- Maruyama K, Sugano S (xaneiro de 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene 138 (1–2): 171–4. PMID 8125298. doi:10.1016/0378-1119(94)90802-8.
- Hirao M, Sato N, Kondo T, Yonemura S, Monden M, Sasaki T, Takai Y, Tsukita S, Tsukita S (outubro de 1996). "Regulation mechanism of ERM (ezrin/radixin/moesin) protein/plasma membrane association: possible involvement of phosphatidylinositol turnover and Rho-dependent signaling pathway". The Journal of Cell Biology 135 (1): 37–51. PMC 2121020. PMID 8858161. doi:10.1083/jcb.135.1.37.
- Bernstein CN, Sargent M, Gallatin WM, Wilkins J (outubro de 1996). "Beta 2-integrin/intercellular adhesion molecule (ICAM) expression in the normal human intestine". Clinical and Experimental Immunology 106 (1): 160–9. PMID 8870715.
- Bonaldo MF, Lennon G, Soares MB (setembro de 1996). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Research 6 (9): 791–806. PMID 8889548. doi:10.1101/gr.6.9.791.
- Casasnovas JM, Springer TA, Liu JH, Harrison SC, Wang JH (maio de 1997). "Crystal structure of ICAM-2 reveals a distinctive integrin recognition surface". Nature 387 (6630): 312–5. Bibcode:1997Natur.387..312C. PMID 9153399. doi:10.1038/387312a0.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (outubro de 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene 200 (1–2): 149–56. PMID 9373149. doi:10.1016/S0378-1119(97)00411-3.
- Sainio M, Zhao F, Heiska L, Turunen O, den Bakker M, Zwarthoff E, Lutchman M, Rouleau GA, Jääskeläinen J, Vaheri A, Carpén O (setembro de 1997). "Neurofibromatosis 2 tumor suppressor protein colocalizes with ezrin and CD44 and associates with actin-containing cytoskeleton". Journal of Cell Science. 110 110 (18): 2249–60. PMID 9378774. doi:10.1242/jcs.110.18.2249.
- Yonemura S, Hirao M, Doi Y, Takahashi N, Kondo T, Tsukita S, Tsukita S (febreiro de 1998). "Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2". The Journal of Cell Biology 140 (4): 885–95. PMC 2141743. PMID 9472040. doi:10.1083/jcb.140.4.885.
- Bernstein CN, Sargent M, Gallatin WM (febreiro de 1998). "Beta2 integrin/ICAM expression in Crohn's disease". Clinical Immunology and Immunopathology 86 (2): 147–60. PMID 9473377. doi:10.1006/clin.1997.4462.
Ligazóns externas
editar- ICAM2 protein, human Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- PDBe-KB proporciona un resumo da información de todas as estruturas dispoñibles en PDB para a molécula de adhesión intercellar humana 2 (ICAM2)


 French
French Deutsch
Deutsch