Cistina
| Cistina | |
|---|---|
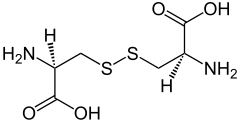 | |
| Nome IUPAC | |
| acido (2R,7R)-3,3'-ditiobis(2-amminopropanoico) | |
| Nomi alternativi | |
| L-(–)-Cistina (2S,7S)-(–)-Cistine Dicisteina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H12N2O4S2 |
| Massa molecolare (u) | 240,29 |
| Aspetto | Solido cristallino bianco |
| Numero CAS | |
| Numero EINECS | 200-296-3 |
| PubChem | 67678 |
| DrugBank | DB00138 |
| SMILES | C(C(C(=O)O)N)SSCC(C(=O)O)N |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 112 mg/L |
| Temperatura di fusione | 260-261 °C (533,15-534,15 K) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
La cistina è un amminoacido solforato caratterizzato da formula molecolare C6H12N2O4S2 e ottenuto per reazione ossidativa di due molecole di cisteina. Si presenta come un solido incolore con punto di fusione 260-261 °C. Fu scoperta nel 1810 da William Hyde Wollaston ma fu riconosciuta come un componente delle proteine solamente quando venne isolata dalle corna di una vacca, nel 1899.
La cistina è presente in molte proteine e ne influenza significativamente la struttura terziaria. La cistina è anche parzialmente responsabile della formazione di una matrice di glutine nel pane, insieme all'instaurarsi di legami a idrogeno e interazioni idrofobiche. Questo amminoacido è significativamente presente nei peli umani, in particolare è responsabile della forma ondulata dei capelli, ondulazione dovuta alla formazione dei caratteristici ponti disolfuro (-S-S-).
Importanza alimentare[modifica | modifica wikitesto]
La cistina viene utilizzata dall'organismo quale fonte di cisteina necessaria per la biosintesi del glutatione, insieme col glutammato e con la glicina. In particolare, la cistina è ritenuta la forma molecolare preferita dalle cellule del sistema immunitario, inclusi macrofagi e astrociti. I linfociti e i neuroni preferiscono invece utilizzare direttamente la cisteina per effettuare la sintesi del glutatione.
Fonti nutrizionali[modifica | modifica wikitesto]
I supplementi dietetici di N-acetilcisteina sono una fonte di cistina, ma le dosi sono limitate dagli effetti collaterali. Una delle fonti più ricche di cistina è rappresentata dalle proteine non denaturate del siero di latte. La cistina non viene digerita o idrolizzata in modo significativo nello stomaco, ma viene trasportata dal flusso sanguigno nei vari distretti cellulari dell'organismo. Qui il debole legame disolfuro viene scisso producendo la cisteina, che viene resa disponibile per la sintesi del glutatione.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 26.01.2011
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su cistina
Wikimedia Commons contiene immagini o altri file su cistina


 French
French Deutsch
Deutsch