Requin balestrine — Wikipédia
Carcharhinus amboinensis
Le Requin balestrine (Carcharhinus amboinensis) est une espèce peu courante de requins tropicaux de la famille des Carcharhinidae, que l'on trouve dans les eaux chaudes de l'est de l'océan Atlantique et de l'ouest des océans Indien et Pacifique. Il préfère les eaux troubles et peu profondes, avec un fond sableux. Avec son corps trapu et gris, ses petits yeux et son museau court et émoussé, le Requin balestrine ressemble beaucoup au Requin bouledogue (C. leucas), mieux connu, avec lequel il est souvent confondu. Les deux espèces diffèrent quant au nombre de leurs vertèbres, à la taille relative de leurs nageoires dorsales et à quelques autres traits plus difficilement perceptibles. Ce requin atteint généralement une longueur comprise entre 1,9 et 2,5 m.
Le Requin balestrine est un superprédateur qui chasse bas dans la colonne d'eau. Il a une alimentation variée, composée principalement de poissons osseux et cartilagineux, mais aussi de crustacés, de mollusques, de serpents de mer et de cétacés. Cette espèce est vivipare, les embryons se développent dans le ventre de leur mère, reliés au placenta, et naissent formés. Trois à treize petits naissent après une gestation de neuf à douze mois. Les jeunes requins passent les premières années de leur vie dans des habitats côtiers abrités comme les baies, où leurs déplacements varient suivant les marées et les saisons. La grande taille et la forte dentition du Requin balestrine le rendent dangereux, même si aucune attaque sur l'Homme n'a été recensée. Il est quelquefois attrapé par des pêcheurs, qui commercialisent sa chair et ses ailerons, ou encore, dans les filets utilisés pour protéger les plages. En 2012, l'Union internationale pour la conservation de la nature (UICN) manquait encore de données suffisamment précises pour évaluer le statut de conservation de cette espèce.
Description
[modifier | modifier le code]Le Requin balestrine est une espèce au corps très robuste avec un museau court, large et arrondi. Les petits yeux circulaires sont munis de membranes nictitantes. La bouche forme un grand arc et présente des sillons à peine perceptibles à chaque extrémité. Il possède entre 11 et 13 (généralement 12) rangées de dents de chaque côté de la mâchoire supérieure et entre 10 et 12 (généralement 11) rangées de dents de chaque côté de la mâchoire inférieure, en plus d'une rangée de petites dents simples au niveau des symphyses supérieures et inférieures (au milieu de la mâchoire). Les dents sont larges et triangulaires avec des bords dentelés. Celles de la mâchoire inférieure sont légèrement plus étroites, plus droites et dentelées plus finement que celles de la mâchoire supérieure. Les cinq paires de fentes branchiales sont de longueur moyenne[1],[2],[3].
La première nageoire dorsale est grande et triangulaire, avec un sommet pointu et une bordure arrière concave ; elle commence plus ou moins au niveau des insertions postérieures des nageoires pectorales. La seconde dorsale est trois fois plus petite que la première, et est implantée un peu devant la nageoire anale. Il n'y a pas de crête médiane entre les nageoires dorsales. Les longues nageoires pectorales sont larges et légèrement falciformes, devenant étroites et pointues à leur extrémité. La nageoire anale a une marge postérieure fortement entaillée. La queue présente une encoche profonde sur sa surface supérieure, à l'origine de la nageoire caudale. Cette dernière est asymétrique, avec un lobe inférieur bien développé et un lobe supérieur plus long présentant une encoche dans sa bordure postérieure près de son extrémité[1],[2],[3].
La peau est recouverte d'assez grands denticules cutanés, qui deviennent plus serrées et se chevauchent plus avec l'âge. Chaque écaille porte entre trois et cinq arêtes horizontales qui se terminent par cinq dents[1]. Ce requin est gris dessus et blanc dessous, avec une bande pâle sur les flancs. La deuxième nageoire dorsale et le lobe inférieur de la nageoire caudale s'assombrissent à leur extrémité, en particulier chez les jeunes[2]. Un individu albinos capturé dans le Queensland en 1987 constitue le premier exemple connu d'albinisme pour un requin de la famille des Carcharhinidae[4]. Un Requin balestrine adulte mesure généralement entre 1,9 et 2,5 m de long, tandis que les plus grands individus atteignent 2,8 m de long[1].
Espèces similaires
[modifier | modifier le code]Le Requin balestrine se distingue du Requin bouledogue (C. leucas) par le nombre de vertèbres précaudales (placées avant la nageoire caudale) : on en compte entre 89 et 95 chez C. amboinensis et entre 101 et 123 chez C. leucas. Du point de vue de la morphologie externe, il a une plus grande différence de taille entre ses nageoires dorsales : le rapport entre la première et la deuxième est supérieur à 3 pour 1 alors qu'il est inférieur à 3 pour 1 chez C. leucas, et l'encoche de la bordure de sa nageoire anale forme un angle aigu, alors que c'est un angle droit chez C. leucas. Sa nageoire caudale est plus verticale que chez le Requin bouledogue, et trois à quatre de ses fentes branchiales sont situées au-dessus de la nageoire pectorale, quand chez le Requin bouledogue on trouve deux branchies au-dessus de la pectorale et les trois autres plus en amont de la tête[5]. Le Requin balestrine a aussi généralement moins de rangées de dents au niveau de sa mâchoire inférieure (entre 10 et 12 de chaque côté contre de 12 ou 13 chez C. leucas)[1],[2].
Biologie et écologie
[modifier | modifier le code]Comportement
[modifier | modifier le code]Le Requin balestrine est un animal essentiellement solitaire, bien que l'on peut parfois observer plusieurs individus au même endroit[6]. Dans le canal du Mozambique, il est présent en plus grand nombre que le Requin bouledogue sur toute la côte est, alors que ce dernier est majoritaire sur la côte ouest, ce qui laisse à penser que ces deux espèces similaires suivent le principe d'exclusion réciproque[2].
Alimentation
[modifier | modifier le code]
Bien que le Requin balestrine peut capturer ses proies à n'importe quel niveau de la colonne d'eau, il préfère chasser à proximité du fond de la mer[6]. C'est un superprédateur qui se nourrit principalement de poissons téléostéens comme les Sciaenidae, les Pleuronectiformes et les Trichiuridae, et dans une moindre mesure de poissons cartilagineux, de céphalopodes et de décapodes. Il a également été observé se nourrissant de gastéropodes, de serpents de mer, de dauphins et de carcasses de baleines[2],[7]. Les autres requins et les raies sont plus communs dans le régime alimentaire des Requins balestrines d'Afrique du Sud que chez ceux des autres régions : les espèces consommées appartiennent aux Carcharhinidae, aux roussettes, aux Squatiniformes, aux Rhinobatidae, aux Myliobatiformes et aux Myliobatidae[6].
Cycle de vie
[modifier | modifier le code]Le Requin balestrine est vivipare. Comme les autres Carcharhinidae, après que l'embryon en développement a épuisé son vitellus, il est nourri via le placenta de sa mère, auquel il est raccordé par le sac vitellin vide[2]. Les femelles matures ont un seul ovaire fonctionnel et deux utérus. Le fonctionnement exact de la reproduction varie selon les régions : au large de l'Afrique du Sud, la période de gestation dure environ douze mois, et l'accouplement et la mise bas ont lieu à la fin de l'été. Les portées comportent de trois à sept petits (en moyenne cinq) et les nouveau-nés mesurent de 75 à 79 cm de long[8],[6]. Au large du nord de l'Australie, la période de gestation dure neuf mois, et les portées naissent de novembre à décembre. Elles comprennent six à treize petits (en moyenne neuf) et les nouveau-nés mesurent entre 59 et 66 cm de long[9].
Les jeunes requins peuvent être trouvés dans les environnements côtiers peu profonds comme les baies jusqu'à au moins trois ans, ce qui suggère que cette espèce utilise ces habitats protégés le temps que les requins atteignent leur taille adulte[10]. Au fur et à mesure que les requins grandissent, ils s'aventurent plus loin au large dans les eaux profondes, et ce de plus en plus souvent, jusqu'à ce qu'ils finissent par se disperser[11],[12]. Il s'agit d'une espèce à croissance lente. Les mâles grandissent plus rapidement et ont une taille adulte plus petite que les femelles. La maturité sexuelle est atteinte quand les animaux ont atteint environ 2,1 m de long et 12 ans pour les mâles, et 2,2 m de long et 13 ans pour les femelles. La durée de vie maximale est de 26 ans pour les mâles et 30 ans pour les femelles[9],[13].
Prédateurs et parasites
[modifier | modifier le code]Les parasites recensés chez le Requin balestrine comprennent la myxozoaire Kudoa carcharhini[14], les copépodes Pandarus smithii et P. cranchii[15] et les cestodes Callitetrarhynchus gracilis[16], Floriceps minacanthus[17], Heteronybelinia australis[18], Otobothrium australe, Otobothrium cysticum[19], ainsi que diverses autres espèces des genres Cathetocephalus[20] et Protogrillotia[16]. Les jeunes Requins balestrines peuvent être la proie des grands requins. La mortalité naturelle des jeunes en baie de Cleveland a été évaluée à plus de 5 % par an, ce taux est comparable à celui des jeunes Requins bouledogue, et est beaucoup plus faible que celui des jeunes Requins bordés (C. limbatus) ou Requins-citron (Negaprion brevirostris)[21].
Distribution et habitat
[modifier | modifier le code]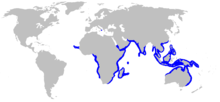
Bien que largement répandu dans les eaux tropicales et subtropicales de l'Eurasie, l'Afrique et l'Océanie, le Requin balestrine n'est nulle part très commun. Les observations de ce requin sont dispatchées, et l'étendue de son aire de répartition est peut-être faussée par sa confusion avec le Requin bouledogue[8]. Dans l'Atlantique Est, on le trouve au large du Cap-Vert et du Sénégal, et du Nigeria à la Namibie[1]. Il a été identifié une fois en Méditerranée au large de Crotone, en Italie[22]. Il vit le long des côtes continentales autour de l'océan Indien, de l'Est de l'Afrique du Sud à l'Asie du Sud-Est, et au nord de l'Australie, en passant par la péninsule Arabique (y compris Madagascar, les Seychelles et l'île Maurice). On le rencontre également dans l'océan Pacifique, des Philippines jusqu'au sud de la Chine au nord, et jusqu'en Nouvelle-Guinée et les îles de la Micronésie à l'est[1]. Les marquages d'animaux et les études génétiques indiquent que les Requins balestrines, en particulier les jeunes, ne sont pas fortement migrateurs et ont tendance à rester dans une région. La plus longue distance enregistrée couverte par un adulte est de 1 080 km[23],[3].
Le Requin balestrine vit dans les eaux côtières jusqu'à une profondeur de 150 m, préférant les environnements avec des sédiments fins et une eau trouble. Il entre parfois dans les estuaires, mais contrairement au Requin bouledogue, il ne remonte pas les rivières et évite les eaux saumâtres[1],[6]. Les mouvements des jeunes Requins balestrines et leur utilisation de l'habitat ont été largement étudiés à Cleveland Bay, dans le nord du Queensland. Les jeunes requins vivent dans la baie toute l'année, en restant principalement dans la partie orientale où l'entrée de trois rivières produit des courants forts et où la turbidité est élevée. Les domaines vitaux individuels sont relativement restreints, avec une moyenne de 30 km2, et s'agrandissent avec l'âge. Les jeunes restent généralement dans des eaux à moins de 40 m de profondeur, et les plus jeunes requins passent le plus clair de leur temps dans les parties les moins profondes de la baie. Ils nagent dans l'estran à marée montante et vont plus au large lorsque la marée descend, certainement pour exploiter les ressources alimentaires des vasières submergées, ou pour éviter la prédation ou la compétition en restant en dehors des eaux plus profondes occupées par les grands requins. On observe également un cycle de déplacement annuel, les jeunes se rapprochant des embouchures de rivières pendant la saison sèche et s'en éloignant pendant la saison des pluies, car celles-ci engendrent un débit plus élevé de l'eau douce dans la baie, et les requins semblent fuir la diminution de la salinité et de la teneur en oxygène dissous qui en découle[11],[24].
Taxinomie
[modifier | modifier le code]
Les biologistes allemands Johannes Müller et Jakob Henle ont décrit le Requin balestrine comme Carcharias (Prionodon) amboinensis dans leur Systematische Beschreibung der Plagiostomen paru en 1839. Plus tard, d'autres auteurs le réaffectent dans le genre Carcharhinus. Le spécimen type est une femelle pleine de 74 cm de long capturée à l'Ambon en Indonésie, île qui a d'ailleurs donné le nom spécifique de l'espèce : amboin(e) pour l'île d'Ambon, parfois orthographiée Amboine, et le suffixe latin -ensis, « qui vit dans, qui habite »[25],[2]. Plusieurs synonymes sont connus pour cette espèce, dont Triaenodon obtusus, qui était décrit par Francis Day à partir d'un fœtus presque naissant, ou Carcharias brachyrhynchos décrit par Bleeker en 1859[2].
Phylogénie et évolution
[modifier | modifier le code]Comme le Requin balestrine ressemble fortement au Requin bouledogue (C. leucas), les études phylogénétiques basées sur la morphologie de ces deux espèces ont conclu qu'ils étaient étroitement apparentés[26],[27]. Ce classement, pas plus que ceux qui l'ont précédé, n'est pas soutenu par la recherche phylogénétique moléculaire, qui n'a pas à ce jour réussi à trouver un lien évolutif entre ce requin et les autres espèces de Carcharhinus[28],[29].
L'analyse génétique des Requins balestrines du nord de l'Australie suggèrent que l'évolution de cette espèce a été affectée par les modifications du littoral durant le Pléistocène (il y a entre 2,6 millions et 12 000 ans). La diversité observée au niveau de son ADN mitochondrial est compatible avec des populations qui ont été plusieurs fois séparées puis réunies, des barrières géographiques qui sont alternativement apparues ou disparues au fil du temps. La plus récente de ces barrières était un pont de terre qui traversait le détroit de Torres, qui s'est rouvert il y a seulement 6 000 ans. Par conséquent, on observe une variabilité génétique importante entre les requins vivant au large de l'Australie-Occidentale et du Territoire du Nord et ceux au large du Queensland[23].
Relations avec l'Homme
[modifier | modifier le code]Le Requin balestrine est grand et formidablement denté, et il est donc considéré comme dangereux pour l'Homme, même s'il n'a pas été impliqué dans des attaques. Cette espèce est rarement capturée dans les palangres et autres filets, auquel cas elle est utilisée pour sa chair et ses ailerons[3]. Cependant, sa chair peut provoquer la ciguatera. En , quelque 500 personnes à Manakara, à Madagascar ont été empoisonnées, dont 98 en sont mortes, après avoir mangé de la chair de Requin balestrine. Il s'agissait de la première intoxication alimentaire de masse par ciguatera causée par un requin, ainsi que la première causant un taux de mortalité important[30]. L'Union internationale pour la conservation de la nature (UICN) a inscrit le Requin balestrine comme présentant des « données insuffisantes », tout en notant que sa rareté peut le rendre vulnérable à la surpêche[8]. À KwaZulu-Natal, en Afrique du Sud, un petit nombre de requins balestrines sont pris dans des filets à requins mis en place pour protéger les plages. Le taux de capture et la taille moyenne des requins capturés ont diminué entre 1978 et 1998, ce qui fait craindre que la population locale peut être en déclin. Ainsi, l'UICN a classé localement l'espèce « quasi-menacée » dans le sud-ouest de l'océan Indien[31]
Références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pigeye shark » (voir la liste des auteurs).
- (en) M. Voigt et D. Weber, Field Guide for Sharks of the Genus Carcharhinus, Munich, Verlag Dr. Friedrich Pfeil, , 47–49 p. (ISBN 978-3-89937-132-1)
- (en) L.J.V. Compagno, Sharks of the World : An Annotated and Illustrated Catalogue of Shark Species Known to Date, Food and Agricultural Organization of the United Nations, , 462–463 p. (ISBN 978-92-5-101384-7)
- (en) P.R. Last et J.D. Stevens, Sharks and Rays of Australia, Cambridge (Mass.), Harvard University Press, , second éd., 253–254 p. (ISBN 978-0-674-03411-2)
- (en) R.J. McKay et K. Beinssen, « Albinism in the pigeye whaler shark Carcharhinus amboinensis Mueller and Henle from Queensland Australia », Memoirs of the Queensland Museum, vol. 25, no 2, , p. 463–464
- « Requin bouledogue » (consulté le )
- (en) G. Cliff et S.F.J. Dudley, « Sharks caught in the protective gill nets off Natal, South Africa. 5. The Java shark Carcharhinus amboinensis (Müller & Henle) », South African Journal of Marine Science, vol. Suppl. 11, no 1, , p. 443–453 (DOI 10.2989/025776191784287817)
- (en) M.J. Kinney, N.E. Hussey, A.T. Fisk, A.J. Tobin et C.A. Simpfendorfer, « Communal or competitive? Stable isotope analysis provides evidence of resource partitioning within a communal shark nursery », Marine Ecology Progress Series, vol. 439, , p. 263–276 (DOI 10.3354/meps09327)
- (en) G. Cliff, « Carcharhinus amboinensis », IUCN Red List of Threatened Species. Version 2012.2. International Union for Conservation of Nature, (consulté le )
- (en) J.D. Stevens et K.J. McLoughlin, « Distribution, size and sex composition, reproductive biology and diet of sharks from northern Australia », Australian Journal of Marine and Freshwater Research, vol. 42, no 2, , p. 151–199 (DOI 10.1071/MF9910151)
- (en) D.M. Knip, M.R. Heupel et C.A. Simpfendorfer, « Evaluating marine protected areas for the conservation of tropical coastal sharks », Biological Conservation, vol. 148, no 1, , p. 200–209 (DOI 10.1016/j.biocon.2012.01.008)
- (en) D.M. Knip, M.R. Heupel, C.A. Simpfendorfer, A.J. Tobin et J. Moloney, « Ontogenetic shifts in movement and habitat use of juvenile pigeye sharks Carcharhinus amboinensis in a tropical nearshore region », Marine Ecology Progress Series, vol. 425, , p. 233–246 (DOI 10.3354/meps09006)
- (en) B.J. Tillett, M.G. Meekan, D. Parry, N. Munksgaard, I.C. Field, D. Thorburn et C.J. Bradshaw, « Decoding fingerprints: elemental composition of vertebrae correlates to age-related habitat use in two morphologically similar sharks », Marine Ecology Progress Series, vol. 434, , p. 133–142 (DOI 10.3354/meps09222)
- (en) B.J. Tillett, M.G. Meekan, I.C. Field, Q. Hua et C.J.A. Bradshaw, « Similar life history traits in bull (Carcharhinus leucas) and pig-eye (C. amboinensis) sharks », Marine and Freshwater Research, vol. 62, no 7, , p. 850–860 (DOI 10.1071/MF10271)
- (en) R.J. Gleeson, M.B. Bennett et R.D. Adlard, « First taxonomic description of multivalvulidan myxosporean parasites from elasmobranchs: Kudoa hemiscylli n.sp. and Kudoa carcharhini n.sp. (Myxosporea: Multivalvulidae) », Parasitology, vol. 137, no 13, , p. 1885–1898 (PMID 20619061, DOI 10.1017/S0031182010000855)
- (en) A.C. Henderson, A.J. Reeve et D. Tang, « Parasitic copepods from some northern Indian Ocean elasmobranchs », Marine Biodiversity Records, vol. 6, , e44 (DOI 10.1017/S1755267213000195)
- (en) P.D. Olson, J.N. Caira, K. Jensen, R.M. Overstreet, H.W. Palm et I. Beveridge, « Evolution of the trypanorhynch tapeworms: parasite phylogeny supports independent lineages of sharks and rays », International Journal for Parasitology, vol. 40, no 2, , p. 223–242 (PMID 19761769, DOI 10.1016/j.ijpara.2009.07.012)
- (en) R.A. Campbell et I. Beveridge, « Floriceps minacanthus sp. nov. (Cestoda: Trypanorhyncha) from Australian fishes », Transactions of the Royal Society of South Australia, vol. 111, nos 3–4, , p. 189–194 (lire en ligne [archive du ])
- (en) H.W. Palm et I. Beveridge, « Tentaculariid cestodes of the order Trypanorhyncha (Platyhelminthes) from the Australian region », Records of the South Australian Museum, vol. 35, no 1, , p. 49–78 (lire en ligne)
- (en) B.C. Schaeffner et I. Beveridge, « Redescriptions and new records of species of Otobothrium Linton, 1890 (Cestoda: Trypanorhyncha) », Systematic Parasitology, vol. 84, no 1, , p. 17–55 (PMID 23263940, DOI 10.1007/s11230-012-9388-1)
- (en) J.N. Caira, J. Mega et T.R. Ruhnke, « An unusual blood sequestering tapeworm (Sanguilevator annéesleyi n. gen., n. sp.) from Borneo with description of Cathetocephalus resendezi n. sp from Mexico and molecular support for the recognition of the order Cathetocephalidea (Platyhelminthes: Eucestoda) », International Journal for Parasitology, vol. 35, , p. 1135–1152 (PMID 16019004, DOI 10.1016/j.ijpara.2005.03.014)
- (en) D.M. Knip, M.R. Heupel et C.A. Simpfendorfer, « Mortality rates for two shark species occupying a shared coastal environment », Fisheries Research, vol. 125–126, , p. 184–189 (DOI 10.1016/j.fishres.2012.02.023)
- (en) A. De Maddalena et G. Della Rovere, « First record of the pigeye shark, Carcharhinus amboinensis (Müller & Henle, 1839), in the Mediterranean Sea », Annales Series Historia Naturalis, vol. 15, no 2, , p. 209–212
- (en) B.J. Tillett, M.G. Meekan, D. Broderick, I.C. Field, G. Cliff et J.R. Ovenden, « Pleistocene isolation, secondary introgression and restricted contemporary gene flow in the pig-eye shark, Carcharhinus amboinensis across northern Australia », Conservation Genetics, vol. 13, no 1, , p. 99–115 (DOI 10.1007/s10592-011-0268-z)
- (en) D.M. Knip, M.R. Heupel, C.A. Simpfendorfer, A.J. Tobin et J. Moloney, « Wet-season effects on the distribution of juvenile pigeye sharks, Carcharhinus amboinensis, in tropical nearshore waters », Marine and Freshwater Research, vol. 62, no 6, , p. 658–667 (DOI 10.1071/MF10136)
- (de) J. Müller et F.G.J. Henle, Systematische Beschreibung der Plagiostomen (volume 2), Veit und Comp., (lire en ligne), p. 40
- (en) L.J.V. Compagno, Sharks of the Order Carcharhiniformes, Princeton University Press, , 319–320 p. (ISBN 978-0-691-08453-4)
- (en) G.J.P. Naylor, « The phylogenetic relationships among requiem and hammerhead sharks: inferring phylogeny when thousands of equally most parsimonious trees result », Cladistics, vol. 8, , p. 295–318 (DOI 10.1111/j.1096-0031.1992.tb00073.x)
- (en) X. Vélez-Zuazoa et I. Agnarsson, « Shark tales: A molecular species-level phylogeny of sharks (Selachimorpha, Chondrichthyes) », Molecular Phylogenetics and Evolution, vol. 58, no 2, , p. 207–217 (PMID 21129490, DOI 10.1016/j.ympev.2010.11.018)
- (en) G.J. Naylor, J.N. Caira, K. Jensen, K.A. Rosana, N. Straube et C. Lakner, The Biology of Sharks and Their Relatives, Boca Raton (Fla.), CRC Press, , seconde éd., 31–57 p. (ISBN 978-1-4398-3924-9, lire en ligne), « Elasmobranch phylogeny: A mitochondrial estimate based on 595 species »
- (en) G.G. Habermehl, H.C. Krebs, P. Rasoanaivo et A. Ramialiharisoa, « Severe ciguatera poisoning in Madagascar — a case-report », Toxicon, vol. 32, no 12, , p. 1539–1542 (PMID 7725322, DOI 10.1016/0041-0101(94)90312-3)
- (en) G. Cliff, « Carcharhinus amboinensis (Southwest Indian Ocean subpopulation) », IUCN Red List of Threatened Species. Version 2012.2. International Union for Conservation of Nature, (consulté le )
Annexes
[modifier | modifier le code]Références taxinomiques
[modifier | modifier le code]- (en) Référence Animal Diversity Web : Carcharhinus amboinensis (consulté le )
- (en + fr) Référence FishBase : (consulté le )
- (fr + en) Référence ITIS : Carcharhinus amboinensis (Müller & Henle, 1839) (consulté le )
- (en) Référence WoRMS : espèce Carcharhinus amboinensis (Müller & Henle, 1839) (consulté le )
Liens externes
[modifier | modifier le code]- (en) Référence NCBI : Carcharhinus amboinensis (taxons inclus) (consulté le )
- (en) Référence UICN : espèce Carcharhinus amboinensis (Müller & Henle, 1839) (consulté le )


 French
French Deutsch
Deutsch

