Органоїд — Вікіпедія
| Органоїд | |
| Очікувана тривалість життя | 80 день[1] |
|---|---|
| З матеріалу | стовбурові клітини і elective abortiond |
| | |
Органоїд — це мініатюрна та спрощена тривимірна версія органу, створена in vitro, яка імітує ключову функціональну, структурну та біологічну складність цього органу.[2][3][4]
Органоїди — це тривимірні (3D) клітинні структури, які походять зі стовбурових клітин або тканиноспецифічних клітин-попередників, і точно імітують мікроархітектуру та функціональність конкретних органів або тканин в організмі людини чи тварини.[2]

Науковці біомедицини та біомедичні інженери використовують органоїди для вивчення нормального розвитку, моделювання захворювань у лабораторії, відкриття та розробки ліків, персоналізованої діагностики та медицини, регенеративної медицини, клітинної терапії стовбуровими клітинами, тканинної інженерії та досліджень можливостей друку органів.[2][3][4][5]

Історія[ред. | ред. код]
Ранні експерименти (1900-ті)[ред. | ред. код]
Культивування органоїдів міцно базується на методології 3D-культивування клітин, розробленій протягом останнього століття. Ще в 1906 році так званий «метод висячої краплі» дозволяв культивувати клітини в 3D.[7]
Одночасно дослідники вивчали здатність дисоційованих клітин до регенерації. Спроби створити органи in vitro розпочалися з одного з перших експериментів «дисоціації-реагрегації»[8], коли Генрі Ван Пітерс Вілсон у 1907 році продемонстрував, що механічно дисоційовані клітини губки можуть реагрегуватись та самоорганізовуватися для створення цілого організму.[9] Вілсон показав, що губки можна розщепити на окремі клітини, які здатні повторно асоціюватися в тканиноподібні структури. Те ж саме, пізніше, показали на прикладі кишковопорожнинних у 1914 році[10] та ембріональних клітин амфібій у 1940-х роках[11][12][7][13].
1920-1970-ті роки[ред. | ред. код]
У 1920-х роках увага дослідників зосередилась на ембріології, зокрема на морфогенезі кінцівок, що призвело до розвитку трубчастих культур і методу годинникового скла.[14][15] Трубчасті культури передбачали вирощування тканин на увігнутій скляній поверхні, на яку вбудовували та культивували фрагменти тканин або зачатки органів.[14] Метод годинникового скла, запроваджений Феллом і Робісоном у 1929 році, використовував увігнуту скляну поверхню, що утримує плазмовий згусток для культивування фрагментів тканини.[15]
До 1950-х років різні органи успішно культивували in vitro, хоча й з обмеженнями. В основному дослідники працювали над тим, щоб уникнути міграції клітин із зразка тканини, намагалися оптимізувати умови газообміну, зменшити некроз. Метод лінзового паперу також дозволив культивувати тонкі зрізи органів протягом цього періоду.[16][17]
На початку 1950-х років робота Москона з кінцівками курячого ембріона та зачатками нирок привела до створення методів ферментативного травлення, суспензійної культури та реагрегації клітин.[18][19][20][21][22]
Також, у цю епоху почали з’являтися методи культури на основі колагену. У 1930-х роках Хузелла експериментував з культивуванням клітин на волокнистому колагені.[23] Значний розвиток відбувся в 1956 році, коли Роберт Ерманн і Джордж Гей представили метод відновлення колагену, вилученого з сухожиль щурячого хвоста, у вигляді прозорого гелю. Це нововведення полегшило культивування різних клітинних ліній і тканин, покращуючи їх виживання.[24] Роком пізніше, Ласфарг створив метод, використовуючи колагеназу для дисоціації тканини молочної залози дорослої миші, утворюючи органоїди молочної залози (фрагменти проток), позбавлені фібробластів і адипоцитів.[25] Це було передумовою, яка згодом призвела до створення методу отримання мільйонів життєздатних гепатоцитів Беррі та Френдом у 1969 році шляхом перфузії печінки цією самою колагеназою.[26]
У 1970-х роках дослідники помітили, що зміна фізичний вплив на субстрат та клітини може викликати специфічну диференціацію клітин.[27][28] В той же час, Річард Сварм і його команда працювали над позаклітинним матриксом хондросарком, виділяючи з них гель з характеристиками базальної мембрани, відомий нині як Матригель[en].[29] Цей гель, багатий ламініном, колагеном IV і фібронектином, зіграв вирішальну роль у вдосконаленні методів культивування органоїдів.[30][31]
1980-2010-ті роки[ред. | ред. код]
1980-ті роки ознаменували значний прогрес у біології стовбурових клітин. Виділення та характеристика ембріональних стовбурових клітин (ЕСК) були ключовими досягненнями в цю епоху.[32][33] ЕСК, з їх потенціалом створювати різноманітні типи клітин, надихнули дослідників досліджувати їх корисність у створенні органоподібних структур.[8]
Не менш вагомими дослідженнями для галузі органоїдів були дослідження впливу культурального середовища чи позаклітинного матриксу на диференціацію клітин. Декілька таких досліджень в 1980-х роках показали значну роль позаклітинного матриксу у регуляції експресії генів та морфогенезу.[34][35][36][37][38][39] Подальші дослідження 1990-х років пролили ще більше світла на роль позаклітинного матриксу в диференціації клітин та утворенні тканиноподібних структур[40][41][42][43][44], зокрема на взаємодію позаклітинного матриксу з рецепторами клітин інтегринами, що призводить до каскаду реакцій, змінюючих експресію генів та диференціацію клітин[45].
Подальші дослідження показали, що морфогенез залежить від взаємодії факторів росту, морфогенів і матриксних металопротеїназ[46], а також від геометрії тканин[47].
У 2006 році Яков Нахміас і Девід Одде продемонстрували самозбірку судинних органоїдів печінки, які підтримувалися протягом понад 50 днів in vitro.[48] У 2008 році Йошікі Сасаї та його команда з інституту RIKEN продемонстрували, що стовбурові клітини можливо перетворити на кульки нервових клітин, які самоорганізуються в характерні шари.[49] У 2009 році Сато та команда опублікували в Nature своє дослідження, в якому вони використали стовбурові клітини, які експресують LGR5, ізольовані із первинної кишкової тканини, і показали, що ці стовбурові клітини можуть клонально генерувати архітектуру крипт-ворсинок у 3D-культурі. Базуючись на літературі про молочні залози, згаданій раніше, ці автори також використовували Matrigel для проведення своїх 3D культур і доповнювали їх факторами, необхідними для росту епітелію кишківника. Були створені органоїди, що складаються з центрального просвіту, вистеленого ворсинчастим епітелієм, і кількох оточуючих криптоподібних доменів.[50] Потім ця методологія була успішно використана в культурах шлунка[51], підшлункової залози[52], товстої кишки[53] та печінки[54]. Мишачі та людські ембріональні стовбурові клітини (ЕСК) також використовувалися для генерування органоїдів in vitro, таких як поляризована кортикальна тканина мозку[55] та зорові чаші[56][57]. Також, у 2010 році було продемонструвано виробництво ниркових органоїдів із реногенних стовбурових клітин мишачого плоду.[58]

Індуковані плюрипотентні стовбурові клітини, отримані завдяки епігенетичному перепрограмуванню, які стали науковим проривом у 2006 році[59], за який Сін'я Яманака та Джон Гердон отримали Нобелівську премію з хімії у 2012 році, стали також додатковим інструментом для вивчення морфогенезу[60][61][62] і, згодом, стали одним з основних джерел клітин для конструювання органоїдів.[63]
У 2013 році Ланкастер з командою створили метод культивування, який дозволив генерувати церебральні органоїди[en] з індукованих плюрипотентних стовбурових клітин, отриманих із фібробластів шкіри.[64]
У 2014 році Цюнь Ван і його колеги розробили гелі на основі колагену-I та синтетичні спінені біоматеріали для культивування та доставки кишкових органоїдів[65], і інкапсулювали функціоналізовані ДНК наночастинки золота в кишкові органоїди, щоб сформувати механізм для доставки ліків і генотерапії.[66] Також, у 2014 році було продемонстровано, що серцево-судинні органоїди можуть утворюватися з ЕСК шляхом модуляції жорсткості субстрату, до якого вони прилипають.[67] Крім того, у 2014 році були створені перші органоїди сітківки.[68]
У 2015 році Такебе з командою продемонстрували узагальнений метод формування зачатка органу з різноманітних тканин шляхом поєднання специфічних тканин-попередників, отриманих із плюрипотентних стовбурових клітин, або відповідних зразків тканини з ендотеліальними клітинами та мезенхімальними стовбуровими клітинами.[69]
У 2017 році була запропонована нова методика утворення церебральних органоїдів[70], а журнал Nature Methods визнав органоїди «Методом року 2017».[71]
Загалом, у 2010-х роках спостерігався значний сплеск досліджень органоїдів та їх використання для моделювання нормального розвитку чи розвитку захворювань, для розробки й тестування ліків, та для регенеративної медицини.[72][73]
2020-сучасність[ред. | ред. код]
Через значний потенціал використання органоїдів в багатьох галузях біомедицини, кількість досліджень органоїдів щороку збільшується, порівняно з початком 2010-х, — експоненційно.[74]
- 2021 — отримані з ембріональних стовбурових клітин людини церебральні органоїди успішно трансплантовані в місця контрольованого травматичного ураження головного мозку мишей. Трансплантовані органоїди вижили та диференціювалися в різні типи нейрональних клітин, утворювали нові зв'язки та демонстрували спонтанну активність; також були виявлені індукована васкуляризація та зменшення гліального рубця. Що більш важливо, просторове навчання та пам’ять мишей покращилися після трансплантації органоїдів. Ці висновки засвідчили про те, що церебральний органоїд, імплантований у місця травматичного ураження є потенційним терапевтичним методом для ЧМТ.[75]
- 2022 — коркові церебральні органоїди, отримані зі стовбурових клітин людини й трансплантовані в соматосенсорну кору новонароджених безтимусних щурів, розвивають зрілі типи клітин, які інтегруються в сенсорні та мотиваційні нейронні схеми.[76] В кінці грудня було опубліковане дослідження, що показало успішну інтеграцію мозкових органоїдів з зоровою корою миші.[77]
- 2023 — органоїди людського мозку знову були успішно інтегровані з зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини в зоровій корі.[78] Дослідження показало успішне відновлення функції після інтеграції мозкового органоїда в ділянку ішемічного інсульту миші.[79] Також було представлено прецизійну роботизовану платформу культур клітин Cell X для ефективного виробництва специфічних для пацієнта іПСК і органоїдів сітківки, демонструючи потенціал для клінічного конвеєрного виробництва іПСК для аутологічної заміни клітин сітківки[80]; пізніше в серпні було представлено ще одну технологію автоматизованого друку органоїдів для тестування та скринінгу ліків[81]. У серпні вийшло дослідження, що описує успішну трансплантацію щурам серцевих органоїдів, сконструйованих з електропровідними кремнієвими нанодротами, в місця ураження інфарктом міоркарда, що сприяло значному функціональному відновленню серця.[82]
Властивості[ред. | ред. код]
Органоїди, культивовані зі стовбурових клітин або тканиноспецифічних попередників, є тривимірними структурами, що відображають структуру та функціональність реальних органів.[2][3][4] До них основних властивостей відносяться:
- клітинна гетерогенність, що дозволяє вивчати складні процеси та захворювання;
- самоорганізація, що дозволяє відтворювати органоподібні структури;
- і функціональність, що імітуює фізіологію органів для дослідження функцій органів, механізмів захворювання та реакції на ліки.
Ланкастер і Кнобліх визначають органоїд як сукупність органоспецифічних типів клітин, які розвиваються зі стовбурових клітин або органів-попередників, самоорганізуються шляхом сортування клітин і просторово обмежені подібно до in vivo, і демонструє наступні властивості[8]:
- органоїд має кілька органів-специфічних типів клітин;
- органоїд здатний повторювати деякі специфічні функції органу (наприклад, скорочення, нервова активність, ендокринна секреція, фільтрація, виділення);
- його клітини згруповані разом і просторово організовані, подібно до органу.
Розробка органоїдів[ред. | ред. код]
Розробка органоїдів включає складний процес, який спрямований на повторення складних структур і функцій різних тканин і органів у контрольованому лабораторному середовищі.
Способи утворення органоїдів[ред. | ред. код]
2D проти 3D культурних систем[ред. | ред. код]
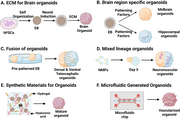
Утворення органоїдів може відбуватися як у двовимірних (2D), так і в тривимірних (3D) культуральних системах. У той час як 2D-культури використовувалися для деяких ранніх досліджень, 3D-культури набули популярності завдяки їхній здатності більш точно відтворювати середовище in vivo. У 3D-режимі клітини взаємодіють одна з одною та навколишньою матрицею таким чином, що точно імітує природну архітектуру тканин, у результаті чого утворюються органоїди, які краще повторюють фізіологічні функції.[73]
Похідні зі стовбурових клітин проти первинних органоїдів, отриманих із тканин[ред. | ред. код]

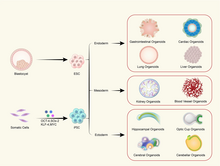
Органоїди можуть бути створені або зі стовбурових клітин, або з первинних зразків тканин. Органоїди, отримані зі стовбурових клітин, часто з індукованих плюрипотентних стовбурових клітин (iPSC) методом епігенетичного перепрограмування, пропонують перевагу плюрипотентності та можуть бути спрямовані на диференціацію в різні типи клітин.[83] Навпаки, первинні органоїди — це такі, що отримані з тканин in vivo.[50] Обидва підходи мають свої переваги: органоїди, отримані зі стовбурових клітин, забезпечують масштабованість і можливість вивчати більш широкий спектр тканин, тоді як органоїди, отримані з первинних тканин, зберігають генетичні та фенотипові характеристики вихідної тканини.[84]
Матрикси та фактори росту[ред. | ред. код]
Вибір позаклітинного матриксу і факторів росту відіграє вирішальну роль у формуванні органоїдів. Компоненти позакрітинного матриксу, такі як Матригель, колаген або ламінін, забезпечують структурну підтримку та біохімічні сигнали, необхідні для клітинної адгезії, проліферації та диференціації.[72] Фактори росту, такі як агоністи Wnt[en] і BMP[en], часто використовуються для спрямування конкретних шляхів розвитку під час дозрівання органоїдів.[85] Ці матрикси та фактори вибираються на основі типу тканини та бажаних характеристик органоїдів.
Колоїдні фотонні кристали пропонують численні переваги для органоїдної інженерії, включаючи їх унікальні структури, можливості оптичного маніпулювання, універсальність функціональності та легкість інтеграції в стандартизовані виробничі процеси.[86]
Тканиноспецифічні мікрооточення[ред. | ред. код]
Однією з ключових детермінант успішного формування органоїдів є відновлення тканиноспецифічного мікросередовища. Ці мікросередовища складаються з унікальних комбінацій компонентів позаклітинного матриксу, факторів росту та міжклітинних взаємодій. Дослідники ретельно розробляють умови культивування, щоб відтворити ці мікросередовища, дозволяючи органоїдам розвиватися у спосіб, який дуже нагадує їх аналоги in vivo.[2][3][87] Цей підхід відіграв важливу роль у створенні органоїдів, які повторюють структуру та функції різних органів, включаючи мозок[88][89][90][91][92], кишківник[93][94][95][96], печінку[97][98][99][100], нирки[101][102], підшлункову залозу[103][104], легені[105][106][107], серце[108][109][110][111][112], судини[113], сітківку[114][115], внутрішнє вухо[116] та інші.

Досягнення в технології утворення органоїдів[ред. | ред. код]
Останні досягнення в техніці утворення органоїдів розширили масштаб і можливості цієї галузі.[2][3][4] Ці інновації включають інтеграцію мікрофлюїдики для точного контролю умов культивування[118][119], розробку систем органоїд-на-чипі для високопродуктивного скринінгу[120][121][122][123][124][125] (див. також Орган на чипі), різноманітні підходи генетичної інженерії[126], застосування штучного інтелекту та машинного навчання для покращеного аналізу органоїдів[127][128][129][130], та, навіть, створення роботизованих автоматичних систем для масового виробництва іПСК та органоїдів[80][81]. Ці передові технології мають потенціал для прискорення дослідження органоїдів та їх застосування в тканинній інженерії, регенеративній медицині, персоналізованій медицині та відкритті ліків.
Типи органоїдів[ред. | ред. код]
Багато різних структур органів були повторені за допомогою органоїдів.[2][3][4]
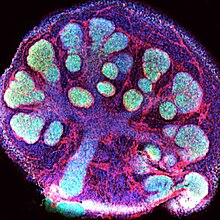
Церебральний органоїд[ред. | ред. код]
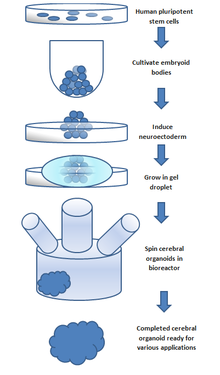
Церебральний органоїд[en] — це органоїд головного мозку, на поточному етапі розвитку — певної його регіон-специфічної ділянки, як-от кора чи передній мозок.[132][133][133] Органоїди головного мозку відіграють важливу роль у вивченні нормального та патологічного нейророзвитку, моделюванні захворювань мозку, таких як хвороба Альцгеймера та хвороба Паркінсона, дослідженні впливу ліків на нервову тканину, і також відкривають значні можливості для інженерії нервової тканини та регенеративної медицини травм головного мозку[75][78], інсульту[79], нейродегенеративних хвороб тощо.[134][135][136][137]
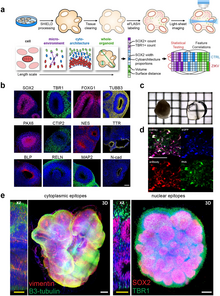
Перші церебральні органоїди були створені в 2013 році шляхом культивування плюрипотентних стовбурових клітин людини в тривимірній структурі за допомогою ротаційного біореактора[en] та розвивались протягом місяців.[64] А вже через 8 років у преклінічному досліджені на тваринах було показано, що церебральні органоїди можуть відновити функцію в уражених травмою чи інсультом ділянках головного мозку.[75][78][79]
Типи[ред. | ред. код]
Існує багато типів церебральних органоїдів, які імітують певний регіон мозку і відрізняються типами клітин та іншими характеристиками, й використовуються для різних цілей.[132][135]
Серед цих типів окремо виділяють асемблоїди — це злиті органоїди, специфічні для регіону, які намагаються повторити міжрегіональні та міжклітинні взаємодії, а також розвиток нейронних ланцюгів шляхом поєднання кількох областей мозку та/або ліній клітин.[119][138][139]
Крім того, окремо виділяють більш прогресивний тип органоїдів — васкуляризований, тобто, з наявною кровоносною системою, що забезпечує кровопостачання клітин, необхідне для нормального фунціонування клітин при довготривалих дослідженнях.[89][140][141][142] Окрім доставки кисню та живлення, накопичені докази свідчать про те, що судинна система мозку регулює нейронну диференціацію, міграцію та формування контурів під час розвитку.[143]

Огляд 2022 року[135] та огляд 2023 року[144] та кілька інших статей зазначених далі виділяють наступні типи органоїдів: олігокортикальні сфероїди[145][146], кортикальні сфероїди[147][148][149], органоїди середнього мозку[150][151][152][153][154], гіпоталамічні органоїди[155][156][157], органоїди сітківки[158][159][160][161] та мультиокулярні органоїди[162], органоїди переднього мозку[78][163][164], асемблоїди переднього мозку[165][166][167], органоїди з мікроглією[168][169][170][171][172], нейросфери[en][173][174], астероїди (з астроцитів)[175][176][177], мієлінізовані органоїди (мієліноїди)[178] та деякі інші[179].
Застосування[ред. | ред. код]
Моделювання захворювань та скринінг ліків[ред. | ред. код]
Фармацевтичні компанії та наукові колективи використовують церебральні органоїди для скринінгу та розробки ліків через їхні характеристики максимально наближені до in vivo.[179][180]
Основні поточні дослідження церебральних органоїдів в моделюванні хвороб[181] та тестування ліків для них направлені на дослідження таких патологій[135][137][182]:
- Патології нейророзвитку (розлади аутистичного спектра[183][184], мікроцефалія[185], синдром Ретта[186][187], синдром Ангельмана[188][189], туберозний склероз[190][191] та ін.[92][192][193])
- Нейродегенеративні хвороби (хвороба Альцгеймера[194][195][196][197][198], хвороба Паркінсона[154][199][200][201], бічний аміотрофічний склероз[202][203], розсіяний склероз[204][205], хвороба Гантінгтона[206][207][208], хвороба Кройцфельда-Якоба[209] та ін.[92][210])
- Психіатричні розлади (депресивні розлади[211][212], шизофренія[213][214], біполярний афективний розлад[215][216] та ін.[217][218][219])
- Пухлини мозку (гліобластома[220][221][222], медулобластома[223][224], менінгіома[225][226][227] та ін.[228][229])
- Інфекційні захворювання ЦНС (малярія[230][231], вірус Зіка[232][233], SARS-CoV-2[234][235], Японський енцефаліт[236], вірус простого герпесу[173][237] та ін.[238][239])
Крім того, органоїди досліджуються на вплив екзогенних хімічних речовин, таких як забруднюючі речовини, токсини, ліки та промислові хімікати на здоров'я мозку.[240]
Персоналізована медицина та індивідуальне лікування[ред. | ред. код]
Церебральні органоїди мають великі перспективи в галузі персоналізованої медицини. Отримавши органоїди з іПСК окремих пацієнтів, дослідники можуть створити індивідуальні моделі пацієнтів для вивчення механізмів захворювання та тестування персоналізованих стратегій лікування. Такий підхід дозволяє проводити більш адаптоване та ефективне терапевтичне втручання, особливо у випадках рідкісних генетичних розладів і станів із значним генетичним компонентом.[241][242][243][244][245]
Сучасні дослідження також фокусуються на використанні органоїдів мозку для досліджень в персоналізованій медицині в поєднанні з різними передовими методами, такими як редагування генома (CRISPR-Cas9), інтегративний мультиоміксний аналіз, 3D очищення мозкової тканини та передових систем візуалізації методом конфокальної мікроскопії.[246] Також, перспективним вважається поєднання машинного навчання та моделювання органоїдів мозку для цілей персоналізованої медицини.[247]

Тканинна інженерія та регенеративна медицина[ред. | ред. код]
Церебральні органоїди є перспективними для регенеративної медицини, особливо в контексті травм головного мозку та дегенеративних розладів.
У 2021 році було показано, що церебральні органоїди можуть відновити функцію в уражених травмою ділянках головного мозку.[75] У 2022 й 2023 роках кілька досліджень показали, що органоїди людського мозку були успішно інтегровані з зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори.[78] Ще одне дослідження 2023 року, опубліковане в npj Regenerative Medicine, показало успішне відновлення функції враженої інсультом ділянки мозку миші після інтеграції в неї мозкового органоїд[79]:
"...Через кілька місяців ми виявили, що трансплантовані органоїди добре вижили в ураженому інфарктом ядрі, диференціювалися в цільові нейрони, відновлювали інфарктну тканину, посилали аксони до віддалених мішеней мозку та інтегрувалися в нейронний ланцюг господаря, тим самим усуваючи сенсомоторні дефекти поведінки мишей, які перенесли інсульт, тоді як трансплантація дисоційованих окремих клітин з органоїдів не привела до відновлення ураженої інфарктом тканини."
Також, дослідження 2023 року продемонструвало виробництво in vitro та in vivo мієлінізуючих олігодендроцитів із культури нейроепітеліальних стовбурових (lt-NES) клітин (отриманих в людських іПСК), яка також дає початок нейронам зі здатністю інтегруватися в пошкоджені інсультом коркові мережі дорослих щурів та мієлінізувати демієлінізовані аксони щура. Це відкриває нові можливості в лікуванні нейродегенеративних захворювань з порушенням мієлінізації нервових волокон.[249]
Див. також — Інженерія нервової тканини, Тканинна інженерія, Регенеративна медицина.
Розуміння біології розвитку[ред. | ред. код]
Церебральні органоїди є безцінними інструментами для вивчення різних аспектів розвитку людського мозку.[134][250][251][252] Дослідники, серед іншого, можуть досліджувати:
- Нейрогенез: органоїди дозволяють спостерігати за диференціюванням нервових стовбурових клітин і формуванням різних підтипів нейронів.[251][253]
- Аксональне наведення[en]: як аксони ростуть і переміщуються до цільових областей під час розвитку мозку.[254]
- Формування нейронних ланцюгів, ансамблів й мереж.[255][256]
- Гирифікація[en] (кортикальне згортання чи згортання кори) — це процес формування характерних складок кори головного мозку.[257][258][259]
- Клітинні взаємодії: церебральні органоїди полегшують вивчення клітинних взаємодій, у тому числі за участю нейронів, гліальних клітин і кровоносних судин.[260][261][262]
Органоїдний інтелект[ред. | ред. код]
Органоїдний інтелект (ОІ) — це нова міждисциплінарна галузь, зосереджена на розробці біологічних обчислень із використанням органоїдів мозку і технологій нейрокомп'ютерного інтерфесу. Біобчислювальні системи на основі OI мають потенціал для швидшого прийняття рішень, безперервного навчання під час виконання завдань і більшої ефективності використання енергії та обчислення даних, ніж обчислення на основі кремнієвих транзисторів та штучного інтелекту. Розвиток OI може покращити наше розуміння розвитку мозку, навчання, пам’яті та, потенційно, може допомогти знайти лікування неврологічних розладів, таких як деменція чи аутизм.[117][263][264]
OI включає збільшення церебральних органоїдів у складні, міцні 3D-структури, збагачені клітинами та генами, пов’язаними з навчанням, підключення їх до пристроїв введення та виведення наступного покоління та систем ШІ/машинного навчання. Для цього потрібні нові моделі, алгоритми та технології інтерфейсу, щоб спілкуватися з органоїдами мозку, розуміти, як вони навчаються та обчислюють, а також обробляти та зберігати величезні обсяги даних, які вони генерують.[117][263][264]
Крім того, використання таких органоїдів, які можуть розвинути відчуття та, ймовірно, в подальшому, свідомість, є предметом дискусій в нейроетиці та біоетиці.[265][266][267][268]
Також досліджується апаратний підхід штучного інтелекту, який використовує адаптивне резервуарне обчислення біологічних нейронних мереж в органоїді мозку. У цьому підході, який називається Brainoware, обчислення виконуються шляхом надсилання та отримання інформації від органоїда мозку за допомогою матриці мікроелектродів[en] високої щільності. Застосовуючи просторово-часову електричну стимуляцію, досягається нелінійна динаміка та властивості запам’ятовування, а також неконтрольоване навчання на основі тренувальних даних шляхом зміни функціональних зв’язків в органоїдах. Був продемонстрований практичний потенціал цієї методики, використовуючи її для розпізнавання мовлення та прогнозування нелінійних рівнянь у системі резервуарних обчислень.[269]
Органоїд кишки[ред. | ред. код]

Кишкові органоїди зазвичай отримують із плюрипотентних стовбурових клітин або стовбурових клітин дорослої тканини. Ці 3D-структури складаються з різних типів клітин, знайдених у кишківнику людини, включаючи ентероцити, келихоподібні клітини, ентероендокринні клітини[en] та клітини Панета[en].[270][271] Кишкові органоїди, зазвичай, складаються з одного шару поляризованих кишкових епітеліальних клітин, що оточують центральний просвіт, і повторюють структуру крипт-ворсинок кишківника, та його функції, фізіологію та організацію, зберігаючи всі типи клітин, які зазвичай зустрічаються в структурі, включаючи стовбурові клітини кишківника.[8] Таким чином, кишкові органоїди є цінною моделлю для вивчення кишкового транспорту поживних речовин[272][273], всмоктування та доставки ліків[274][275], наноматеріалів і наномедицини[276][277][278], секреції гормону інкретину[279][280] та інфікування різними ентеропатогенами.[281][282]
Однією з сфер дослідження кишкових органоїдів є дослідження ніші стовбурових клітин. Кишкові органоїди використовувалися для вивчення природи ніші кишкових стовбурових клітин, і дослідження, проведені з ними, продемонстрували позитивну роль IL-22 у підтримці кишкових стовбурових клітин[283], разом із демонстрацією ролі інших типів клітин, таких як нейрони та фібробласти в підтримці стовбурових клітин кишечника.[284]
У галузі інфекційної біології були досліджені різні модельні системи кишкових органоїдів. З одного боку, органоїди можуть бути інфіковані масово, просто змішавши їх із цікавим ентеропатогеном.[285] Однак для моделювання інфекції більш природним шляхом, починаючи з просвіту кишечника, необхідна мікроін’єкція збудника.[286][287] Крім того, полярність кишкових органоїдів можна інвертувати[288], і їх навіть можна розділити на окремі клітини та культивувати як двовимірні моношари[289][290] для того, щоб апікальна та базолатеральна сторони епітелію були легше доступні.
Кишкові органоїди також продемонстрували терапевтичний потенціал в лікуванні цукрового діабету, коли науковці перетворили клітини органоїда кишки у бета-клітини підшлункової залози, що продукують інсулін.[291]

Для більш точної рекапітуляції кишечника in vivo були розроблені спільні культури кишкових органоїдів та імунних клітин.[290] Крім того, моделі «орган-на-чипі» поєднують кишкові органоїди з іншими типами клітин, такими як ендотеліальні або імунні клітини, а також перистальтичний потік.[292][293]
Застосування[ред. | ред. код]
- Розуміння розвитку та фізіології: кишкові органоїди дають змогу зрозуміти розвиток[294], структуру[295] та фізіологію[296] кишечника людини. Дослідники можуть вивчати такі процеси, як диференціація клітин[297], оновлення епітелію[298], розвиток імунної системи кишківника[299] та ніші стовбурових клітин[300], поглинання поживних речовин[301], взаємодія хазяїна та мікроба[302][303][304][305], та багато інших.[306][307][308]
- Моделювання захворювань. Дослідники використовують кишкові органоїди для моделювання різноманітних шлунково-кишкових захворювань[en][309], включаючи запальні захворювання кишечника[en][310][311][312][313], муковісцидоз[314][315][316][317] та інфекційні захворювання[318][319][320], такі як норовірус[321][322], ротавірус[323] та ін. Вводячи специфічні для захворювання мутації або патогени, вчені можуть вивчати механізми захворювання та тестувати можливі методи лікування.
- Скринінг і розробка ліків: фармацевтичні компанії та дослідники використовують кишкові органоїди для оцінки безпеки та ефективності препаратів-кандидатів для шлунково-кишкових розладів. Ці моделі пропонують фізіологічно відповідну систему для скринінгу потенційних терапевтичних засобів.[324][325][326]
- Персоналізована медицина: кишкові органоїди, отримані з клітин пацієнтів, можна використовувати для вивчення індивідуальних реакцій на ліки та хвороби. Цей підхід є перспективним для пристосування лікування до конкретних пацієнтів.[316][317][327][328]
- Регенеративна медицина: Органоїдна терапія заснована на культивуванні in vitro з подальшим відбором і розмноженням здорових кишкових стовбурових клітин з метою трансплантації в слизову оболонку кишечника людини. Трансплантовані кишкові органоїди можна застосовувати для сприяння регенерації епітелію та відновлення нормальної фізіології кишечника.[311][313][329]
- Дослідження токсикології та фармакокінетики. Кишкові органоїди використовуються в токсикологічних дослідженнях для оцінки впливу хімічних речовин і токсинів на кишечник[330][331], а також фармакокінетику і метаболізм лікарських засобів[332][333].
Органоїд шлунка[ред. | ред. код]
Шлункові органоїди принаймні частково повторюють фізіологію шлунка. Органоїди шлунка були створені безпосередньо з плюрипотентних стовбурових клітин шляхом тимчасових маніпуляцій сигнальними шляхами FGF, WNT, BMP, ретиноєвої кислоти та EGF в умовах тривимірної культури.[334] Перші шлункові органоїди також були створені з використанням LGR5, що експресує дорослі стовбурові клітини шлунка.[51]
Органоїди шлунка використовувалися як модель для вивчення нормального та патологічного розвитку[334], та раку[335][336][336].
Органоїд печінки[ред. | ред. код]
Органоїди печінки повторюють структурні та функціональні особливості печінки, включаючи гепатоцити та епітеліальні клітини жовчних шляхів.[97][98][99][100]
Застосування[ред. | ред. код]
- Моделювання захворювань. Органоїди печінки використовуються для моделювання широкого спектру захворювань печінки[en][98][337][338][339], включаючи вірусний гепатит[340][341][342], неалкогольну жирову хворобу печінки[343][344][345][346], генетичні захворювання печінки[347][348], медикаментозне ураження печінки[349][350], травми печінки[en][351], рак печінки[352][353][354][355] та інші.
- Скринінг і розробка ліків: фармацевтичні компанії використовують органоїди печінки для оцінки токсичності[356][357] й ефективності препаратів-кандидатів, та їх метаболізму в печінці.[339][358][359][360] Ці моделі забезпечують фізіологічно релевантну систему для оцінки метаболізму ліків, гепатотоксичності та взаємодії ліків.
- Регенеративна медицина: органоїди печінки пропонують платформу для досліджень регенерації печінки[351][361][362], та трансплантації печінкових органоїдів[362][363] і біоштучних пристроїв печінки[364][365].
- Персоналізована медицина: органоїди печінки, отримані з клітин пацієнта, дають змогу використовувати персоналізовані підходи до медицини. Використовуючи власні клітини пацієнта для створення органоїдів, дослідники можуть перевіряти реакцію на ліки та розробляти індивідуальні методи лікування захворювань печінки.[354][355]
- Дослідження розвитку печінки: органоїди печінки дають змогу зрозуміти розвиток печінки та органогенез. Дослідники можуть досліджувати процеси диференціації гепатобластів, формування жовчних проток і дозрівання печінки.[99][366]
- Токсикологічні дослідження: ці органоїди є цінними інструментами для вивчення впливу токсинів, хімічних речовин та інших ксенобіотиків на печінку. Вони можуть допомогти визначити потенційну небезпеку та оцінити безпеку різних сполук.[367][368]
Органоїд підшлункової залози[ред. | ред. код]
Органоїди підшлункової залози відтворюють клітинне різноманіття та функціональність підшлункової залози, включаючи типи ендокринних та екзокринних клітин, й стромальних компонентів.[369] Органоїди підшлункової залози дають цінну інформацію про розвиток підшлункової залози, моделювання захворювань, тестування ліків і відкривають цінні можливості для регенеративної медицини.
Застосування[ред. | ред. код]
- Моделювання захворювань: Органоїди підшлункової залози відіграли важливу роль у вивченні захворювань підшлункової залози[370], таких як цукровий діабет[371][372], панкреатит[373][374], муковісцидоз[373][375] і рак підшлункової залози[376][377][378][379]. Дослідники можуть індукувати мутації, специфічні для захворювання, або піддавати органоїди впливу середовища, пов’язаного з епігеномними змінами при захворюваннях, щоб зрозуміти механізми захворювання.
- Скринінг ліків: фармацевтичні компанії використовують органоїди підшлункової залози, які можуть точніше передбачати реакцію на ліки, ніж традиційні двовимірні клітинні культури, допомагаючи ідентифікувати потенційні терапевтичні засоби.[380][381][382][383][384]
- Регенеративна медицина: органоїди підшлункової залози можуть бути джерелом клітин-попередників підшлункової залози для трансплантації, потенційно забезпечуючи лікування цукрового діабету 1 типу, відновлюючи популяцію острівців Лангерганса з бета-клітинами, продукуючих інсулін, в тілі.[371][385][386][387][388][389][390][391] (див. також Трансплантація підшлункової залози) Також, дослідження 2023 року показало можливість оптогенетичного[en] контролю виділення інсуліну трансплантованими миші органоїдами підшлункової залози.[392]
- Персоналізована медицина: Органоїди підшлункової залози, отримані зі специфічних клітин пацієнта, дозволяють використовувати підходи до персоналізованої медицини. Дослідники можуть перевірити реакцію на ліки на органоїдах, створених із власних клітин пацієнта, пристосовуючи лікування до індивідуальних потреб.[379][393][394]
Органоїд нирок[ред. | ред. код]

Органоїди нирок імітують нефронові структури нирки, включаючи клубочки та ниркові канальці.[101][102][395][396][397]
Застосування[ред. | ред. код]
- Біологія розвитку: органоїди нирок дозволяють вивчати розвиток і диференціювання нирок, проливаючи світло на молекулярні механізми, які керують формуванням і функцією нирок.[398][399][400]
- Моделювання захворювань: Дослідники використовують органоїди нирок для вивчення захворювань, пов’язаних з нирками[401][402][403], таких як полікістоз нирок[404][405], нефротичний синдром[406][407][408], вроджені захворювання нирок[409] та ін. Впроваджуючи специфічні для захворювання мутації або клітини, отримані від пацієнтів, вчені отримують уявлення про механізми захворювання та потенційні методи лікування.
- Скринінг і розробка ліків.[410][411]
- Випробування на нефротоксичність: органоїди нирок використовуються для оцінки нефротоксичності ліків і хімічних речовин, що допомагає ідентифікувати речовини, які можуть пошкодити нирки.[412][413][414]
- Персоналізована медицина: використовуючи клітини, отримані від пацієнтів, дослідники прагнуть розробити персоналізоване лікування, максимально ефективне для конкретного пацієнта.[415][416]
- Регенеративна медицина[417][418] та трансплантації нирок[419][420][421][422]. Щоб підвищити функціональність органоїдів нирок, зусилля зосереджені на покращенні васкуляризації та інтеграції з тканиною господаря, що зробить їх більш придатними для трансплантації та регенеративної медицини.
Органоїд легень[ред. | ред. код]
Органоїди легень – це складні тривимірні моделі in vitro, які імітують структуру та функцію легенів людини[423] чи тварин[424]. Ці мініатюрні структури стали безцінними інструментами для різноманітних біомедичних застосувань, пропонуючи уявлення про розвиток легень[425][426][427], моделювання захворювань, скринінг ліків і потенційну регенеративну терапію.[428][429]
Легеневі органоїди, зазвичай, утворюють з індукованих плюрипотентних, ембріональних і дорослих стовбурових клітин. Сигнальні шляхи TGF-β/BMP/SMAD, FGF і Wnt/β-катеніну підтримують розвиток легеневих органоїдів.[426] Легеневі органоїди містять різноманітність клітин легенів, включаючи клітини бронхів, альвеол та різні типи клітин, такі як епітеліальні, мезенхімальні та імунні[430] клітини.
Застосування[ред. | ред. код]
- Моделювання захворювань: Дослідники використовують легеневі органоїди для вивчення захворювань легенів[106], включаючи хронічне обструктивне захворювання легень (ХОЗЛ)[431][432], ідіопатичний легеневий фіброз[433], респіраторні інфекції[434], муковісцидоз[435], рак легень[436] та ін. Впроваджуючи специфічні для хвороби мутації або піддаючи органоїди дії факторів, пов’язаних із хворобою, вчені отримують уявлення про механізми хвороби. Також, легеневі органоїди відіграють важливу роль у вивченні респіраторних інфекцій, таких як грип[437] і SARS‐CoV‐2[437][438][439]. Вони створюють контрольоване середовище для дослідження взаємодії вірусу та господаря та тестування противірусних методів лікування.
- Скринінг ліків та персоналізована медицина[440][441][442][443][444][445]
- Регенеративна медицина. Легеневі органоїди є перспективними для регенеративної медицини, зокрема у відновленні пошкодженої легеневої тканини. Дослідники прагнуть створити функціональну легеневу тканину для трансплантації, що потенційно принесе користь пацієнтам із термінальною стадією захворювань легенів.[446][447]
Органоїд серця[ред. | ред. код]
Органоїди серця — це складні тривимірні структури, створені для повторення архітектури та функції серця.[109][110][448] Серцеві органоїди зазвичай створюють із плюрипотентних стовбурових клітин людини, таких як індуковані плюрипотентні стовбурові клітини або ембріональні стовбурові клітини. Ці органоїди мають на меті імітувати складність людського серця, включаючи різні типи клітин, такі як кардіоміоцити, фібробласти, перицити та ендотеліальні клітини.[449][450] Епікардіоіди — новітні моделі серцевих органоїдів, що імітують структуру як міокарда, так і епікарда.[451]
Застосування[ред. | ред. код]
- Моделювання розвитку та захворювань: Дослідники використовують серцеві органоїди для вивчення нормального розвитку[452] та моделювання різних захворювань серця[453][454], таких як кардіоміопатії[455][456], вроджені вади серця[457][458], аритмії[459], інфаркт міокарда[460], серцева недостатність[461] та інших[462]. Впроваджуючи специфічні для захворювання генетичні мутації або використовуючи клітини, взяті у пацієнтів, вчені отримують уявлення про механізми захворювання та потенційні терапевтичні цілі.
- Скринінг і розробка ліків.[463][464][465]
- Регенеративна медицина: Серцеві органоїди досліджуються на предмет можливості активації сигнальних шляхів, відповідальних за регенерацію в серці[449][463][466], а також через їхній потенціал у безпосередньому відновленні пошкодженої тканини серця, наприклад, після інфаркту міокарда[82]. Досягнення належної васкуляризації та інтеграції з тканиною господаря має важливе значення для функціональності серцевих органоїдів. Дослідники зосереджуються на вдосконаленні цих аспектів, щоб зробити їх більш придатними для трансплантації та регенеративної терапії.[450]
- Електрофізіологічні дослідження: Серцеві органоїди забезпечують платформу для електрофізіологічних досліджень, допомагаючи зрозуміти порушення серцевого ритму. Ці моделі дозволяють дослідникам досліджувати, як кардіоміоцити скорочуються та електрично спілкуються.[467][468][469]
Органоїди сітківки[ред. | ред. код]

Органоїди сітківки — це тривимірні in vitro моделі сітківки людини, які пропонують цінну платформу для вивчення розвитку сітківки[471], захворювань і потенційних терапевтичних втручань.[114][115][472][473][474]
Органоїди сітківки також отримують із плюрипотентних стовбурових клітин, таких як індуковані плюрипотентні стовбурові клітини або ембріональні стовбурові клітини. Вони повторюють складну структуру сітківки людини, включаючи різні типи клітин сітківки, такі як фоторецептори[475], гангліозні клітини сітківки та глія Мюллера.[159][161][476][477]
Застосування[ред. | ред. код]
- Моделювання захворювань. Дослідники використовують органоїди сітківки для моделювання різних захворювань сітківки[478][479], включаючи пігментний ретиніт[480][481][482][483][484], вікову дегенерацію жовтої плями (макулодистрофія)[485][486], глаукому[487][488] та інші. Завдяки таким органоїдам, вчені можуть отримати уявлення про механізми захворювання та перевірити потенційні методи лікування.
- Скринінг і розробка ліків, токсикологічні дослідження.[489][490][490][491] Також, органоїди сітківки та органоїди-на-чипі сітківки використовуються для моделювання внутрішньоочної доставки ліків.[492]
- Регенеративна медицина: Науковці досліджують можливість трансплантації клітин сітківки, отриманих з органоїдів, пацієнтам з захворюваннями сітківки для відновлення зору.[493][494][495][496][497] Також, деякі дослідження вивчають використання органоїдів сітківки для дослідження регенерації зорового нерва, що є складним аспектом лікування нейропатій зорового нерва. Відновлення зору в пацієнтів, які осліпли внаслідок пізніх нейропатій зорового нерва, потребує технологій, які можуть або врятувати пошкоджені та запобігти подальшій дегенерації гангліозних клітин сітківки, або замінити втрачені гангліозні клітини, — і органоїди сітківки є перспективним джерелом цих клітин.[498][499][500] Також, у 2023 році було представлено прецизійну роботизовану платформу культур клітин Cell X для ефективного виробництва специфічних для пацієнта іПСК і органоїдів сітківки, демонструючи потенціал для клінічного конвеєрного виробництва іПСК для аутологічної заміни клітин сітківки.[80]
- Редагування генів: Інструмент редагування генів CRISPR-Cas9 застосовується до органоїдів сітківки для виправлення хвороботворних мутацій або введення певних генетичних модифікацій. Це дозволяє вивчати функцію генів і потенційні методи редагування генома та генотерапії при офтальмологічних патологіях.[480]
Органоїд язика[ред. | ред. код]
Язикові (лінгвальні) органоїди — це органоїди, які повторюють, принаймні частково, аспекти фізіології язика. Епітеліальні язикові органоїди були створені з використанням BMI1, що експресують епітеліальні стовбурові клітини в умовах тривимірної культури за допомогою маніпуляції з EGF, WNT і TGF-β.[501] Однак ця органоїдна культура не має смакових рецепторів, оскільки ці клітини не виникають із епітеліальних стовбурових клітин, що експресують Bmi1.[501] Органоїди язикової смакової бруньки, що містять смакові клітини, однак, були створені з використанням стовбурових/прогеніторних клітин LGR5+ або CD44+ тканини циркумваллятного (CV) сосочка.[502] Ці органоїди смакових рецепторів були успішно створені безпосередньо з ізольованих стовбурових клітин/клітин-попередників, що експресують смак Lgr5- або LGR6.[503] і опосередковано, через виділення та подальше культивування тканини циркумваллятного сосочка, що містить Lgr5+ або CD44+ стовбурові клітини/клітини-попередники.[502] Суспензійно-культивовані органоїди можуть забезпечити ефективну модель для імітації смакових рецепторів in vivo порівняно зі звичайними органоїдами культивованими в Matrigel.[504]
Інші типи органоїдів[ред. | ред. код]
- Органоїд щитоподібної залози[505][506][507][508]
- Органоїд тимуса[509][510]
- Тестикулярний органоїд[511][512][513][514]
- Органоїд простати[515][516][517][518]
- Епітеліальний органоїд[519][520] (ендометрію матки[521], носу[522])
- Бластоїд[523]
- Ендометріальний органоїд[524][525][526] та асемблоїд[527]
- Органоїд судин[113]
- Органоїд шкіри[528]
- Органоїд гематоенцефалічного бар'єру[529][530][531][532]
Окрім органоїдів, останнім часом з’явилися інші більш складні 3D-моделі, які набувають великої популярності. Обробка тривимірних агрегатів стовбурових клітин Wnt призводить до порушення симетрії з подальшим поляризованим ростом щодо трьох ортогональних осей.[533] Цей процес формує подовжені тривимірні структури, так звані «гаструлоїди[en]».[534]
Асемблоїди — це тривимірні системи клітинної культури, які є результатом інтеграції декількох типів органоїдів, або містять спеціалізовані типи клітин і демонструють особливості самоорганізації.[165][166][167][527]
Див. також[ред. | ред. код]
- Тканинна інженерія
- Друк органів
- Регенеративна медицина
- Біомедична інженерія
- Інженерія нервової тканини
- Орган на чипі
- Стовбурові клітини
- Культура клітин
Додаткова література[ред. | ред. код]
Книги[ред. | ред. код]
- K. Paul, Manash, ред. (28 вересня 2022). Organoid Bioengineering - Advances, Applications and Challenges. Biomedical Engineering (англ.) 13. IntechOpen. ISBN 978-1-80355-768-7.
- Yahaya, Badrul Hisham, ред. (2022). Organoid Technology for Disease Modelling and Personalized Treatment. Stem Cell Biology and Regenerative Medicine (англ.) 71. Cham: Springer International Publishing, Springer Nature. ISBN 978-3-030-93055-4.
- Spence, Jason R., ред. (2020). Human Pluripotent Stem Cell Derived Organoid Models. Methods in Cell Biology (1st edition). Cambridge, MA San Diego, CA Oxford London: Academic Press, an imprint of Elsevier. ISBN 978-0-12-821531-9.
- Turksen, Kursad, ред. (2019). Organoids: stem cells, structure, and function. Methods in molecular biology. New York, NY: Humana Press, Springer. ISBN 978-1-4939-7616-4.
Журнали[ред. | ред. код]
- Organoid
- Cell Stem Cell (сайт, Cell Press)
- Stem Cell Reports (сайт, Cell Press)
Статті[ред. | ред. код]
- Vandana, J. Jeya; Manrique, Cassandra; Lacko, Lauretta A.; Chen, Shuibing (2023-05). Human pluripotent-stem-cell-derived organoids for drug discovery and evaluation. Cell Stem Cell 30 (5). doi:10.1016/j.stem.2023.04.011.
- Suhito, Intan Rosalina; Kim, Tae-Hyung (25 квітня 2022). Recent advances and challenges in organoid-on-a-chip technology. Organoid (англ.) 2. doi:10.51335/organoid.2022.2.e4.
- Lee, Hanbyeol. Trends in the global organoid technology and industry: from organogenesis in a dish to the commercialization of organoids : [англ.] / Hanbyeol Lee, Jeong Suk Im, Da Bin Choi [et al.] // Organoid. — 2021. — Vol. 1 (15 July). — DOI:10.51335/organoid.2021.1.e11.
- Corrò, Claudia. A brief history of organoids : [англ.] / Claudia Corrò, Laura Novellasdemunt, Vivian S.W. Li // American Journal of Physiology-Cell Physiology. — 2020. — Vol. 319, no. 1 (1 July). — P. 151–165. — DOI:10.1152/ajpcell.00120.2020.
Посилання[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ https://www.sciencealert.com/this-mini-brain-is-made-from-real-tissue-and-it-has-huge-potential
- ↑ а б в г д е ж Zhao, Zixuan; Chen, Xinyi; Dowbaj, Anna M.; Sljukic, Aleksandra; Bratlie, Kaitlin; Lin, Luda; Fong, Eliza Li Shan; Balachander, Gowri Manohari; Chen, Zhaowei (1 грудня 2022). Organoids. Nature Reviews Methods Primers (англ.). Т. 2, № 1. с. 1—21. doi:10.1038/s43586-022-00174-y. ISSN 2662-8449. PMC 10270325. PMID 37325195. Процитовано 2 вересня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б в г д е Hofer, Moritz; Lutolf, Matthias P. (2021-05). Engineering organoids. Nature Reviews Materials (англ.). Т. 6, № 5. с. 402—420. doi:10.1038/s41578-021-00279-y. ISSN 2058-8437. Процитовано 2 вересня 2023.
- ↑ а б в г д е ж Tang, Xiao-Yan; Wu, Shanshan; Wang, Da; Chu, Chu; Hong, Yuan; Tao, Mengdan; Hu, Hao; Xu, Min; Guo, Xing (24 травня 2022). Human organoids in basic research and clinical applications. Signal Transduction and Targeted Therapy (англ.). Т. 7, № 1. с. 1—17. doi:10.1038/s41392-022-01024-9. ISSN 2059-3635. Процитовано 3 вересня 2023.
- ↑ Mullard, Asher (16 лютого 2023). Mini-organs attract big pharma. Nature Reviews Drug Discovery (англ.). Т. 22, № 3. с. 175—176. doi:10.1038/d41573-023-00030-y. Процитовано 2 вересня 2023.
- ↑ NIAID scientists develop “mini-brain” model of human prion disease. National Institutes of Health (NIH) (EN) . 14 червня 2019. Процитовано 3 вересня 2023.
- ↑ а б в Simian, Marina; Bissell, Mina J. (28 грудня 2016). Organoids: A historical perspective of thinking in three dimensions. Journal of Cell Biology. Т. 216, № 1. с. 31—40. doi:10.1083/jcb.201610056. ISSN 0021-9525. PMC 5223613. PMID 28031422. Процитовано 2 вересня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б в г Lancaster, Madeline A.; Knoblich, Juergen A. (18 липня 2014). Organogenesis in a dish: Modeling development and disease using organoid technologies. Science (англ.). Т. 345, № 6194. doi:10.1126/science.1247125. ISSN 0036-8075.
- ↑ Wilson, H. V. (7 червня 1907). A New Method by Which Sponges May Be Artificially Reared. Science (англ.). Т. 25, № 649. с. 912—915. doi:10.1126/science.25.649.912.
- ↑ De Morgan, W.; Drew, late G. Harold (1914-10). A Study of the Restitution Masses formed by the Dissociated Cells of the Hydroids Antennularia Ramosa and A. Antennina. Journal of the Marine Biological Association of the United Kingdom (англ.). Т. 10, № 3. с. 440—463. doi:10.1017/S0025315400008237. ISSN 0025-3154.
- ↑ Holtfreter J (1944). Experimental studies on the development of the pronephros. Rev. Can. Biol. 3: 220—250.
- ↑ Holtfreter J. 1948. The mechanism of embryonic induction and its relation to parthenogenesis and malignancy. In Symposia of the Society for Experimental Biology. Cambridge University Press, Cambridge, England, UK. 17.
- ↑ Corrò et al., 2020, с. ?.
- ↑ а б Experimental studies on the differentiation of embryonic tissues growing in vivo and in vitro.—II. The development of the isolated early embryonic eye of the fowl when cultivated in vitro. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character (англ.). Т. 100, № 703. 1926-09. с. 273—283. doi:10.1098/rspb.1926.0049. ISSN 0950-1193.
- ↑ а б Fell, Honor Bridget; Robison, Robert (1 січня 1929). The growth, development and phosphatase activity of embryonic avian femora and limb-buds cultivated in vitro. Biochemical Journal (англ.). Т. 23, № 4. с. 767—784.5. doi:10.1042/bj0230767. ISSN 0306-3283.
- ↑ Trowell, O. A. (1 січня 1954). A modified technique for organ culture in vitro. Experimental Cell Research. Т. 6, № 1. с. 246—248. doi:10.1016/0014-4827(54)90169-X. ISSN 0014-4827.
- ↑ Trowell, O. A. (1955-03). EXPERIMENTS ON LYMPH NODES COLTURED IN VITRO. Annals of the New York Academy of Sciences (англ.). Т. 59, № 5. с. 1066—1069. doi:10.1111/j.1749-6632.1955.tb46002.x.
- ↑ Moscona, A.; Moscona, H. (1952-07). The dissociation and aggregation of cells from organ rudiments of the early chick embryo. Journal of Anatomy. Т. 86, № Pt 3. с. 287—301. ISSN 0021-8782. PMC 1273752. PMID 12980879.
- ↑ Moscona, A. A. (1959-05). Tissues from Dissociated Cells. Scientific American. Т. 200, № 5. с. 132—144. doi:10.1038/scientificamerican0559-132. ISSN 0036-8733.
- ↑ Moscona, A. (1 січня 1961). Rotation-mediated histogenetic aggregation of dissociated cells: A quantifiable approach to cell interactions in vitro. Experimental Cell Research. Т. 22. с. 455—475. doi:10.1016/0014-4827(61)90122-7. ISSN 0014-4827.
- ↑ Steinberg, M. S. (1 листопада 1962). The role of temperature in the control of aggregation of dissociated embryonic cells. Experimental Cell Research. Т. 28, № 1. с. 1—10. doi:10.1016/0014-4827(62)90306-3. ISSN 0014-4827.
- ↑ Hayes, Raymond L. (1 січня 1965). An in vitro technique for reaggregation of dissociated tissue in a centrifugal field. Experimental Cell Research. Т. 37, № 1. с. 1—11. doi:10.1016/0014-4827(65)90152-7. ISSN 0014-4827.
- ↑ Huzella T. 1932. Orientation de la croissance des cultures de tissus sur la trame fibrillaire artificielle coagulée de la solution de collagène. SAC r. Soc. Biol. Paris. 109:515.
- ↑ Ehrmann, R. L.; Gey, G. O. (1956-06). The growth of cells on a transparent gel of reconstituted rat-tail collagen. Journal of the National Cancer Institute. Т. 16, № 6.
- ↑ Lasfargues, Etienne Y. (1957-01). Cultivation and behavior in vitro of the normal mammary epithelium of the adult mouse. The Anatomical Record (англ.). Т. 127, № 1. с. 117—129. doi:10.1002/ar.1091270111. ISSN 0003-276X.
- ↑ Berry, M. N.; Friend, D. S. (1 грудня 1969). HIGH-YIELD PREPARATION OF ISOLATED RAT LIVER PARENCHYMAL CELLS. The Journal of Cell Biology. Т. 43, № 3. с. 506—520. doi:10.1083/jcb.43.3.506.
- ↑ Michalopoulos, G.; Pitot, H.C. (1975-08). Primary culture of parenchymal liver cells on collagen membranes. Experimental Cell Research (англ.). Т. 94, № 1. с. 70—78. doi:10.1016/0014-4827(75)90532-7.
- ↑ Emerman, Joanne T.; Pitelka, Dorothy R. (1 травня 1977). Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro (англ.). Т. 13, № 5. с. 316—328. doi:10.1007/BF02616178.
- ↑ Kleinman, Hynda K.; Martin, George R. (1 жовтня 2005). Matrigel: Basement membrane matrix with biological activity. Seminars in Cancer Biology. Т. 15, № 5. с. 378—386. doi:10.1016/j.semcancer.2005.05.004.
- ↑ Kim, Suran; Min, Sungjin; Choi, Yi Sun; Jo, Sung-Hyun; Jung, Jae Hun; Han, Kyusun; Kim, Jin; An, Soohwan; Ji, Yong Woo (30 березня 2022). Tissue extracellular matrix hydrogels as alternatives to Matrigel for culturing gastrointestinal organoids. Nature Communications (англ.). Т. 13, № 1. с. 1692. doi:10.1038/s41467-022-29279-4.
- ↑ Kozlowski, Mark T.; Crook, Christiana J.; Ku, Hsun Teresa (10 грудня 2021). Towards organoid culture without Matrigel. Communications Biology (англ.). Т. 4, № 1. с. 1—15. doi:10.1038/s42003-021-02910-8.
- ↑ Evans, M. J.; Kaufman, M. H. (1981-07). Establishment in culture of pluripotential cells from mouse embryos. Nature (англ.). Т. 292, № 5819. с. 154—156. doi:10.1038/292154a0. ISSN 1476-4687.
- ↑ Martin, G R (1981-12). Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proceedings of the National Academy of Sciences (англ.). Т. 78, № 12. с. 7634—7638. doi:10.1073/pnas.78.12.7634.
- ↑ Chambard, M; Gabrion, J; Mauchamp, J (1 жовтня 1981). Influence of collagen gel on the orientation of epithelial cell polarity: follicle formation from isolated thyroid cells and from preformed monolayers. The Journal of Cell Biology (англ.). Т. 91, № 1. с. 157—166. doi:10.1083/jcb.91.1.157.
- ↑ Bissell, Mina J.; Hall, H. Glenn; Parry, Gordon (7 листопада 1982). How does the extracellular matrix direct gene expression?. Journal of Theoretical Biology. Т. 99, № 1. с. 31—68. doi:10.1016/0022-5193(82)90388-5.
- ↑ Lee, E Y; Parry, G; Bissell, M J (1 січня 1984). Modulation of secreted proteins of mouse mammary epithelial cells by the collagenous substrata. The Journal of Cell Biology. Т. 98, № 1. с. 146—155. doi:10.1083/jcb.98.1.146.
- ↑ Hadley, M A; Byers, S W; Suárez-Quian, C A; Kleinman, H K; Dym, M (1 жовтня 1985). Extracellular matrix regulates Sertoli cell differentiation, testicular cord formation, and germ cell development in vitro. The Journal of Cell Biology (англ.). Т. 101, № 4. с. 1511—1522. doi:10.1083/jcb.101.4.1511.
- ↑ Li, M L; Aggeler, J; Farson, D A; Hatier, C; Hassell, J; Bissell, M J (1987-01). Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells. Proceedings of the National Academy of Sciences (англ.). Т. 84, № 1. с. 136—140. doi:10.1073/pnas.84.1.136.
- ↑ Schuetz, Erin G.; Li, Donna; Omiecinski, Curtis J.; Muller-Eberhard, Ursula; Kleinman, Hynda K.; Elswick, Barbara; Guzelian, Philip S. (1988-03). Regulation of gene expression in adult rat hepatocytes cultured on a basement membrane matrix. Journal of Cellular Physiology (англ.). Т. 134, № 3. с. 309—323. doi:10.1002/jcp.1041340302.
- ↑ Streuli, C H; Bissell, M J (1 квітня 1990). Expression of extracellular matrix components is regulated by substratum. The Journal of Cell Biology (англ.). Т. 110, № 4. с. 1405—1415. doi:10.1083/jcb.110.4.1405.
- ↑ Schmidhauser, C; Bissell, M J; Myers, C A; Casperson, G F (1990-12). Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proceedings of the National Academy of Sciences (англ.). Т. 87, № 23. с. 9118—9122. doi:10.1073/pnas.87.23.9118.
- ↑ Schmidhauser, C; Casperson, G F; Myers, C A; Sanzo, K T; Bolten, S; Bissell, M J (1992-06). A novel transcriptional enhancer is involved in the prolactin- and extracellular matrix-dependent regulation of beta-casein gene expression. Molecular Biology of the Cell (англ.). Т. 3, № 6. с. 699—709. doi:10.1091/mbc.3.6.699.
- ↑ Streuli, C H; Schmidhauser, C; Bailey, N; Yurchenco, P; Skubitz, A P; Roskelley, C; Bissell, M J (1 травня 1995). Laminin mediates tissue-specific gene expression in mammary epithelia. The Journal of Cell Biology (англ.). Т. 129, № 3. с. 591—603. doi:10.1083/jcb.129.3.591.
- ↑ Muschler, John; Lochter, André; Roskelley, Calvin D.; Yurchenco, Peter; Bissell, Mina J. (1999-09). Nelson, W. James (ред.). Division of Labor among the α6β4 Integrin, β1 Integrins, and an E3 Laminin Receptor to Signal Morphogenesis and β-Casein Expression in Mammary Epithelial Cells. Molecular Biology of the Cell (англ.). Т. 10, № 9. с. 2817—2828. doi:10.1091/mbc.10.9.2817.
- ↑ Streuli, C H; Bailey, N; Bissell, M J (1 грудня 1991). Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. The Journal of Cell Biology (англ.). Т. 115, № 5. с. 1383—1395. doi:10.1083/jcb.115.5.1383.
- ↑ Simian, Marina; Hirai, Yohei; Navre, Marc; Werb, Zena; Lochter, Andre; Bissell, Mina J. (15 серпня 2001). The interplay of matrix metalloproteinases, morphogens and growth factors is necessary for branching of mammary epithelial cells. Development. Т. 128, № 16. с. 3117—3131. doi:10.1242/dev.128.16.3117.
- ↑ Nelson, Celeste M.; VanDuijn, Martijn M.; Inman, Jamie L.; Fletcher, Daniel A.; Bissell, Mina J. (13 жовтня 2006). Tissue Geometry Determines Sites of Mammary Branching Morphogenesis in Organotypic Cultures. Science (англ.). Т. 314, № 5797. с. 298—300. doi:10.1126/science.1131000.
- ↑ Nahmias, Yaakov; Schwartz, Robert E.; Hu, Wei-Shou; Verfaillie, Catherine M.; Odde, David J. (2006-06). Endothelium-Mediated Hepatocyte Recruitment in the Establishment of Liver-like Tissue In Vitro. Tissue Engineering. Т. 12, № 6. с. 1627—1638. doi:10.1089/ten.2006.12.1627.
- ↑ Yong, Ed (28 серпня 2013). Lab-Grown Model Brains. The Scientist. Процитовано 26 грудня 2013.
- ↑ а б Sato, Toshiro; Vries, Robert G.; Snippert, Hugo J.; van de Wetering, Marc; Barker, Nick; Stange, Daniel E.; van Es, Johan H.; Abo, Arie; Kujala, Pekka (2009-05). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature (англ.). Т. 459, № 7244. с. 262—265. doi:10.1038/nature07935.
- ↑ а б Barker, Nick; Huch, Meritxell; Kujala, Pekka; van de Wetering, Marc; Snippert, Hugo J.; van Es, Johan H.; Sato, Toshiro; Stange, Daniel E.; Begthel, Harry (2010-01). Lgr5+ve Stem Cells Drive Self-Renewal in the Stomach and Build Long-Lived Gastric Units In Vitro. Cell Stem Cell (англ.). Т. 6, № 1. с. 25—36. doi:10.1016/j.stem.2009.11.013.
- ↑ Huch, Meritxell; Bonfanti, Paola; Boj, Sylvia F; Sato, Toshiro; Loomans, Cindy J M; van de Wetering, Marc; Sojoodi, Mozhdeh; Li, Vivian S W; Schuijers, Jurian (17 вересня 2013). Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. The EMBO Journal. Т. 32, № 20. с. 2708—2721. doi:10.1038/emboj.2013.204.
- ↑ Sato, Toshiro; Stange, Daniel E.; Ferrante, Marc; Vries, Robert G.J.; van Es, Johan H.; van den Brink, Stieneke; van Houdt, Winan J.; Pronk, Apollo; van Gorp, Joost (2011-11). Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium. Gastroenterology (англ.). Т. 141, № 5. с. 1762—1772. doi:10.1053/j.gastro.2011.07.050.
- ↑ Huch, Meritxell; Dorrell, Craig; Boj, Sylvia F.; van Es, Johan H.; Li, Vivian S. W.; van de Wetering, Marc; Sato, Toshiro; Hamer, Karien; Sasaki, Nobuo (14 лютого 2013). In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature (англ.). Т. 494, № 7436. с. 247—250. doi:10.1038/nature11826.
- ↑ Eiraku, Mototsugu; Watanabe, Kiichi; Matsuo-Takasaki, Mami; Kawada, Masako; Yonemura, Shigenobu; Matsumura, Michiru; Wataya, Takafumi; Nishiyama, Ayaka; Muguruma, Keiko (2008-11). Self-Organized Formation of Polarized Cortical Tissues from ESCs and Its Active Manipulation by Extrinsic Signals. Cell Stem Cell (англ.). Т. 3, № 5. с. 519—532. doi:10.1016/j.stem.2008.09.002.
- ↑ Eiraku, Mototsugu; Takata, Nozomu; Ishibashi, Hiroki; Kawada, Masako; Sakakura, Eriko; Okuda, Satoru; Sekiguchi, Kiyotoshi; Adachi, Taiji; Sasai, Yoshiki (2011-04). Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature (англ.). Т. 472, № 7341. с. 51—56. doi:10.1038/nature09941.
- ↑ Nakano, Tokushige; Ando, Satoshi; Takata, Nozomu; Kawada, Masako; Muguruma, Keiko; Sekiguchi, Kiyotoshi; Saito, Koichi; Yonemura, Shigenobu; Eiraku, Mototsugu (2012-06). Self-Formation of Optic Cups and Storable Stratified Neural Retina from Human ESCs. Cell Stem Cell (англ.). Т. 10, № 6. с. 771—785. doi:10.1016/j.stem.2012.05.009.
- ↑ Unbekandt, Mathieu; Davies, Jamie A. (2010-03). Dissociation of embryonic kidneys followed by reaggregation allows the formation of renal tissues. Kidney International. Т. 77, № 5. с. 407—416. doi:10.1038/ki.2009.482.
- ↑ Takahashi, Kazutoshi; Яманака Сін'я (2006-08). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. Т. 126, № 4. с. 663—676. doi:10.1016/j.cell.2006.07.024.
- ↑ Takahashi, Kazutoshi; Tanabe, Koji; Ohnuki, Mari; Narita, Megumi; Ichisaka, Tomoko; Tomoda, Kiichiro; Яманака Сін'я (2007-11). Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell (англ.). Т. 131, № 5. с. 861—872. doi:10.1016/j.cell.2007.11.019.
- ↑ Yu, Junying; Vodyanik, Maxim A.; Smuga-Otto, Kim; Antosiewicz-Bourget, Jessica; Frane, Jennifer L.; Tian, Shulan; Nie, Jeff; Jonsdottir, Gudrun A.; Ruotti, Victor (21 грудня 2007). Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells. Science (англ.). Т. 318, № 5858. с. 1917—1920. doi:10.1126/science.1151526.
- ↑ Park, In-Hyun; Lerou, Paul H; Zhao, Rui; Huo, Hongguang; Daley, George Q (2008-07). Generation of human-induced pluripotent stem cells. Nature Protocols (англ.). Т. 3, № 7. с. 1180—1186. doi:10.1038/nprot.2008.92.
- ↑ Xu, Ziran; Yang, Jiaxu; Xin, Xianyi; Liu, Chengrun; Li, Lisha; Mei, Xianglin; Li, Meiying (2023). Merits and challenges of iPSC-derived organoids for clinical applications. Frontiers in Cell and Developmental Biology. Т. 11. doi:10.3389/fcell.2023.1188905.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Lancaster, Madeline A.; Renner, Magdalena; Martin, Carol-Anne; Wenzel, Daniel; Bicknell, Louise S.; Hurles, Matthew E.; Homfray, Tessa; Penninger, Josef M.; Jackson, Andrew P. (19 вересня 2013). Cerebral organoids model human brain development and microcephaly. Nature (англ.). Т. 501, № 7467. с. 373—379. doi:10.1038/nature12517. Процитовано 2 вересня 2023.
- ↑ Peng, Haisheng; Poovaiah, Nitya; Forrester, Michael; Cochran, Eric; Wang, Qun (12 січня 2015). Ex Vivo Culture of Primary Intestinal Stem Cells in Collagen Gels and Foams. ACS Biomaterials Science & Engineering (англ.). Т. 1, № 1. с. 37—42. doi:10.1021/ab500041d.
- ↑ Peng, Haisheng; Wang, Chao; Xu, Xiaoyang; Yu, Chenxu; Wang, Qun (26 лютого 2015). An intestinal Trojan horse for gene delivery. Nanoscale (англ.). Т. 7, № 10. с. 4354—4360. doi:10.1039/C4NR06377E.
- ↑ Shkumatov, Artem; Baek, Kwanghyun; Kong, Hyunjoon (14 квіт. 2014 р.). Matrix Rigidity-Modulated Cardiovascular Organoid Formation from Embryoid Bodies. PLOS ONE (англ.). Т. 9, № 4. с. e94764. doi:10.1371/journal.pone.0094764.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Zhong, Xiufeng; Gutierrez, Christian; Xue, Tian; Hampton, Christopher; Vergara, M. Natalia; Cao, Li-Hui; Peters, Ann; Park, Tea Soon; Zambidis, Elias T. (10 червня 2014). Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications (англ.). Т. 5, № 1. с. 4047. doi:10.1038/ncomms5047.
- ↑ Takebe, Takanori; Enomura, Masahiro; Yoshizawa, Emi; Kimura, Masaki; Koike, Hiroyuki; Ueno, Yasuharu; Matsuzaki, Takahisa; Yamazaki, Takashi; Toyohara, Takafumi (2015-05). Vascularized and Complex Organ Buds from Diverse Tissues via Mesenchymal Cell-Driven Condensation. Cell Stem Cell. Т. 16, № 5. с. 556—565. doi:10.1016/j.stem.2015.03.004.
- ↑ Zhu, Yujuan; Wang, Li; Yu, Hao; Yin, Fangchao; Wang, Yaqing; Liu, Haitao; Jiang, Lei; Qin, Jianhua (22 серпня 2017). In situ generation of human brain organoids on a micropillar array. Lab on a Chip (англ.). Т. 17, № 17. с. 2941—2950. doi:10.1039/C7LC00682A.
- ↑ Method of the Year 2017: Organoids. Nature Methods (англ.). Т. 15, № 1. 2018-01. с. 1—1. doi:10.1038/nmeth.4575.
- ↑ а б Fatehullah, Aliya; Tan, Si Hui; Barker, Nick (2016-03). Organoids as an in vitro model of human development and disease. Nature Cell Biology (англ.). Т. 18, № 3. с. 246—254. doi:10.1038/ncb3312.
- ↑ а б Clevers, Hans (2016-06). Modeling Development and Disease with Organoids. Cell. Т. 165, № 7. с. 1586—1597. doi:10.1016/j.cell.2016.05.082.
- ↑ Calà, Giuseppe; Sina, Beatrice; De Coppi, Paolo; Giobbe, Giovanni Giuseppe; Gerli, Mattia Francesco Maria (2023). Primary human organoids models: Current progress and key milestones. Frontiers in Bioengineering and Biotechnology. Т. 11. doi:10.3389/fbioe.2023.1058970.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г Bao, Zhongyuan; Fang, Kaiheng; Miao, Zong; Li, Chong; Yang, Chaojuan; Yu, Qiang; Zhang, Chen; Miao, Zengli; Liu, Yan (22 листопада 2021). Human Cerebral Organoid Implantation Alleviated the Neurological Deficits of Traumatic Brain Injury in Mice. Oxidative Medicine and Cellular Longevity (англ.). Т. 2021. с. e6338722. doi:10.1155/2021/6338722.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Revah, Omer; Gore, Felicity; Kelley, Kevin W.; Andersen, Jimena; Sakai, Noriaki; Chen, Xiaoyu; Li, Min-Yin; Birey, Fikri; Yang, Xiao (2022-10). Maturation and circuit integration of transplanted human cortical organoids. Nature (англ.). Т. 610, № 7931. с. 319—326. doi:10.1038/s41586-022-05277-w.
- ↑ Wilson, Madison N.; Thunemann, Martin; Liu, Xin; Lu, Yichen та ін. (26 грудня 2022). Multimodal monitoring of human cortical organoids implanted in mice reveal functional connection with visual cortex. Nature Communications (англ.). Т. 13, № 1. doi:10.1038/s41467-022-35536-3.
{{cite news}}: Явне використання «та ін.» у:|first4=(довідка) - ↑ а б в г д Jgamadze, Dennis; Lim, James T.; Zhang, Zhijian; Harary, Paul M.; Germi, James; Mensah-Brown, Kobina; Adam, Christopher D.; Mirzakhalili, Ehsan; Singh, Shikha (2023-02). Structural and functional integration of human forebrain organoids with the injured adult rat visual system. Cell Stem Cell. Т. 30, № 2. с. 137—152.e7. doi:10.1016/j.stem.2023.01.004.
- ↑ а б в г Cao, Shi-Ying; Yang, Di; Huang, Zhen-Quan; Lin, Yu-Hui; Wu, Hai-Yin; Chang, Lei; Luo, Chun-Xia; Xu, Yun; Liu, Yan (30 травня 2023). Cerebral organoids transplantation repairs infarcted cortex and restores impaired function after stroke. npj Regenerative Medicine (англ.). Т. 8, № 1. с. 1—14. doi:10.1038/s41536-023-00301-7.
- ↑ а б в Bohrer, Laura R.; Stone, Nicholas E.; Mullin, Nathaniel K.; Voigt, Andrew P.; Anfinson, Kristin R.; Fick, Jessica L.; Luangphakdy, Viviane; Hittle, Bradley; Powell, Kimerly (28 лютого 2023). Automating iPSC generation to enable autologous photoreceptor cell replacement therapy. Journal of Translational Medicine (англ.). Т. 21, № 1. doi:10.1186/s12967-023-03966-2.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Kang, Soo‐Yeon; Kimura, Masaki; Shrestha, Sunil; Lewis, Phillip; Lee, Sangjoon; Cai, Yuqi; Joshi, Pranav; Acharya, Prabha; Liu, Jiafeng (24 серпня 2023). A Pillar and Perfusion Plate Platform for Robust Human Organoid Culture and Analysis. Advanced Healthcare Materials (англ.). doi:10.1002/adhm.202302502.
- ↑ а б Tan, Yu; Coyle, Robert C.; Barrs, Ryan W.; Silver, Sophia E.; Li, Mei; Richards, Dylan J.; Lin, Yiliang; Jiang, Yuanwen; Wang, Hongjun (4 серпня 2023). Nanowired human cardiac organoid transplantation enables highly efficient and effective recovery of infarcted hearts. Science Advances (англ.). Т. 9, № 31. doi:10.1126/sciadv.adf2898.
- ↑ Takasato, Minoru; Er, Pei X.; Chiu, Han S.; Little, Melissa H. (2016-09). Generation of kidney organoids from human pluripotent stem cells. Nature Protocols (англ.). Т. 11, № 9. с. 1681—1692. doi:10.1038/nprot.2016.098.
- ↑ Sachs, Norman; Papaspyropoulos, Angelos; Zomer‐van Ommen, Domenique D; Heo, Inha; Böttinger, Lena та ін. (15 лютого 2019). Long‐term expanding human airway organoids for disease modeling. The EMBO Journal (англ.). Т. 38, № 4. doi:10.15252/embj.2018100300.
{{cite news}}: Явне використання «та ін.» у:|last6=(довідка) - ↑ McCracken, Kyle W.; Catá, Emily M.; Crawford, Calyn M.; Sinagoga, Katie L.; Schumacher, Michael; Rockich, Briana E.; Tsai, Yu-Hwai; Mayhew, Christopher N.; Spence, Jason R. (2014-12). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature (англ.). Т. 516, № 7531. с. 400—404. doi:10.1038/nature13863.
- ↑ Huang, Kai; Li, Qiwei; Xue, Yufei; Wang, Qiong; Chen, Zaozao; Gu, Zhongze (1 жовтня 2023). Application of colloidal photonic crystals in study of organoids. Advanced Drug Delivery Reviews. Т. 201. с. 115075. doi:10.1016/j.addr.2023.115075.
- ↑ Yin, Xiaolei; Mead, Benjamin E.; Safaee, Helia; Langer, Robert; Karp, Jeffrey M.; Levy, Oren (2016-01). Engineering Stem Cell Organoids. Cell Stem Cell. Т. 18, № 1. с. 25—38. doi:10.1016/j.stem.2015.12.005.
- ↑ Ha, Jeongmin; Kang, Ji Su; Lee, Minhyung; Baek, Areum; Kim, Seongjun; Chung, Sun-Ku; Lee, Mi-Ok; Kim, Janghwan (2020). Simplified Brain Organoids for Rapid and Robust Modeling of Brain Disease. Frontiers in Cell and Developmental Biology. Т. 8. doi:10.3389/fcell.2020.594090.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Sun, Xin-Yao; Ju, Xiang-Chun; Li, Yang; Zeng, Peng-Ming; Wu, Jian; Zhou, Ying-Ying; Shen, Li-Bing; Dong, Jian; Chen, Yue-Jun (4 травня 2022). Gleeson, Joseph G (ред.). Generation of vascularized brain organoids to study neurovascular interactions. eLife. Т. 11. с. e76707. doi:10.7554/eLife.76707.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Jang, Hyunsoo; Kim, Seo Hyun; Koh, Youmin; Yoon, Ki-Jun (28 лютого 2022). Engineering Brain Organoids: Toward Mature Neural Circuitry with an Intact Cytoarchitecture. International Journal of Stem Cells (англ.). Т. 15, № 1. с. 41—59. doi:10.15283/ijsc22004.
- ↑ Jusop, Amirah Syamimi; Thanaskody, Kalaiselvaan; Tye, Gee Jun; Dass, Sylvia Annabel; Wan Kamarul Zaman, Wan Safwani; Nordin, Fazlina (2023). Development of brain organoid technology derived from iPSC for the neurodegenerative disease modelling: a glance through. Frontiers in Molecular Neuroscience. Т. 16. doi:10.3389/fnmol.2023.1173433. ISSN 1662-5099.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в D’Antoni, Chiara; Mautone, Lorenza; Sanchini, Caterina; Tondo, Lucrezia; Grassmann, Greta; Cidonio, Gianluca; Bezzi, Paola; Cordella, Federica; Di Angelantonio, Silvia (28 червня 2023). Unlocking Neural Function with 3D In Vitro Models: A Technical Review of Self-Assembled, Guided, and Bioprinted Brain Organoids and Their Applications in the Study of Neurodevelopmental and Neurodegenerative Disorders. International Journal of Molecular Sciences (англ.). Т. 24, № 13. с. 10762. doi:10.3390/ijms241310762.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Qu, Molong; Xiong, Liang; Lyu, Yulin; Zhang, Xiannian; Shen, Jie; Guan, Jingyang; Chai, Peiyuan; Lin, Zhongqing; Nie, Boyao (2021-03). Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research (англ.). Т. 31, № 3. с. 259—271. doi:10.1038/s41422-020-00453-x.
- ↑ Kardia, Egi; Frese, Michael; Smertina, Elena; Strive, Tanja; Zeng, Xi-Lei; Estes, Mary; Hall, Robyn N. (8 березня 2021). Culture and differentiation of rabbit intestinal organoids and organoid-derived cell monolayers. Scientific Reports (англ.). Т. 11, № 1. с. 5401. doi:10.1038/s41598-021-84774-w.
- ↑ Kasendra, Magdalena; Troutt, Misty; Broda, Taylor; Bacon, W. Clark; Wang, Timothy C.; Niland, Joyce C.; Helmrath, Michael A. (1 липня 2021). Intestinal organoids: roadmap to the clinic. American Journal of Physiology-Gastrointestinal and Liver Physiology (англ.). Т. 321, № 1. с. G1—G10. doi:10.1152/ajpgi.00425.2020.
- ↑ Taelman, Jasin; Diaz, Mònica; Guiu, Jordi (2022). Human Intestinal Organoids: Promise and Challenge. Frontiers in Cell and Developmental Biology. Т. 10. doi:10.3389/fcell.2022.854740.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Tanimizu, Naoki; Ichinohe, Norihisa; Sasaki, Yasushi; Itoh, Tohru; Sudo, Ryo; Yamaguchi, Tomoko; Katsuda, Takeshi; Ninomiya, Takafumi; Tokino, Takashi (7 червня 2021). Generation of functional liver organoids on combining hepatocytes and cholangiocytes with hepatobiliary connections ex vivo. Nature Communications (англ.). Т. 12, № 1. с. 3390. doi:10.1038/s41467-021-23575-1.
- ↑ а б в Liu, Qianglin; Zeng, Anqi; Liu, Zibo; Wu, Chunjie; Song, Linjiang (2022). Liver organoids: From fabrication to application in liver diseases. Frontiers in Physiology. Т. 13. doi:10.3389/fphys.2022.956244.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в Kim, Hyo Jin; Kim, Gyeongmin; Chi, Kyun Yoo; Kim, Hyemin; Jang, Yu Jin; Jo, Seongyea; Lee, Jihun; Lee, Youngseok; Woo, Dong-Hun (3 лютого 2023). Generation of multilineage liver organoids with luminal vasculature and bile ducts from human pluripotent stem cells via modulation of Notch signaling. Stem Cell Research & Therapy (англ.). Т. 14, № 1. doi:10.1186/s13287-023-03235-5.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Harrison, Sean P.; Siller, Richard; Tanaka, Yoshiaki; Chollet, Maria Eugenia; de la Morena-Barrio, María Eugenia; Xiang, Yangfei; Patterson, Benjamin; Andersen, Elisabeth; Bravo-Pérez, Carlos (1 вересня 2023). Scalable production of tissue-like vascularized liver organoids from human PSCs. Experimental & Molecular Medicine (англ.). с. 1—20. doi:10.1038/s12276-023-01074-1.
- ↑ а б Khoshdel-Rad, Niloofar; Ahmadi, Amin; Moghadasali, Reza (2022-02). Kidney organoids: current knowledge and future directions. Cell and Tissue Research (англ.). Т. 387, № 2. с. 207—224. doi:10.1007/s00441-021-03565-x.
- ↑ а б Kim, Hye-Youn; Yu, Seyoung; Choi, Yo Jun; Gee, Heon Yung (25 червня 2023). Kidney organoids: development and applications. Organoid (English) . Т. 3. doi:10.51335/organoid.2023.3.e10.
- ↑ Casamitjana, Joan; Espinet, Elisa; Rovira, Meritxell (2022). Pancreatic Organoids for Regenerative Medicine and Cancer Research. Frontiers in Cell and Developmental Biology. Т. 10. doi:10.3389/fcell.2022.886153.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Liu, Yuxiang; Li, Nianshuang; Zhu, Yin (2023-01). Pancreatic Organoids: A Frontier Method for Investigating Pancreatic-Related Diseases. International Journal of Molecular Sciences (англ.). Т. 24, № 4. с. 4027. doi:10.3390/ijms24044027.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Miller, Alyssa J.; Dye, Briana R.; Ferrer-Torres, Daysha; Hill, David R.; Overeem, Arend W.; Shea, Lonnie D.; Spence, Jason R. (2019-02). Generation of lung organoids from human pluripotent stem cells in vitro. Nature Protocols (англ.). Т. 14, № 2. с. 518—540. doi:10.1038/s41596-018-0104-8.
- ↑ а б Bosáková, Veronika; De Zuani, Marco; Sládková, Lucie; Garlíková, Zuzana; Jose, Shyam Sushama; Zelante, Teresa; Hortová Kohoutková, Marcela; Frič, Jan (2022). Lung Organoids—The Ultimate Tool to Dissect Pulmonary Diseases?. Frontiers in Cell and Developmental Biology. Т. 10. doi:10.3389/fcell.2022.899368.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Demchenko, Anna; Lavrov, Alexander; Smirnikhina, Svetlana (2022-12). Lung organoids: current strategies for generation and transplantation. Cell and Tissue Research (англ.). Т. 390, № 3. с. 317—333. doi:10.1007/s00441-022-03686-x.
- ↑ Hoang, Plansky; Wang, Jason; Conklin, Bruce R.; Healy, Kevin E.; Ma, Zhen (2018-04). Generation of spatial-patterned early-developing cardiac organoids using human pluripotent stem cells. Nature Protocols (англ.). Т. 13, № 4. с. 723—737. doi:10.1038/nprot.2018.006.
- ↑ а б Kim, Hyeonyu; Kamm, Roger D.; Vunjak-Novakovic, Gordana; Wu, Joseph C. (2022-04). Progress in multicellular human cardiac organoids for clinical applications. Cell Stem Cell. Т. 29, № 4. с. 503—514. doi:10.1016/j.stem.2022.03.012.
- ↑ а б Lee, Seul-Gi; Kim, Ye-Ji; Son, Mi-Young; Oh, Min-Seok; Kim, Jin; Ryu, Bokyeong; Kang, Kyu-Ree; Baek, Jieun; Chung, Gujin (1 листопада 2022). Generation of human iPSCs derived heart organoids structurally and functionally similar to heart. Biomaterials. Т. 290. с. 121860. doi:10.1016/j.biomaterials.2022.121860.
- ↑ Sahara, Makoto (2023-01). Recent Advances in Generation of In Vitro Cardiac Organoids. International Journal of Molecular Sciences (англ.). Т. 24, № 7. с. 6244. doi:10.3390/ijms24076244.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Volmert, Brett; Kiselev, Artem; Juhong, Aniwat; Wang, Fei; Riggs, Ashlin; Kostina, Aleksandra; O’Hern, Colin; Muniyandi, Priyadharshni; Wasserman, Aaron (12 грудня 2023). A patterned human primitive heart organoid model generated by pluripotent stem cell self-organization. Nature Communications (англ.). Т. 14, № 1. с. 8245. doi:10.1038/s41467-023-43999-1. Процитовано 16 грудня 2023.
- ↑ а б Wimmer, Reiner A.; Leopoldi, Alexandra; Aichinger, Martin; Wick, Nikolaus; Hantusch, Brigitte; Novatchkova, Maria; Taubenschmid, Jasmin; Hämmerle, Monika; Esk, Christopher (2019-01). Human blood vessel organoids as a model of diabetic vasculopathy. Nature (англ.). Т. 565, № 7740. с. 505—510. doi:10.1038/s41586-018-0858-8.
- ↑ а б Afanasyeva, Tess A. V.; Corral-Serrano, Julio C.; Garanto, Alejandro; Roepman, Ronald; Cheetham, Michael E.; Collin, Rob W. J. (1 жовтня 2021). A look into retinal organoids: methods, analytical techniques, and applications. Cellular and Molecular Life Sciences (англ.). Т. 78, № 19. с. 6505—6532. doi:10.1007/s00018-021-03917-4.
- ↑ а б Li, Jinyan; Chen, Yijia; Ouyang, Shuai; Ma, Jingyu; Sun, Hui; Luo, Lixia; Chen, Shuyi; Liu, Yizhi (2021). Generation and Staging of Human Retinal Organoids Based on Self-Formed Ectodermal Autonomous Multi-Zone System. Frontiers in Cell and Developmental Biology. Т. 9. doi:10.3389/fcell.2021.732382.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Kim, Hantai; Kim, Young Sun; Kim, Yeon Ju; Ha, Jungho; Sung, Siung; Jang, Jeong Hun; Park, Sunho; Kim, Jangho; Kim, Kyunghoon (25 квітня 2023). Development of otic organoids and their current status. Organoid (English) . Т. 3. doi:10.51335/organoid.2023.3.e7.
- ↑ а б в Smirnova, Lena; Caffo, Brian S.; Gracias, David H.; Huang, Qi; Morales Pantoja, Itzy E.; Tang, Bohao; Zack, Donald J.; Berlinicke, Cynthia A.; Boyd, J. Lomax (28 лютого 2023). Organoid intelligence (OI): the new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science. Т. 1. с. 1017235. doi:10.3389/fsci.2023.1017235.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Hetzel, Laura Ann; Ali, Ahmed; Corbo, Vincenzo; Hankemeier, Thomas (2023-01). Microfluidics and Organoids, the Power Couple of Developmental Biology and Oncology Studies. International Journal of Molecular Sciences (англ.). Т. 24, № 13. с. 10882. doi:10.3390/ijms241310882.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Zhu, Yujuan; Zhang, Xiaoxuan; Sun, Lingyu; Wang, Yu; Zhao, Yuanjin (2023-04). Engineering Human Brain Assembloids by Microfluidics. Advanced Materials (англ.). Т. 35, № 14. doi:10.1002/adma.202210083.
- ↑ Wu, Lei; Ai, Yongjian; Xie, Ruoxiao; Xiong, Jialiang; Wang, Yu; Liang, Qionglin (1 березня 2023). Organoids/organs-on-a-chip: new frontiers of intestinal pathophysiological models. Lab on a Chip (англ.). Т. 23, № 5. с. 1192—1212. doi:10.1039/D2LC00804A.
- ↑ Fang, Guocheng; Chen, Yu‐Cheng; Lu, Hongxu; Jin, Dayong (2023-05). Advances in Spheroids and Organoids on a Chip. Advanced Functional Materials (англ.). Т. 33, № 19. doi:10.1002/adfm.202215043.
- ↑ Wang, Yaqing; Qin, Jianhua (1 лютого 2023). Advances in human organoids-on-chips in biomedical research. Life Medicine (англ.). Т. 2, № 1. doi:10.1093/lifemedi/lnad007.
- ↑ Tan, Sin Yen; Feng, Xiaohan; Cheng, Lily Kwan Wai; Wu, Angela Ruohao (13 червня 2023). Vascularized human brain organoid on-chip. Lab on a Chip (англ.). Т. 23, № 12. с. 2693—2709. doi:10.1039/D2LC01109C.
- ↑ Saorin, Gloria; Caligiuri, Isabella; Rizzolio, Flavio (30 липня 2023). Microfluidic organoids-on-a-chip: The future of human models. Seminars in Cell & Developmental Biology. Т. 144. с. 41—54. doi:10.1016/j.semcdb.2022.10.001.
- ↑ Shoji, Jun‐ya; Davis, Richard P.; Mummery, Christine L.; Krauss, Stefan (7 серпня 2023). Global Meta‐Analysis of Organoid and Organ‐on‐Chip Research. Advanced Healthcare Materials (англ.). doi:10.1002/adhm.202301067.
- ↑ Menche, Constantin; Farin, Henner F. (2021-10). Strategies for genetic manipulation of adult stem cell-derived organoids. Experimental & Molecular Medicine (англ.). Т. 53, № 10. с. 1483—1494. doi:10.1038/s12276-021-00609-8.
- ↑ Haja, Asmaa; Horcas-Nieto, José M.; Bakker, Barbara M.; Schomaker, Lambert (1 січня 2023). Towards automatization of organoid analysis: A deep learning approach to localize and quantify organoid images. Computer Methods and Programs in Biomedicine Update. Т. 3. с. 100101. doi:10.1016/j.cmpbup.2023.100101.
- ↑ Matthews, Jonathan M.; Schuster, Brooke; Kashaf, Sara Saheb; Liu, Ping; Ben-Yishay, Rakefet; Ishay-Ronen, Dana; Izumchenko, Evgeny; Shen, Le; Weber, Christopher R. (9 лист. 2022 р.). OrganoID: A versatile deep learning platform for tracking and analysis of single-organoid dynamics. PLOS Computational Biology (англ.). Т. 18, № 11. с. e1010584. doi:10.1371/journal.pcbi.1010584.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Du, Xuan; Chen, Zaozao; Li, Qiwei; Yang, Sheng; Jiang, Lincao; Yang, Yi; Li, Yanhui; Gu, Zhongze (2023-05). Organoids revealed: morphological analysis of the profound next generation in-vitro model with artificial intelligence. Bio-Design and Manufacturing (англ.). Т. 6, № 3. с. 319—339. doi:10.1007/s42242-022-00226-y.
- ↑ Park, Taeyun; Kim, Taeyul K.; Han, Yoon Dae; Kim, Kyung-A.; Kim, Hwiyoung; Kim, Han Sang (13 листопада 2023). Development of a deep learning based image processing tool for enhanced organoid analysis. Scientific Reports (англ.). doi:10.1038/s41598-023-46485-2. Процитовано 16 грудня 2023.
- ↑ Albanese, Alexandre; Swaney, Justin M.; Yun, Dae Hee; Evans, Nicholas B.; Antonucci, Jenna M. та ін. (8 грудня 2020). Multiscale 3D phenotyping of human cerebral organoids. Scientific Reports (англ.). Т. 10, № 1. doi:10.1038/s41598-020-78130-7.
{{cite news}}: Явне використання «та ін.» у:|first5=(довідка) - ↑ а б Jacob, Fadi; Schnoll, Jordan G.; Song, Hongjun; Ming, Guo-li (1 січня 2021). Bashaw, Greg J. (ред.). Chapter Twelve - Building the brain from scratch: Engineering region-specific brain organoids from human stem cells to study neural development and disease. Current Topics in Developmental Biology. Т. 142. Academic Press. с. 477—530. doi:10.1016/bs.ctdb.2020.12.011. PMC 8363060. PMID 33706925.
{{cite book}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б Adlakha, Yogita K. (3 липня 2023). Human 3D brain organoids: steering the demolecularization of brain and neurological diseases. Cell Death Discovery (англ.). Т. 9, № 1. с. 1—17. doi:10.1038/s41420-023-01523-w.
- ↑ а б Eichmüller, Oliver L.; Knoblich, Juergen A. (2022-11). Human cerebral organoids — a new tool for clinical neurology research. Nature Reviews Neurology (англ.). Т. 18, № 11. с. 661—680. doi:10.1038/s41582-022-00723-9.
- ↑ а б в г Li, Xiaodong; Shopit, Abdullah; Wang, Jingmin (5 грудня 2022). A Comprehensive Update of Cerebral Organoids between Applications and Challenges. Oxidative Medicine and Cellular Longevity (англ.). Т. 2022. с. e7264649. doi:10.1155/2022/7264649.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Mulder, Lance A.; Depla, Josse A.; Sridhar, Adithya; Wolthers, Katja; Pajkrt, Dasja; Vieira de Sá, Renata (15 квітня 2023). A beginner’s guide on the use of brain organoids for neuroscientists: a systematic review. Stem Cell Research & Therapy (англ.). Т. 14, № 1. doi:10.1186/s13287-023-03302-x.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Li, Yang; Zeng, Peng-Ming; Wu, Jian; Luo, Zhen-Ge (24 травня 2023). Advances and Applications of Brain Organoids. Neuroscience Bulletin (англ.). doi:10.1007/s12264-023-01065-2.
- ↑ Makrygianni, Evanthia A.; Chrousos, George P. (2021). From Brain Organoids to Networking Assembloids: Implications for Neuroendocrinology and Stress Medicine. Frontiers in Physiology. Т. 12. doi:10.3389/fphys.2021.621970.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Roth, Julien G.; Brunel, Lucia G.; Huang, Michelle S.; Liu, Yueming; Cai, Betty; Sinha, Sauradeep; Yang, Fan; Pașca, Sergiu P.; Shin, Sungchul (19 липня 2023). Spatially controlled construction of assembloids using bioprinting. Nature Communications (англ.). Т. 14, № 1. с. 4346. doi:10.1038/s41467-023-40006-5.
- ↑ Cakir, Bilal; Xiang, Yangfei; Tanaka, Yoshiaki; Kural, Mehmet H.; Parent, Maxime; Kang, Young-Jin; Chapeton, Kayley; Patterson, Benjamin; Yuan, Yifan (2019-11). Engineering of human brain organoids with a functional vascular-like system. Nature Methods (англ.). Т. 16, № 11. с. 1169—1175. doi:10.1038/s41592-019-0586-5.
- ↑ LaMontagne, Erin; Muotri, Alysson R.; Engler, Adam J. (2022). Recent advancements and future requirements in vascularization of cortical organoids. Frontiers in Bioengineering and Biotechnology. Т. 10. doi:10.3389/fbioe.2022.1048731.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Ye, Bing (8 трав. 2023 р.). Approaches to vascularizing human brain organoids. PLOS Biology (англ.). Т. 21, № 5. с. e3002141. doi:10.1371/journal.pbio.3002141.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Matsui, Takeshi K.; Tsuru, Yuichiro; Hasegawa, Koichi; Kuwako, Ken-ichiro (1 серпня 2021). Vascularization of Human Brain Organoids. Stem Cells (англ.). Т. 39, № 8. с. 1017—1024. doi:10.1002/stem.3368.
- ↑ Zhou, Jin-Qi; Zeng, Ling-Hui; Li, Chen-Tao; He, Da-Hong; Zhao, Hao-Duo; Xu, Yan-Nan; Jin, Zi-Tian; Gao, Chong (2023-09). Brain organoids are new tool for drug screening of neurological diseases. Neural Regeneration Research (амер.). Т. 18, № 9. с. 1884. doi:10.4103/1673-5374.367983.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Madhavan, Mayur; Nevin, Zachary S.; Shick, H. Elizabeth; Garrison, Eric; Clarkson-Paredes, Cheryl; Karl, Molly; Clayton, Benjamin L. L.; Factor, Daniel C.; Allan, Kevin C. (2018-09). Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods (англ.). Т. 15, № 9. с. 700—706. doi:10.1038/s41592-018-0081-4.
- ↑ Ma, Ling; Mei, Yuting; Xu, Peibo; Cheng, Yan; You, Zhiwen; Ji, Xiaoli; Zhuang, Deyi; Zhou, Wenhao; Chen, Yuejun (2022-10). Fast generation of forebrain oligodendrocyte spheroids from human embryonic stem cells by transcription factors. iScience. Т. 25, № 10. с. 105172. doi:10.1016/j.isci.2022.105172.
- ↑ Yoon, Se-Jin; Elahi, Lubayna S.; Pașca, Anca M.; Marton, Rebecca M.; Gordon, Aaron; Revah, Omer; Miura, Yuki; Walczak, Elisabeth M.; Holdgate, Gwendolyn M. (2019-01). Reliability of human cortical organoid generation. Nature Methods (англ.). Т. 16, № 1. с. 75—78. doi:10.1038/s41592-018-0255-0.
- ↑ Park, Yoonseok; Franz, Colin K.; Ryu, Hanjun; Luan, Haiwen; Cotton, Kristen Y.; Kim, Jong Uk; Chung, Ted S.; Zhao, Shiwei; Vazquez-Guardado, Abraham (19 березня 2021). Three-dimensional, multifunctional neural interfaces for cortical spheroids and engineered assembloids. Science Advances (англ.). Т. 7, № 12. doi:10.1126/sciadv.abf9153.
- ↑ De Kleijn, Kim M. A.; Zuure, Wieteke A.; Straasheijm, Kirsten R.; Martens, Marijn B.; Avramut, M. Cristina; Koning, Roman I.; Martens, Gerard J. M. (23 березня 2023). Human cortical spheroids with a high diversity of innately developing brain cell types. Stem Cell Research & Therapy (англ.). Т. 14, № 1. doi:10.1186/s13287-023-03261-3.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Jo, Junghyun; Xiao, Yixin; Sun, Alfred Xuyang; Cukuroglu, Engin; Tran, Hoang-Dai; Göke, Jonathan; Tan, Zi Ying; Saw, Tzuen Yih; Tan, Cheng-Peow (2016-08). Midbrain-like Organoids from Human Pluripotent Stem Cells Contain Functional Dopaminergic and Neuromelanin-Producing Neurons. Cell Stem Cell (англ.). Т. 19, № 2. с. 248—257. doi:10.1016/j.stem.2016.07.005.
- ↑ Sabate‐Soler, Sonia; Nickels, Sarah Louise; Saraiva, Cláudia; Berger, Emanuel; Dubonyte, Ugne; Barmpa, Kyriaki; Lan, Yan Jun; Kouno, Tsukasa; Jarazo, Javier (2022-07). Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia (англ.). Т. 70, № 7. с. 1267—1288. doi:10.1002/glia.24167.
- ↑ Mohamed, Nguyen-Vi; Lépine, Paula; Lacalle-Aurioles, María; Sirois, Julien; Mathur, Meghna; Reintsch, Wolfgang; Beitel, Lenore K.; Fon, Edward A.; Durcan, Thomas M. (1 липня 2022). Microfabricated disk technology: Rapid scale up in midbrain organoid generation. Methods. Т. 203. с. 465—477. doi:10.1016/j.ymeth.2021.07.008.
- ↑ Sozzi, Edoardo; Nilsson, Fredrik; Kajtez, Janko; Parmar, Malin; Fiorenzano, Alessandro (2022-09). Generation of Human Ventral Midbrain Organoids Derived from Pluripotent Stem Cells. Current Protocols (англ.). Т. 2, № 9. doi:10.1002/cpz1.555.
- ↑ а б Toh, Hilary S Y; Choo, Xin Yi; Sun, Alfred Xuyang (2023). Midbrain organoids—development and applications in Parkinson’s disease. Oxford Open Neuroscience. Т. 2. doi:10.1093/oons/kvad009.
- ↑ Huang, Wei-Kai; Wong, Samuel Zheng Hao; Pather, Sarshan R.; Nguyen, Phuong T.T.; Zhang, Feng; Zhang, Daniel Y.; Zhang, Zhijian; Lu, Lu; Fang, Wanqi (2021-09). Generation of hypothalamic arcuate organoids from human induced pluripotent stem cells. Cell Stem Cell (англ.). Т. 28, № 9. с. 1657—1670.e10. doi:10.1016/j.stem.2021.04.006.
- ↑ Ozaki, Hajime; Suga, Hidetaka; Arima, Hiroshi (2021-02). Hypothalamic–pituitary organoid generation through the recapitulation of organogenesis. Development, Growth & Differentiation (англ.). Т. 63, № 2. с. 154—165. doi:10.1111/dgd.12719.
- ↑ Sarrafha, Lily; Neavin, Drew R.; Parfitt, Gustavo M.; Kruglikov, Ilya A.; Whitney, Kristen; Reyes, Ricardo; Coccia, Elena; Kareva, Tatyana; Goldman, Camille (2023-09). Novel human pluripotent stem cell-derived hypothalamus organoids demonstrate cellular diversity. iScience. Т. 26, № 9. с. 107525. doi:10.1016/j.isci.2023.107525.
- ↑ Afanasyeva, Tess A. V.; Corral-Serrano, Julio C.; Garanto, Alejandro; Roepman, Ronald; Cheetham, Michael E.; Collin, Rob W. J. (1 жовтня 2021). A look into retinal organoids: methods, analytical techniques, and applications. Cellular and Molecular Life Sciences (англ.). Т. 78, № 19. с. 6505—6532. doi:10.1007/s00018-021-03917-4.
- ↑ а б Wahle, Philipp; Brancati, Giovanna; Harmel, Christoph; He, Zhisong; Gut, Gabriele; del Castillo, Jacobo Sarabia; Xavier da Silveira dos Santos, Aline; Yu, Qianhui; Noser, Pascal (8 травня 2023). Multimodal spatiotemporal phenotyping of human retinal organoid development. Nature Biotechnology (англ.). с. 1—11. doi:10.1038/s41587-023-01747-2.
- ↑ Ludwig, Allison L.; Mayerl, Steven J.; Gao, Yu; Banghart, Mark; Bacig, Cole; Fernandez Zepeda, Maria A.; Zhao, Xinyu; Gamm, David M. (10 січня 2023). Re-formation of synaptic connectivity in dissociated human stem cell-derived retinal organoid cultures. Proceedings of the National Academy of Sciences (англ.). Т. 120, № 2. doi:10.1073/pnas.2213418120.
- ↑ а б Tresenrider, Amy; Sridhar, Akshayalakshmi; Eldred, Kiara C.; Cuschieri, Sophia; Hoffer, Dawn; Trapnell, Cole; Reh, Thomas A. (28 серпня 2023). Single-cell sequencing of individual retinal organoids reveals determinants of cell-fate heterogeneity. Cell Reports Methods. Т. 3, № 8. с. 100548. doi:10.1016/j.crmeth.2023.100548.
- ↑ Isla-Magrané, Helena; Veiga, Anna; García-Arumí, José; Duarri, Anna (22 листопада 2021). Multiocular organoids from human induced pluripotent stem cells displayed retinal, corneal, and retinal pigment epithelium lineages. Stem Cell Research & Therapy (англ.). Т. 12, № 1. doi:10.1186/s13287-021-02651-9.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Kaluthantrige Don, Flaminia; Kalebic, Nereo (2022). Forebrain Organoids to Model the Cell Biology of Basal Radial Glia in Neurodevelopmental Disorders and Brain Evolution. Frontiers in Cell and Developmental Biology. Т. 10. doi:10.3389/fcell.2022.917166.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Gabriel, Elke; Albanna, Walid; Pasquini, Giovanni; Ramani, Anand; Josipovic, Natasa; Mariappan, Aruljothi; Riparbelli, Maria Giovanna; Callaini, Giuliano; Karch, Celeste M. (2023-06). Generation of iPSC-derived human forebrain organoids assembling bilateral eye primordia. Nature Protocols (англ.). Т. 18, № 6. с. 1893—1929. doi:10.1038/s41596-023-00814-x.
- ↑ а б Birey, Fikri; Andersen, Jimena; Makinson, Christopher D.; Islam, Saiful; Wei, Wu; Huber, Nina; Fan, H. Christina; Metzler, Kimberly R. Cordes; Panagiotakos, Georgia (4 травня 2017). Assembly of functionally integrated human forebrain spheroids. Nature (англ.). Т. 545, № 7652. с. 54—59. doi:10.1038/nature22330.
- ↑ а б Birey, Fikri; Li, Min-Yin; Gordon, Aaron; Thete, Mayuri V.; Valencia, Alfredo M.; Revah, Omer; Paşca, Anca M.; Geschwind, Daniel H.; Paşca, Sergiu P. (2022-02). Dissecting the molecular basis of human interneuron migration in forebrain assembloids from Timothy syndrome. Cell Stem Cell. Т. 29, № 2. с. 248—264.e7. doi:10.1016/j.stem.2021.11.011.
- ↑ а б Birey, Fikri; Pașca, Sergiu P. (16 вересня 2022). Imaging neuronal migration and network activity in human forebrain assembloids. STAR Protocols. Т. 3, № 3. с. 101478. doi:10.1016/j.xpro.2022.101478.
- ↑ Song, Liqing; Yuan, Xuegang; Jones, Zachary; Vied, Cynthia; Miao, Yu; Marzano, Mark; Hua, Thien; Sang, Qing-Xiang Amy; Guan, Jingjiao (30 липня 2019). Functionalization of Brain Region-specific Spheroids with Isogenic Microglia-like Cells. Scientific Reports (англ.). Т. 9, № 1. doi:10.1038/s41598-019-47444-6.
- ↑ Zhang, Wendiao; Jiang, Jiamei; Xu, Zhenhong; Yan, Hongye; Tang, Beisha та ін. (2023-01). Microglia-containing human brain organoids for the study of brain development and pathology. Molecular Psychiatry (англ.). Т. 28, № 1. с. 96—107. doi:10.1038/s41380-022-01892-1.
{{cite news}}: Явне використання «та ін.» у:|first5=(довідка) - ↑ Zhang, Wendiao; Jiang, Jiamei; Xu, Zhenhong; Yan, Hongye; Tang, Beisha; Liu, Chunyu; Chen, Chao; Meng, Qingtuan (2023-01). Microglia-containing human brain organoids for the study of brain development and pathology. Molecular Psychiatry (англ.). Т. 28, № 1. с. 96—107. doi:10.1038/s41380-022-01892-1.
- ↑ Hong, Yiling; Dong, Xu; Chang, Lawrence; Xie, Chen; Chang, Mariann; Aguilar, Jose S.; Lin, Jimmy; Lin, Juncheng; Li, Qingshun Q. (2023-03). Microglia-containing cerebral organoids derived from induced pluripotent stem cells for the study of neurological diseases. iScience. Т. 26, № 3. с. 106267. doi:10.1016/j.isci.2023.106267.
- ↑ Schafer, Simon T.; Mansour, Abed AlFatah; Schlachetzki, Johannes C.M.; Pena, Monique; Ghassemzadeh, Saeed; Mitchell, Lisa; Mar, Amanda; Quang, Daphne; Stumpf, Sarah (2023-05). An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. Т. 186, № 10. с. 2111—2126.e20. doi:10.1016/j.cell.2023.04.022.
- ↑ а б D’Aiuto, Leonardo; Bloom, David C.; Naciri, Jennifer N.; Smith, Adam; Edwards, Terri G.; McClain, Lora; Callio, Jason A.; Jessup, Morgan; Wood, Joel (2019-05). Sandri-Goldin, Rozanne M. (ред.). Modeling Herpes Simplex Virus 1 Infections in Human Central Nervous System Neuronal Cells Using Two- and Three-Dimensional Cultures Derived from Induced Pluripotent Stem Cells. Journal of Virology (англ.). Т. 93, № 9. doi:10.1128/JVI.00111-19.
- ↑ Selejan, Ovidiu (31 липня 2023). Differentiation of neurosphere after transplantation into the damaged spinal cord • JML Journal of Medicine and Life. JML Journal of Medicine and Life (амер.). doi:10.25122/jml-2022-0346.
- ↑ Krencik, Robert; Seo, Kyounghee; van Asperen, Jessy V.; Basu, Nupur; Cvetkovic, Caroline; Barlas, Saba; Chen, Robert; Ludwig, Connor; Wang, Chao (2017-12). Systematic Three-Dimensional Coculture Rapidly Recapitulates Interactions between Human Neurons and Astrocytes. Stem Cell Reports. Т. 9, № 6. с. 1745—1753. doi:10.1016/j.stemcr.2017.10.026.
- ↑ Sloan, Steven A.; Darmanis, Spyros; Huber, Nina; Khan, Themasap A.; Birey, Fikri; Caneda, Christine; Reimer, Richard; Quake, Stephen R.; Barres, Ben A. (2017-08). Human Astrocyte Maturation Captured in 3D Cerebral Cortical Spheroids Derived from Pluripotent Stem Cells. Neuron (англ.). Т. 95, № 4. с. 779—790.e6. doi:10.1016/j.neuron.2017.07.035.
- ↑ Szebényi, Kornélia; Wenger, Léa M. D.; Sun, Yu; Dunn, Alexander W. E.; Limegrover, Colleen A.; Gibbons, George M.; Conci, Elena; Paulsen, Ole; Mierau, Susanna B. (2021-11). Human ALS/FTD brain organoid slice cultures display distinct early astrocyte and targetable neuronal pathology. Nature Neuroscience (англ.). Т. 24, № 11. с. 1542—1554. doi:10.1038/s41593-021-00923-4.
- ↑ James, Owen G.; Selvaraj, Bhuvaneish T.; Magnani, Dario; Burr, Karen; Connick, Peter; Barton, Samantha K.; Vasistha, Navneet A.; Hampton, David W.; Story, David (2022-01). iPSC-derived myelinoids to study myelin biology of humans. Developmental Cell. Т. 57, № 1. с. 146. doi:10.1016/j.devcel.2021.12.009.
- ↑ а б Ma, Cuili; Seong, Hwanwook; Li, Xiaowei; Yu, Xiao; Xu, Shunliang; Li, Yujing (25 серпня 2022). Human Brain Organoid: A Versatile Tool for Modeling Neurodegeneration Diseases and for Drug Screening. Stem Cells International (англ.). Т. 2022. с. e2150680. doi:10.1155/2022/2150680.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Bergmann, Sonja; Lawler, Sean E.; Qu, Yuan; Fadzen, Colin M.; Wolfe, Justin M.; Regan, Michael S.; Pentelute, Bradley L.; Agar, Nathalie Y. R.; Cho, Choi-Fong (2018-12). Blood–brain-barrier organoids for investigating the permeability of CNS therapeutics. Nature Protocols (англ.). Т. 13, № 12. с. 2827—2843. doi:10.1038/s41596-018-0066-x.
- ↑ Mayhew, Christopher N.; Singhania, Richa (17 березня 2023). A review of protocols for brain organoids and applications for disease modeling. STAR Protocols. Т. 4, № 1. с. 101860. doi:10.1016/j.xpro.2022.101860.
- ↑ Chen, Hao; Jin, Xin; Li, Tie; Ye, Zhuang (2022). Brain organoids: Establishment and application. Frontiers in Cell and Developmental Biology. Т. 10. doi:10.3389/fcell.2022.1029873.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Kilpatrick, Savannah; Irwin, Courtney; Singh, Karun K. (21 червня 2023). Human pluripotent stem cell (hPSC) and organoid models of autism: opportunities and limitations. Translational Psychiatry (англ.). Т. 13, № 1. с. 1—21. doi:10.1038/s41398-023-02510-6.
- ↑ Santos, John Lenon de Souza; Araújo, Cecília de Almeida; Rocha, Clarissa Araújo Gurgel; Costa-Ferro, Zaquer Suzana Munhoz; Souza, Bruno Solano de Freitas (2023-02). Modeling Autism Spectrum Disorders with Induced Pluripotent Stem Cell-Derived Brain Organoids. Biomolecules (англ.). Т. 13, № 2. с. 260. doi:10.3390/biom13020260.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Fair, Summer R; Schwind, Wesley; Julian, Dominic L; Biel, Alecia; Guo, Gongbo; Rutherford, Ryan; Ramadesikan, Swetha; Westfall, Jesse; Miller, Katherine E (8 липня 2022). Cerebral organoids containing an AUTS2 missense variant model microcephaly. Brain. Т. 146, № 1. с. 387—404. doi:10.1093/brain/awac244.
- ↑ Haase, Florencia D.; Coorey, Bronte; Riley, Lisa; Cantrill, Laurence C.; Tam, Patrick P. L.; Gold, Wendy A. (2021). Pre-clinical Investigation of Rett Syndrome Using Human Stem Cell-Based Disease Models. Frontiers in Neuroscience. Т. 15. doi:10.3389/fnins.2021.698812.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Yildirim, Murat; Delepine, Chloe; Feldman, Danielle; Pham, Vincent A; Chou, Stephanie; Ip, Jacque; Nott, Alexi; Tsai, Li-Huei; Ming, Guo-Li (29 липня 2022). Chin, Jeannie (ред.). Label-free three-photon imaging of intact human cerebral organoids for tracking early events in brain development and deficits in Rett syndrome. eLife. Т. 11. с. e78079. doi:10.7554/eLife.78079.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Sen, Dilara; Voulgaropoulos, Alexis; Drobna, Zuzana; Keung, Albert J. (2020-10). Human Cerebral Organoids Reveal Early Spatiotemporal Dynamics and Pharmacological Responses of UBE3A. Stem Cell Reports. Т. 15, № 4. с. 845—854. doi:10.1016/j.stemcr.2020.08.006.
- ↑ Sun, Alfred Xuyang; Yuan, Qiang; Fukuda, Masahiro; Yu, Weonjin; Yan, Haidun; Lim, Grace Gui Yin; Nai, Mui Hoon; D’Agostino, Giuseppe Alessandro; Tran, Hoang-Dai (20 грудня 2019). Potassium channel dysfunction in human neuronal models of Angelman syndrome. Science (англ.). Т. 366, № 6472. с. 1486—1492. doi:10.1126/science.aav5386.
- ↑ Blair, John D.; Hockemeyer, Dirk; Bateup, Helen S. (2018-10). Genetically engineered human cortical spheroid models of tuberous sclerosis. Nature Medicine (англ.). Т. 24, № 10. с. 1568—1578. doi:10.1038/s41591-018-0139-y.
- ↑ Eichmüller, Oliver L.; Corsini, Nina S.; Vértesy, Ábel; Morassut, Ilaria; Scholl, Theresa; Gruber, Victoria-Elisabeth; Peer, Angela M.; Chu, Julia; Novatchkova, Maria (28 січня 2022). Amplification of human interneuron progenitors promotes brain tumors and neurological defects. Science (англ.). Т. 375, № 6579. doi:10.1126/science.abf5546.
- ↑ Xu, Jie; Wen, Zhexing (10 вересня 2021). Brain Organoids: Studying Human Brain Development and Diseases in a Dish. Stem Cells International (англ.). Т. 2021. с. e5902824. doi:10.1155/2021/5902824.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Kim, Soo-hyun; Chang, Mi-Yoon (2023-01). Application of Human Brain Organoids—Opportunities and Challenges in Modeling Human Brain Development and Neurodevelopmental Diseases. International Journal of Molecular Sciences (англ.). Т. 24, № 15. с. 12528. doi:10.3390/ijms241512528.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Park, Jong-Chan; Jang, So-Yeong; Lee, Dongjoon; Lee, Jeongha; Kang, Uiryong; Chang, Hongjun; Kim, Haeng Jun; Han, Sun-Ho; Seo, Jinsoo (12 січня 2021). A logical network-based drug-screening platform for Alzheimer’s disease representing pathological features of human brain organoids. Nature Communications (англ.). Т. 12, № 1. с. 280. doi:10.1038/s41467-020-20440-5.
- ↑ Venkataraman, Lalitha; Fair, Summer R.; McElroy, Craig A.; Hester, Mark E.; Fu, Hongjun (1 лютого 2022). Modeling neurodegenerative diseases with cerebral organoids and other three-dimensional culture systems: focus on Alzheimer’s disease. Stem Cell Reviews and Reports (англ.). Т. 18, № 2. с. 696—717. doi:10.1007/s12015-020-10068-9.
- ↑ Sreenivasamurthy, Sai; Laul, Mahek; Zhao, Nan; Kim, Tiffany; Zhu, Donghui (2023-03). Current progress of cerebral organoids for modeling Alzheimer's disease origins and mechanisms. Bioengineering & Translational Medicine (англ.). Т. 8, № 2. doi:10.1002/btm2.10378.
- ↑ Cerneckis, Jonas; Bu, Guojun; Shi, Yanhong (2023-08). Pushing the boundaries of brain organoids to study Alzheimer’s disease. Trends in Molecular Medicine. Т. 29, № 8. с. 659—672. doi:10.1016/j.molmed.2023.05.007.
- ↑ Lavekar, Sailee S.; Harkin, Jade; Hernandez, Melody; Gomes, Cátia; Patil, Shruti; Huang, Kang-Chieh; Puntambekar, Shweta S.; Lamb, Bruce T.; Meyer, Jason S. (24 серпня 2023). Development of a three-dimensional organoid model to explore early retinal phenotypes associated with Alzheimer’s disease. Scientific Reports (англ.). Т. 13, № 1. с. 13827. doi:10.1038/s41598-023-40382-4.
- ↑ Wulansari, Noviana; Darsono, Wahyu Handoko Wibowo; Woo, Hye-Ji; Chang, Mi-Yoon; Kim, Jinil; Bae, Eun-Jin; Sun, Woong; Lee, Ju-Hyun; Cho, Il-Joo (19 лютого 2021). Neurodevelopmental defects and neurodegenerative phenotypes in human brain organoids carrying Parkinson’s disease-linked DNAJC6 mutations. Science Advances (англ.). Т. 7, № 8. doi:10.1126/sciadv.abb1540.
- ↑ Smits, Lisa M.; Reinhardt, Lydia; Reinhardt, Peter; Glatza, Michael; Monzel, Anna S.; Stanslowsky, Nancy; Rosato-Siri, Marcelo D.; Zanon, Alessandra; Antony, Paul M. (5 квітня 2019). Modeling Parkinson’s disease in midbrain-like organoids. npj Parkinson's Disease (англ.). Т. 5, № 1. с. 1—8. doi:10.1038/s41531-019-0078-4.
- ↑ McComish, Sarah F.; MacMahon Copas, Adina N.; Caldwell, Maeve A. (2022). Human Brain-Based Models Provide a Powerful Tool for the Advancement of Parkinson’s Disease Research and Therapeutic Development. Frontiers in Neuroscience. Т. 16. doi:10.3389/fnins.2022.851058.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Pereira, João D.; DuBreuil, Daniel M.; Devlin, Anna-Claire; Held, Aaron; Sapir, Yechiam; Berezovski, Eugene; Hawrot, James; Dorfman, Katherine; Chander, Vignesh (6 серпня 2021). Human sensorimotor organoids derived from healthy and amyotrophic lateral sclerosis stem cells form neuromuscular junctions. Nature Communications (англ.). Т. 12, № 1. с. 4744. doi:10.1038/s41467-021-24776-4.
- ↑ Szebényi, Kornélia; Wenger, Léa M. D.; Sun, Yu; Dunn, Alexander W. E.; Limegrover, Colleen A.; Gibbons, George M.; Conci, Elena; Paulsen, Ole; Mierau, Susanna B. (2021-11). Human ALS/FTD brain organoid slice cultures display distinct early astrocyte and targetable neuronal pathology. Nature Neuroscience (англ.). Т. 24, № 11. с. 1542—1554. doi:10.1038/s41593-021-00923-4.
- ↑ Chen, Eric; Daviaud, Nicolas; Sadiq, Saud (13 квітня 2021). Effect of multiple sclerosis patient genetic background on cerebral organoid cell populations. (4296). Neurology (англ.). Т. 96, № 15 Supplement.
- ↑ Daviaud, Nicolas; Chen, Eric; Edwards, Tara; Sadiq, Saud A. (6 березня 2023). Cerebral organoids in primary progressive multiple sclerosis reveal stem cell and oligodendrocyte differentiation defect. Biology Open. Т. 12, № 3. doi:10.1242/bio.059845.
- ↑ Conforti, P.; Besusso, D.; Bocchi, V. D.; Faedo, A.; Cesana, E.; Rossetti, G.; Ranzani, V.; Svendsen, C. N.; Thompson, L. M. (23 січня 2018). Faulty neuronal determination and cell polarization are reverted by modulating HD early phenotypes. Proceedings of the National Academy of Sciences (англ.). Т. 115, № 4. doi:10.1073/pnas.1715865115.
- ↑ Liu, Chunyue; Fu, Zixing; Wu, Shanshan; Wang, Xiaosong; Zhang, Shengrong; Chu, Chu; Hong, Yuan; Wu, Wenbo; Chen, Shengqi (7 липня 2022). Mitochondrial HSF1 triggers mitochondrial dysfunction and neurodegeneration in Huntington's disease. EMBO Molecular Medicine (англ.). Т. 14, № 7.
- ↑ Conner, LT; Srinageshwar, B.; Bakke, JL; Dunbar, GL; Rossignol, J. (1 липня 2023). Advances in stem cell and other therapies for Huntington’s disease: An update. Brain Research Bulletin. Т. 199. с. 110673. doi:10.1016/j.brainresbull.2023.110673.
- ↑ Groveman, Bradley R.; Ferreira, Natalia C.; Foliaki, Simote T.; Walters, Ryan O.; Winkler, Clayton W.; Race, Brent; Hughson, Andrew G.; Zanusso, Gianluigi; Haigh, Cathryn L. (9 березня 2021). Human cerebral organoids as a therapeutic drug screening model for Creutzfeldt–Jakob disease. Scientific Reports (англ.). Т. 11, № 1. с. 5165. doi:10.1038/s41598-021-84689-6.
- ↑ Pellegrini, Laura; Lancaster, Madeline A. (2021-08). Modeling neurodegeneration with mutant-tau organoids. Cell. Т. 184, № 17. с. 4377—4379. doi:10.1016/j.cell.2021.07.031.
- ↑ Wang, Qinying; Dong, Xiaoxu; Hu, Tingting; Qu, Chao; Lu, Jing; Zhou, Yue; Li, Jinsong; Pei, Gang (2021-01). Constitutive Activity of Serotonin Receptor 6 Regulates Human Cerebral Organoids Formation and Depression-like Behaviors. Stem Cell Reports. Т. 16, № 1. с. 75—88. doi:10.1016/j.stemcr.2020.11.015.
- ↑ Lu, Kaiqin; Hong, Yuan; Tao, Mengdan; Shen, Luping; Zheng, Zhilong; Fang, Kaiheng; Yuan, Fang; Xu, Min; Wang, Chun (11 січня 2023). Depressive patient‐derived GABA interneurons reveal abnormal neural activity associated with HTR2C. EMBO Molecular Medicine (англ.). Т. 15, № 1. doi:10.15252/emmm.202216364.
- ↑ Kathuria, Annie; Lopez-Lengowski, Kara; Jagtap, Smita S.; McPhie, Donna; Perlis, Roy H.; Cohen, Bruce M.; Karmacharya, Rakesh (1 липня 2020). Transcriptomic Landscape and Functional Characterization of Induced Pluripotent Stem Cell–Derived Cerebral Organoids in Schizophrenia. JAMA Psychiatry (англ.). Т. 77, № 7. с. 745. doi:10.1001/jamapsychiatry.2020.0196.
- ↑ Notaras, Michael; Lodhi, Aiman; Dündar, Friederike; Collier, Paul; Sayles, Nicole M.; Tilgner, Hagen; Greening, David; Colak, Dilek (2022-03). Schizophrenia is defined by cell-specific neuropathology and multiple neurodevelopmental mechanisms in patient-derived cerebral organoids. Molecular Psychiatry (англ.). Т. 27, № 3. с. 1416—1434. doi:10.1038/s41380-021-01316-6.
- ↑ Kathuria, Annie; Lopez-Lengowski, Kara; Vater, Magdalena; McPhie, Donna; Cohen, Bruce M.; Karmacharya, Rakesh (19 квітня 2020). Transcriptome analysis and functional characterization of cerebral organoids in bipolar disorder. Genome Medicine. Т. 12, № 1. с. 34. doi:10.1186/s13073-020-00733-6.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Hewitt, Tristen; Alural, Begüm; Tilak, Manali; Wang, Jennifer; Becke, Natalina; Chartley, Ellis; Perreault, Melissa; Haggarty, Stephen J.; Sheridan, Steven D. (4 липня 2023). Bipolar disorder-iPSC derived neural progenitor cells exhibit dysregulation of store-operated Ca2+ entry and accelerated differentiation. Molecular Psychiatry (англ.). с. 1—14. doi:10.1038/s41380-023-02152-6.
- ↑ Dixon, Thomas Anthony; Muotri, Alysson R. (2023-01). Advancing preclinical models of psychiatric disorders with human brain organoid cultures. Molecular Psychiatry (англ.). Т. 28, № 1. с. 83—95. doi:10.1038/s41380-022-01708-2.
- ↑ Villanueva, Rosa (2023). Advances in the knowledge and therapeutics of schizophrenia, major depression disorder, and bipolar disorder from human brain organoid research. Frontiers in Psychiatry. Т. 14. doi:10.3389/fpsyt.2023.1178494.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Zhang, Zhijian; Wang, Xin; Park, Sean; Song, Hongjun; Ming, Guo-Li (2023-04). Development and Application of Brain Region–Specific Organoids for Investigating Psychiatric Disorders. Biological Psychiatry. Т. 93, № 7. с. 594—605. doi:10.1016/j.biopsych.2022.12.015.
- ↑ Ogawa, Junko; Pao, Gerald M.; Shokhirev, Maxim N.; Verma, Inder M. (2018-04). Glioblastoma Model Using Human Cerebral Organoids. Cell Reports. Т. 23, № 4. с. 1220—1229. doi:10.1016/j.celrep.2018.03.105.
- ↑ Linkous, Amanda; Balamatsias, Demosthenes; Snuderl, Matija; Edwards, Lincoln; Miyaguchi, Ken; Milner, Teresa; Reich, Batsheva; Cohen-Gould, Leona; Storaska, Andrew (2019-03). Modeling Patient-Derived Glioblastoma with Cerebral Organoids. Cell Reports. Т. 26, № 12. с. 3203—3211.e5. doi:10.1016/j.celrep.2019.02.063.
- ↑ Jacob, Fadi; Salinas, Ryan D.; Zhang, Daniel Y.; Nguyen, Phuong T.T.; Schnoll, Jordan G.; Wong, Samuel Zheng Hao; Thokala, Radhika; Sheikh, Saad; Saxena, Deeksha (2020-01). A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity. Cell. Т. 180, № 1. с. 188—204.e22. doi:10.1016/j.cell.2019.11.036.
- ↑ Ballabio, Claudio; Anderle, Marica; Gianesello, Matteo; Lago, Chiara; Miele, Evelina; Cardano, Marina; Aiello, Giuseppe; Piazza, Silvano; Caron, Davide (29 січня 2020). Modeling medulloblastoma in vivo and with human cerebellar organoids. Nature Communications (англ.). Т. 11, № 1. с. 583. doi:10.1038/s41467-019-13989-3.
- ↑ Ballabio, Claudio; Gianesello, Matteo; Lago, Chiara; Okonechnikov, Konstantin; Anderle, Marica; Aiello, Giuseppe; Antonica, Francesco; Zhang, Tingting; Gianno, Francesca (25 червня 2021). Notch1 switches progenitor competence in inducing medulloblastoma. Science Advances (англ.). Т. 7, № 26. doi:10.1126/sciadv.abd2781.
- ↑ Magill, Stephen T.; Vasudevan, Harish N.; Seo, Kyounghee; Villanueva-Meyer, Javier E.; Choudhury, Abrar; John Liu, S.; Pekmezci, Melike; Findakly, Sarah; Hilz, Stephanie (23 вересня 2020). Multiplatform genomic profiling and magnetic resonance imaging identify mechanisms underlying intratumor heterogeneity in meningioma. Nature Communications (англ.). Т. 11, № 1. с. 4803. doi:10.1038/s41467-020-18582-7.
- ↑ Chan, Henry Siu Cheung; Ng, Ho Keung; Chan, Aden Ka-Yin; Cheng, Sau Ha; Chow, Chit; Wong, Nathalie; Wong, George Kwok Chu (2021-12). Establishment and characterization of meningioma patient-derived organoid. Journal of Clinical Neuroscience. Т. 94. с. 192—199. doi:10.1016/j.jocn.2021.10.035.
- ↑ Yamazaki, Shintaro; Ohka, Fumiharu; Hirano, Masaki; Shiraki, Yukihiro; Motomura, Kazuya; Tanahashi, Kuniaki; Tsujiuchi, Takashi; Motomura, Ayako; Aoki, Kosuke (2 липня 2021). Newly established patient-derived organoid model of intracranial meningioma. Neuro-Oncology. Т. 23, № 11. с. 1936—1948. doi:10.1093/neuonc/noab155.
- ↑ Antonica, Francesco; Aiello, Giuseppe; Soldano, Alessia; Abballe, Luana; Miele, Evelina; Tiberi, Luca (2022). Modeling Brain Tumors: A Perspective Overview of in vivo and Organoid Models. Frontiers in Molecular Neuroscience. Т. 15. doi:10.3389/fnmol.2022.818696.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Khan, Syamantak; Shin, June Ho; Ferri, Valentina; Cheng, Ning; Noel, Julia E.; Kuo, Calvin; Sunwoo, John B.; Pratx, Guillem (7 жовтня 2021). High-resolution positron emission microscopy of patient-derived tumor organoids. Nature Communications (англ.). Т. 12, № 1. doi:10.1038/s41467-021-26081-6.
- ↑ Harbuzariu, Adriana; Pitts, Sidney; Cespedes, Juan Carlos; Harp, Keri Oxendine; Nti, Annette; Shaw, Andrew P.; Liu, Mingli; Stiles, Jonathan K. (16 грудня 2019). Modelling heme-mediated brain injury associated with cerebral malaria in human brain cortical organoids. Scientific Reports (англ.). Т. 9, № 1.


 French
French Deutsch
Deutsch